1. Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
2. Shandong Provincial Center for Disease Control and Prevention, Jinan 250014, Shandong, China;
3. Beijing Friendship Hospital, Beijing 100050, China
Cloning and expression of mtlD encoding mannitol-1-phosphate dehydrogenase of Vibrio cholerae
LIANG Wei-li1, CHEN Bao-li1,2, ZHAO Meng1, ZHOU Yan-yan1,3, KAN Biao1
Abstract
Objective To clone and express the mtlD gene encoding mannitol-1-phosphate dehydrogenase from Vibrio cholerae mannitol specific PTS operon. Methods PCR was conducted to amplify the mtlD gene with the chromosome of N16961 as template. The PCR product was cloned as NdeⅠ-XhoⅠ fragment into the expression vector pET-30a. The mtlD expression was induced with 0.1 mmol/L IPTG, the cell lysis supernatant treated with sonication was purified with Ni-NTA affinity column. The enzyme activity was tested with chromometry assay. Results mtlD was successfully cloned into pET-30a and expressed in the E.coli host cell BL21. The purified MtlD protein containing 6×His-tag at its carboxyl terminus showed specific enzyme activity. Conclusion Mannitol-1-phosphate dehydrogenase of V. cholerae was functionally expressed in E. coli as a His-tagged recombinant protein and purified to homogeneity, which severed as the basis for further function study.
霍乱弧菌甘露醇-1-磷酸脱氢酶基因mtlD的克隆表达
梁未丽1, 陈保立1,2, 赵萌1, 周妍妍1,3, 阚飙1
1. 中国疾病预防控制中心传染病预防控制所, 北京 102206;
2. 山东省疾病预防控制中心, 山东 济南 250014;
3. 北京友谊医院, 北京 100050
2. 山东省疾病预防控制中心, 山东 济南 250014;
3. 北京友谊医院, 北京 100050
收稿日期:2014-2-10
基金项目:国家自然科学基金(No. 81171640)
通讯作者:梁未丽,Tel:010-58900744,Email:liangweili@icdc.cn
摘要
目的 克隆表达霍乱弧菌甘露醇特异性磷酸烯醇式丙酮酸依赖的磷酸转移酶系统操纵子中的甘露醇-1-磷酸脱氢酶基因mtlD。方法 以测序株N16961染色体为模板,聚合酶链反应(polymerase chain reaction,PCR)扩增mtlD基因,扩增产物经NdeⅠ和XhoⅠ酶切后克隆入表达载体pET-30a。0.1 mmol/L IPTG 诱导表达,超声裂解上清经Ni柱亲和层析纯化,比色法测定酶活性。结果 mtlD 基因成功克隆入表达载体pET-30a,在宿主菌BL21中诱导表达,利用Ni亲和层析柱获得较高纯度的羧基端带His标签的MtlD蛋白,并具有酶活性。结论 表达纯化了有活性的霍乱弧菌甘露醇-1-磷酸脱氢酶,为进一步的功能研究打下了基础。
内容大纲
-
1 材料与方法
- 1.1 实验用菌株和质粒
- 1.2 主要试剂和仪器
- 1.3 基因扩增和克隆
- 1.4 MtlD-His融合蛋白表达分析
- 1.5 MtlD酶活性检测
- 2.1 重组质粒pET-30a-mtlD的构建
- 2.2 MtlD的表达与纯化
- 2.3 MtlD脱氢酶活性检测
霍乱弧菌是引起急性肠道传染病——霍乱的病原体,广泛分布于海洋、江河、湖泊等自然水体中。霍乱弧菌能够发酵和利用甘露醇,并且产毒株和非产毒株利用甘露醇的速率不同,表现在产毒株为慢发酵,非产毒株为快发酵,从而在霍乱致病株的快速判断中有重要的参考价值[7]。霍乱弧菌中负责甘露醇转运和代谢的mtl操纵子包括mtlA (VCA1045)、mtlD (VCA1046) 和mtlR (VCA1047) 三个基因,其中mtlA编码甘露醇膜转运蛋白(酶Ⅱ),mtlD编码甘露醇-1-磷酸脱氢酶,mtlR编码抑制性调节蛋白。甘露醇在霍乱弧菌的致病及环境生存中的意义还不清楚,Mustachio 等[8]认为霍乱弧菌通过转运宿主肠道的甘露醇可能利于其适应肠道渗透压并定殖,水生环境中的甘露醇利于霍乱弧菌在自然界的生存。mtlD编码的甘露醇-1-磷酸脱氢酶将转运进入胞内的甘露醇-1-磷酸氧化为果糖-6-磷酸,进而进入果糖代谢途径,是甘露醇分解代谢的关键酶,为进一步了解甘露醇-1-磷酸脱氢酶的生化特性和功能及探究甘露醇和甘露醇特异的PTS操纵子在霍乱弧菌致病和环境存活等方面的生理意义,笔者克隆表达了mtlD基因,并初步测定了纯化的表达产物甘露醇-1-磷酸脱氢酶的酶活性,为后续研究打下了基础。
1 材料与方法
1.1 实验用菌株和质粒霍乱弧菌全基因组测序株N16961为科室保存,以其染色体基因组为模板扩增mtlD基因。大肠埃希菌BL21(λDE3)(科室保存) 用作纯化表达mtlD的重组质粒的宿主细胞,pET-30a(Novagen载体)为克隆表达载体。
1.2 主要试剂和仪器
Ni-NTA His.Bind Resin 用于纯化带His标签的表达蛋白,为MERCK Novagen & Calbiochem 产品,限制性内切酶、Taq DNA polymerase、dNTP、及Solution I 快速连接试剂盒均为TaKaRa宝生物工程(大连)有限公司产品。抗His标签抗体和HRP标记的羊抗鼠二抗购自北京中杉金桥生物技术有限公司,HRP显色液、聚合酶链反应(PCR)产物纯化和质粒提取试剂盒购自天根生化科技(北京)有限公司。甘露醇-1-磷酸钡盐由日本筑波大学(university of tsukuba) 的Yoshihiro Shiraiwa 教授惠赠,NAD购自上海生工生物工程股份有限公司,PCR扩增特异性引物由上海生工合成,LB和LBA培养基按常规配置,卡那霉素 (Kan) 按终浓度 30 μg/ml加入, IPTG 诱导浓度0.1 mmol/L。
PCR扩增仪为MJ公司的PTC200,凝胶成像仪为Bio-Rad Gel Doc XR系统。紫外可见分光光度计为美国UNICO公司的WEZUV-2102型产品。超声破碎仪为SONICS & MATERIALS公司产品,聚丙烯酰胺凝胶电泳仪及湿转印装置为Bio-Rad公司产品。
1.3 基因扩增和克隆
1.3.1 模板制备
用接种环挑取单菌落于60 μl去离子水中,煮8 min,冰浴10 min,12 000 r/min离心5 min取上清。
1.3.2 扩增引物
mtlD引物的5′端和3′端分别加有NdeⅠ和XhoⅠ酶切位点,见划线处。mtlD-up-NdeⅠ:5′-CGC CAT ATG AAA AAG AAT GCA GTT CAT TT-3′,mtlD-dn-XhoⅠ:5′-CCG CTC GAG ATC CAT CTG TTG GTA GAG AG 3′,扩增产物长1152 bp,扩增参数:94 ℃预变性4 min;94 ℃ 30 s;58 ℃ 30 s;72 ℃ 1 min,30个循环;最后72 ℃延伸6 min。
1.3.3 克隆转化
经NdeⅠ和XhoⅠ酶切纯化后的mtlD PCR产物和pET-30a按2 ∶ 1的摩尔比在Solution Ⅰ 连接体系中16 ℃连接2 h,连接产物转化BL21(λDE3)感受态细胞,涂布Kanr LBA平板,37 ℃培养过夜,菌落PCR鉴定阳性克隆,提取质粒酶切验证并测序核实。
1.4 MtlD-His融合蛋白表达分析
从37 ℃培养过夜的Kanr LBA平板上挑取阳性克隆子pET-30a-mtlD/BL21单菌落至 Kanr LB中,37 ℃培养至对数生长期,加IPTG(终浓度为0.1 mmol/L)37 ℃诱导2 h,SDS-PAGE检测诱导前后目标蛋白表达情况,以空载体pET-30a/BL21为对照,并用His的标签抗体进一步确定MtlD-His的特异性融合表达。
挑取表达阳性的单克隆扩大诱导培养3 h,离心集菌弃上清,菌体沉淀用适量1×Ni-NTA Binding buffer (50 mmol/L磷酸钠缓冲液, 300 mmol/L NaCl, 10 mmol/L 咪唑,pH 8.0) 重悬,在冰水浴中超声破碎细菌至菌悬液呈半透明(超声功率26%,超3 s,停12 s),4 ℃ 12 000 r/min离心20 min,去除细菌碎片;离心后上清用0.45 μm滤膜过滤备用。
Ni-NTA His·Bind Resin的装柱,平衡,蛋白结合及洗脱过程参照蛋白纯化试剂盒说明进行。分管收集的洗脱液用SDS-PAGE电泳检测是否含有目的蛋白,将含有目的蛋白纯度及浓度均比较高的洗脱液合并,置于Tris缓冲液(10 mmol/L Tris-HCl, pH 8.0, 0.1% Triton X-100) 4 ℃透析过夜去除咪唑,超滤管超滤浓缩备用。
1.5 MtlD酶活性检测
MtlD的甘露醇-1-磷酸脱氢酶的活性测定参照文献[9],在室温(25 ℃)条件下测定以甘露醇-1-磷酸为底物时NADH的形成,紫外分光光度计在340 nm处检测反应体系吸光度值的变化。在1 ml的反应体系中包括200 mmol/L甘露醇-1-磷酸钡盐10 μl,100 mmol/L NAD 10 μl,700 mmol/L Tris-HCl (pH 9.0) 100 μl,纯化的mtlD 10 μg,用双蒸水补足1 ml,平行检测3个样,以340 nm波长处底物甘露醇-1-磷酸钡盐加入前反应体系的吸光度值为空白,记录加入底物后5 min的时间间隔中反应体系的吸光度值的增加。
2 结果
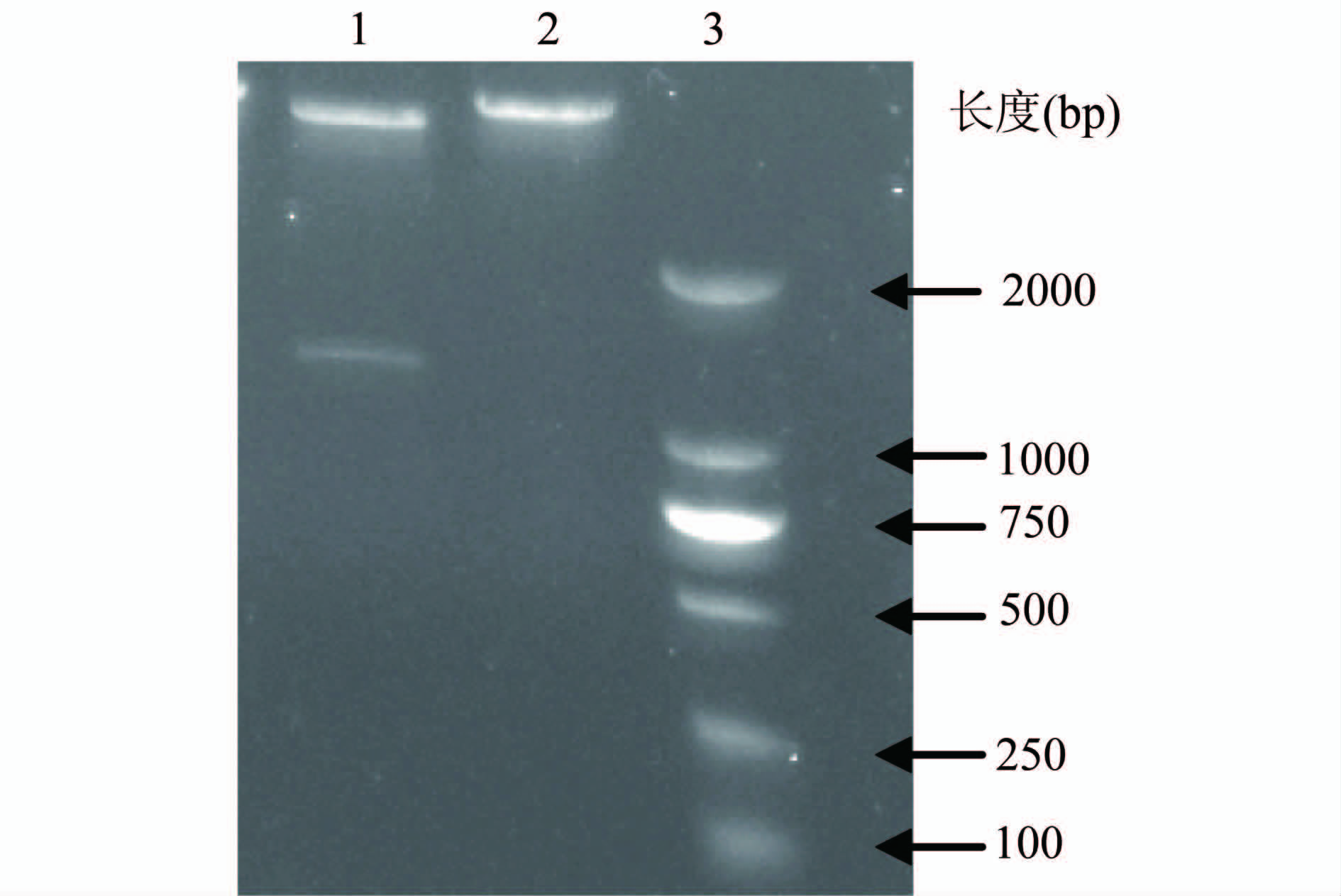
2.1 重组质粒pET-30a-mtlD的构建 以霍乱弧菌全基因组测序株N16961染色体DNA为模板,PCR扩增mtlD基因,克隆入表达载体pET-30a(+) 的NdeⅠ和XhoⅠ酶切位点之间,菌落PCR筛选阳性重组子,并经酶切鉴定(图1)和测序验证。mtlD扩增下游引物序列起始于mtlD终止密码子TGA的前面,不包括该终止密码子。测序验证结果表明重组质粒pET-30a-mtlD中的插入片段为甘露醇PTS操纵子中的mtlD基因,其3′端带有6x His,二者形成融合蛋白。
图1 重组质粒pET-30a-mtlD酶切鉴定
Figure 1 Enzyme digestion of recombinant plasmid pET-30a-mtlD 注:1. pET-30a-mtlD/NdeⅠ+XhoⅠ; 2. pET-30a/NdeⅠ+XhoⅠ; 3. DL2000 Marker。
2.2 MtlD的表达与纯化
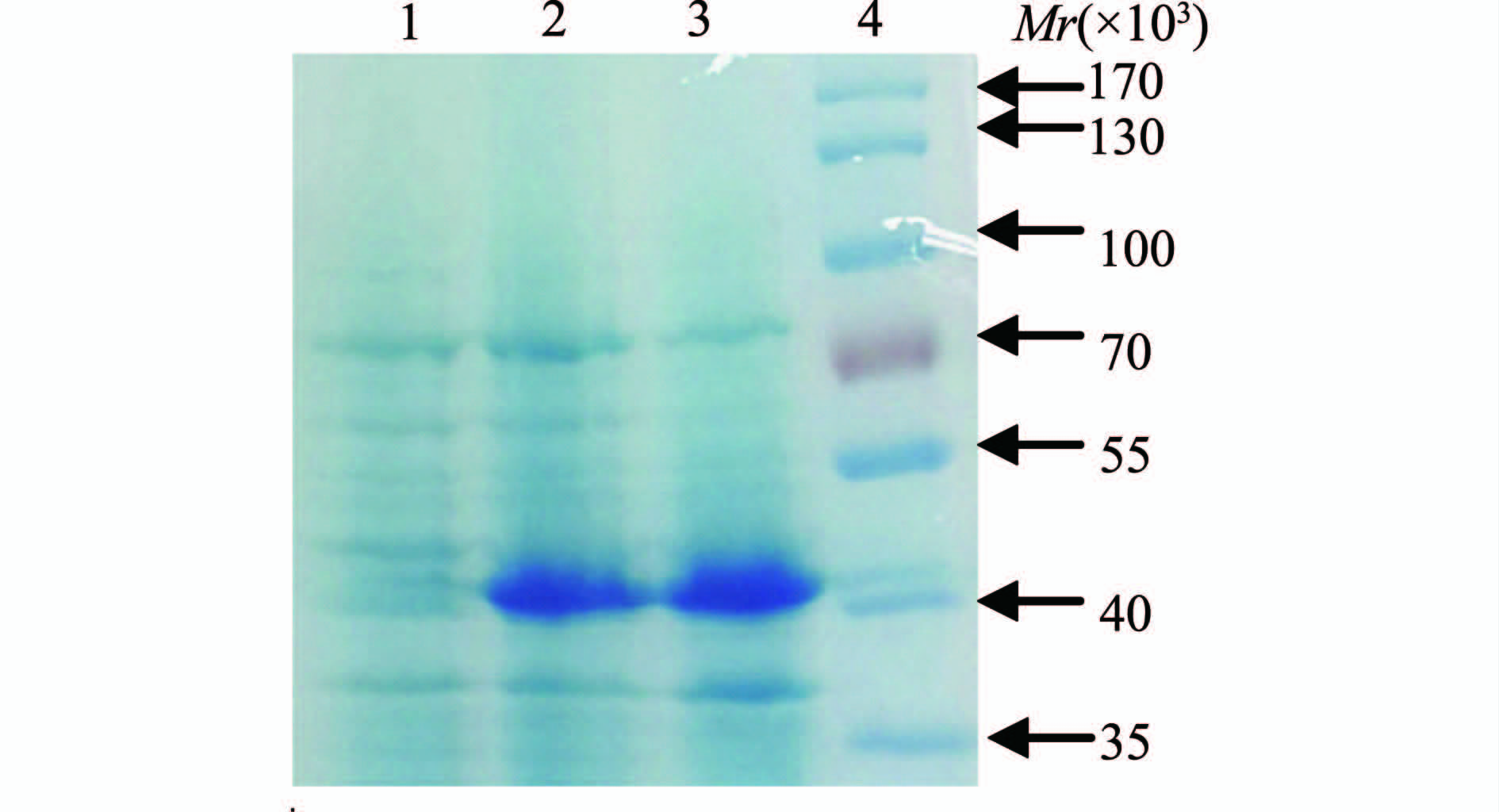
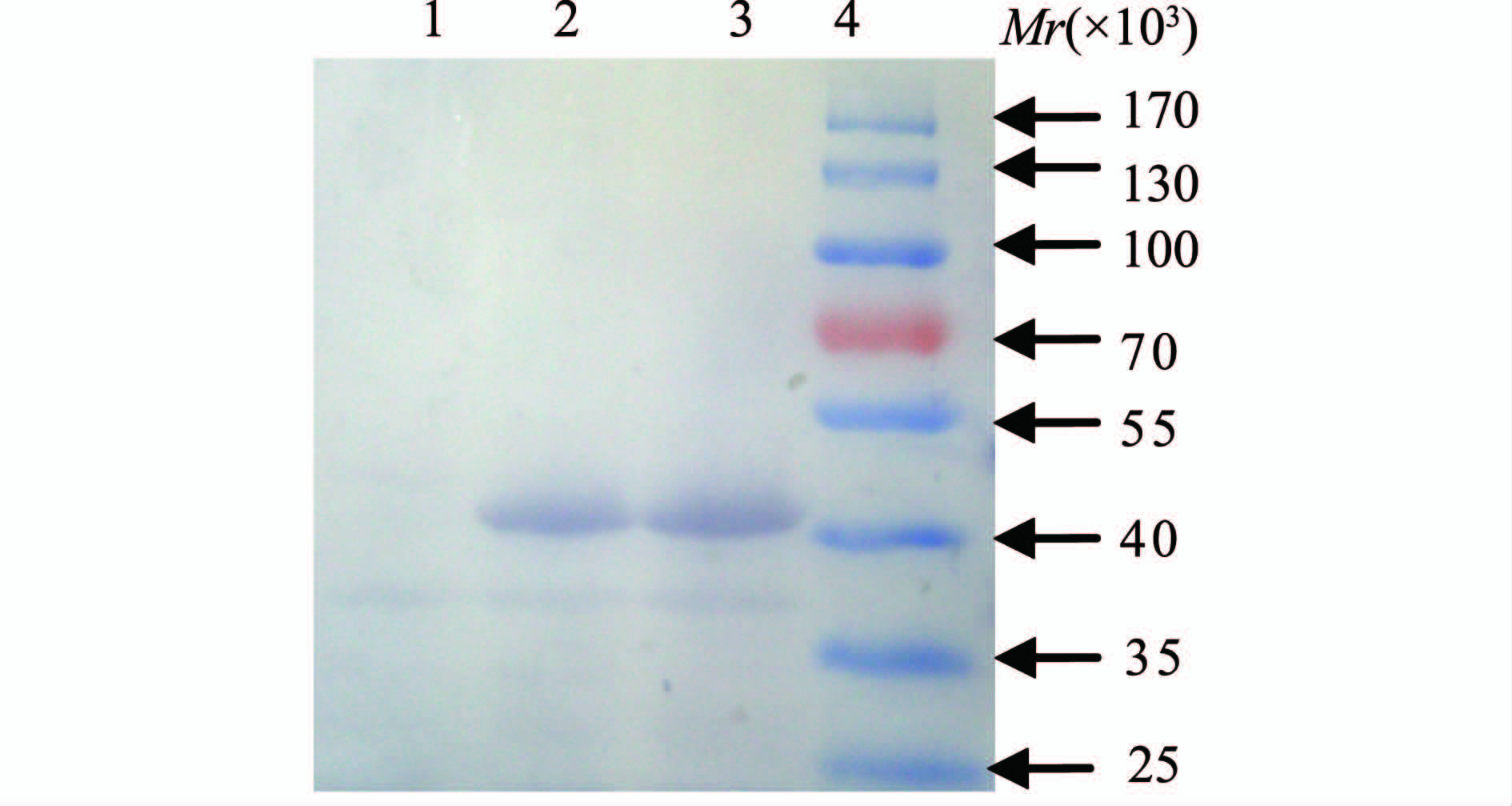
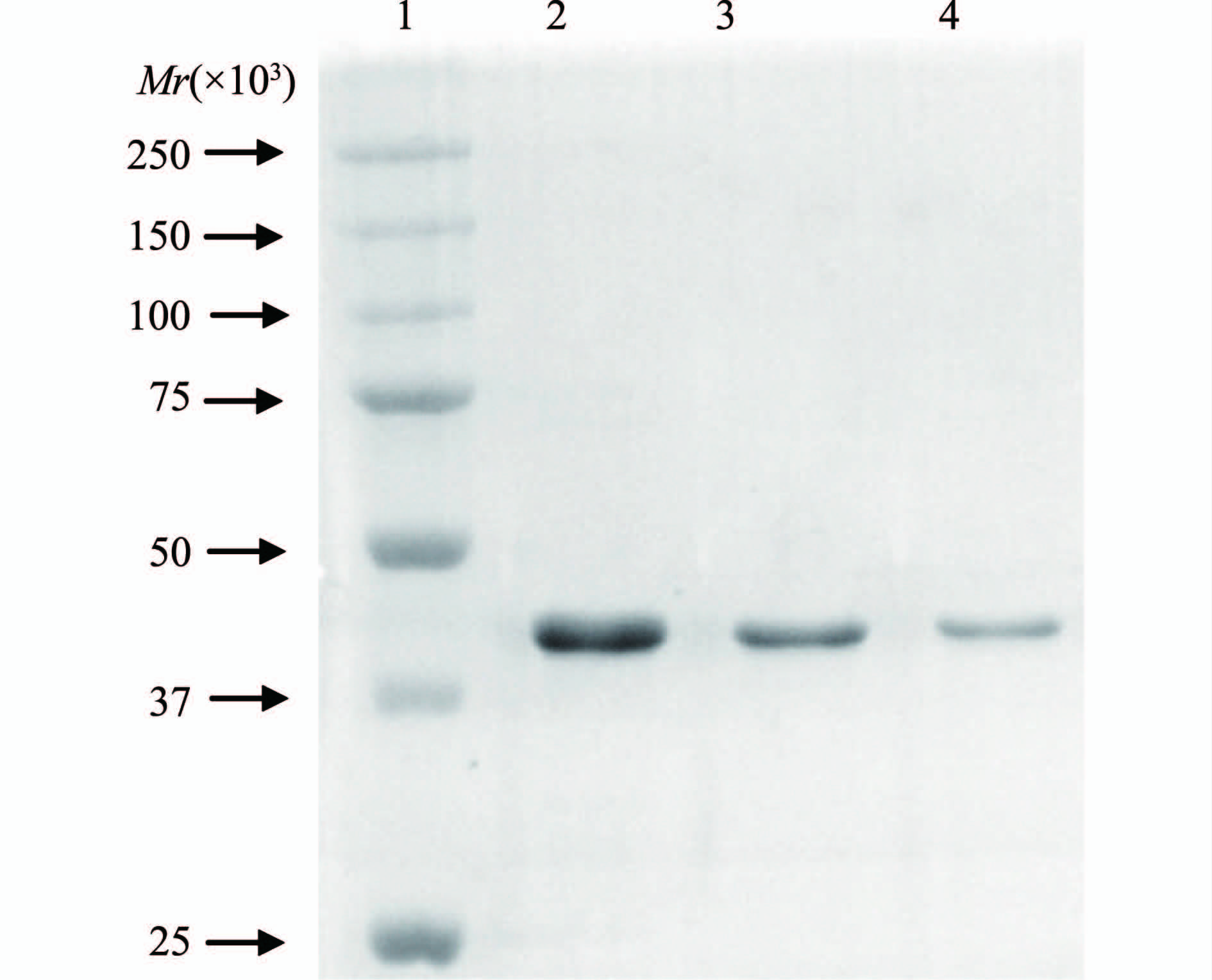
序列分析表明羧基端带His·Tag的mtlD融合基因表达一个390个氨基酸的融合蛋白,预测大小为43×103。图2显示,相同培养条件下pET-30a-mtlD/BL21比pET-30a/BL21在40×103 Marker条带处出现多出一条明显的外源蛋白表达条带,进一步的Westen-blot检测表示,该蛋白条带带有His标签,大小完全符合MtlD-His融合蛋白的大小(图3)。大体积诱导后菌体沉淀的超声裂解上清经镍柱亲和层析纯化,图4显示纯化后的洗脱液中目的蛋白为高纯度的单一条带。
图2 诱导前后mtlD表达检测
Figure 2 Detection of mtlD expression before and after inducement 注:1. pET-30a/BL21; 2. pET-30a-mtlD/BL21诱导前;3. pET-30a-mtlD/BL21诱导后; 4.蛋白Marker。
图3 Werstern-blot检测MtlD-His融合表达
Figure 3 Detection of mix expression of MtlD-His with Western-blot 注:1. pET-30a/BL21; 2. pET-30a-mtlD/BL21诱导前; 3. pET-30a-mtlD/BL21诱导后; 4.蛋白Marker。
图4 纯化后MtlD 12% SDS-PAGE 电泳检测
Figure 4 Electrophoresis detection of purified MtlD 12% SDS-PAGE 注:1:蛋白Marker; 2~4:纯化的6xHis-MtlD蛋白。
2.3 MtlD脱氢酶活性检测
MtlD的酶活性即可体现在对6-磷酸果糖的还原能力,也可反映在对甘露醇-1-磷酸的氧化能力,此过程中伴随NAD或 NADH的生成。笔者以甘露醇-1-磷酸的钡盐为底物,检测了纯化的表达产物在氧化底物过程中还原NAD生成NADH所引起的吸光度的升高,加入底物前和加入底物后5 min的时间间隔中反应体系在340 nm波长处的吸光度值升高了0.4±0.03,说明表达纯化的MtlD具有氧化甘露醇-1-磷酸的酶活性。
3 讨论
本研究克隆表达了霍乱弧菌甘露醇PTS操纵子中的mtlD基因,以甘露醇-1-磷酸的钡盐为底物的酶活性测定实验表明,表达纯化的产物具有酶活性,能够特异性的氧化甘露醇-1-磷酸。国际上甘露醇发酵实验也被用作鉴定弧菌属细菌的一项重要生化指标[10];我国学者发现霍乱弧菌的产毒株和非产毒代谢甘露醇的能力不同,产毒株致病,能够在人群中引起霍乱的传播和流行,非产毒株一般不致病或仅引起个体感染;产毒株慢发酵甘露醇,非产毒株快发酵甘露醇[7]。目前甘露醇代谢差异在两类菌株致病和存活中的具体生理意义还不清楚。在创伤弧菌中甘露醇的发酵表型也与菌株毒力有相关性[11],我们前期基于mRNA转录水平的研究表明,产毒株(慢发酵株)中甘露醇特异的mtl 操纵子的转录水平低于非产毒株(快发酵株)[12],本研究中获得的纯化表达的MtlD蛋白为进一步了解MtlD的生化特性奠定了基础,通过制备特异性的MtlD抗体也有助于我们从蛋白水平了解两类菌株甘露醇代谢差异的机制,进一步研究不同的生长、胁迫条件下甘露醇特异性PTS操纵子的表达水平,从而推测其对菌株致病和生存可能的作用和意义。
参考文献
[1] Iwamoto K, Kawanobe H, Ikawa T, et, al. Characterization of salt-regulated mannitol-1-phosphate dehydrogenase in the red alga Caloglossa continua[J]. Plant Physiol, 2003, 133(2):893-900.
[2] Wolff JB, Kaplan NO. D-Mannitol 1-phosphate dehydrogenase from Escherichia coli[J]. J Biol Chem, 1956, 218(2):849-869.
[3] Jennings DH. Polyol metabolism in fungi[J]. Adv Microb Physiol, 1984, 25:149-193.
[4] Stoop JM, Mooibroek H. Cloning and characterization of NADP-mannitol dehydrogenase cDNA from the button mushroom, Agaricus bisporus, and its expression in response to NaCl stress[J]. Appl Environ Microbiol, 1998, 64(12):4689-4696.
[5] Suvarna K, Bartiss A, Wong B. Mannitol-1-phosphate dehydrogenase from Cryptococcus neoformans is a zinc-containing long-chain alcohol/polyol dehydrogenase[J]. Microbiology, 2000, 146 (Pt 10):2705-2713.
[6] Kumar S, Smith KP, Floyd JL, et al. Cloning and molecular analysis of a mannitol operon of phosphoenolpyruvate-dependent phosphotransferase (PTS) type from Vibrio cholerae O395[J]. Arch Microbiol, 2011, 193(3):201-208.
[7] Wang HY, Yan MY, Zhao YW, et al. Transcriptional repressor gene-mtlR of mannitol PTS operon in Vibrio cholerae[J]. Acta Microbiologica Sinica, 2007, 47(3):522-525. (in Chinese) 王海燕, 闫梅英, 赵英伟, 等. 霍乱弧菌甘露醇PTS 操纵子中mtlR为转录抑制基因[J]. 微生物学报, 2007, 47(3):522-525.
[8] Mustachio LM, Aksit S, Mistry RH, et al. The Vibrio cholerae mannitol transporter is regulated posttranscriptionally by the MtlS small regulatory RNA[J]. J Bacteriol, 2012, 194(3):598-606.
[9] Horwitz SB, Kaplan NO. Hexitol Dehydrogenases of Bacillus Subtilis[J]. J Biol Chem, 1964, 239:830-838.
[10] West PA, Colwell RR. Identification and classification of Vibrionaceae-an overview[M]//Colwell RR.Vibrios in the environment. Wiley:New York, 1984: 285-363.
[11] Drake SL, Whitney B, Levine JF, et al. Correlation of mannitol fermentation with virulence-associated genotypic characteristics in Vibrio vulnificus isolates from oysters and water samples in the Gulf of Mexico[J]. Foodborne Pathog Dis, 2010, 7(1):97-101.
[12] Wang HY, Zheng X, Lou J, et al. Comparison of the transcriptional levels of mannitol PTS operon between epidemic and non-epidemic strains of Vibrio cholerae[J].Acta Academiae Medicinae Sinicae, 2009, 31(1):51-54. (in Chinese) 王海燕, 郑霄, 娄静, 等.霍乱弧菌两类菌株甘露醇发酵过程中PTS操纵子转录水平差异分析[J].中国医学科学院学报, 2009, 31(1):51-54.
[2] Wolff JB, Kaplan NO. D-Mannitol 1-phosphate dehydrogenase from Escherichia coli[J]. J Biol Chem, 1956, 218(2):849-869.
[3] Jennings DH. Polyol metabolism in fungi[J]. Adv Microb Physiol, 1984, 25:149-193.
[4] Stoop JM, Mooibroek H. Cloning and characterization of NADP-mannitol dehydrogenase cDNA from the button mushroom, Agaricus bisporus, and its expression in response to NaCl stress[J]. Appl Environ Microbiol, 1998, 64(12):4689-4696.
[5] Suvarna K, Bartiss A, Wong B. Mannitol-1-phosphate dehydrogenase from Cryptococcus neoformans is a zinc-containing long-chain alcohol/polyol dehydrogenase[J]. Microbiology, 2000, 146 (Pt 10):2705-2713.
[6] Kumar S, Smith KP, Floyd JL, et al. Cloning and molecular analysis of a mannitol operon of phosphoenolpyruvate-dependent phosphotransferase (PTS) type from Vibrio cholerae O395[J]. Arch Microbiol, 2011, 193(3):201-208.
[7] Wang HY, Yan MY, Zhao YW, et al. Transcriptional repressor gene-mtlR of mannitol PTS operon in Vibrio cholerae[J]. Acta Microbiologica Sinica, 2007, 47(3):522-525. (in Chinese) 王海燕, 闫梅英, 赵英伟, 等. 霍乱弧菌甘露醇PTS 操纵子中mtlR为转录抑制基因[J]. 微生物学报, 2007, 47(3):522-525.
[8] Mustachio LM, Aksit S, Mistry RH, et al. The Vibrio cholerae mannitol transporter is regulated posttranscriptionally by the MtlS small regulatory RNA[J]. J Bacteriol, 2012, 194(3):598-606.
[9] Horwitz SB, Kaplan NO. Hexitol Dehydrogenases of Bacillus Subtilis[J]. J Biol Chem, 1964, 239:830-838.
[10] West PA, Colwell RR. Identification and classification of Vibrionaceae-an overview[M]//Colwell RR.Vibrios in the environment. Wiley:New York, 1984: 285-363.
[11] Drake SL, Whitney B, Levine JF, et al. Correlation of mannitol fermentation with virulence-associated genotypic characteristics in Vibrio vulnificus isolates from oysters and water samples in the Gulf of Mexico[J]. Foodborne Pathog Dis, 2010, 7(1):97-101.
[12] Wang HY, Zheng X, Lou J, et al. Comparison of the transcriptional levels of mannitol PTS operon between epidemic and non-epidemic strains of Vibrio cholerae[J].Acta Academiae Medicinae Sinicae, 2009, 31(1):51-54. (in Chinese) 王海燕, 郑霄, 娄静, 等.霍乱弧菌两类菌株甘露醇发酵过程中PTS操纵子转录水平差异分析[J].中国医学科学院学报, 2009, 31(1):51-54.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 梁未丽 | |
| 陈保立 | |
| 赵萌 | |
| 周妍妍 | |
| 阚飙 | |
| PubMed | |
| Article by LIANG Wei-li | |
| Article by CHEN Bao-li | |
| Article by ZHAO Meng | |
| Article by ZHOU Yan-yan | |
| Article by KAN Biao | |