1. Beijing Municipal Center for Disease Prevention and Control, Beijing 100013, China;
2. International Travel Health Care Center, Entry and Exit Inspection and Quarantine Bureau of Hebei Province, Shijiazhuang 050091, Heibei, China
Evaluation on performance of five routine rotavirus detection assays and application strategies
LUO Ming1, GONG Cheng1, SHI Ling-li2, WU Jiang1, ZHANG He-run1, WANG Yu-mei1, GAO Zhi-yong1, HUANG Fang1
Abstract
Objective To evaluate the performance of five routine rotavirus detection assays-gold Immunochromatography assay (GICA), enzyme-linked immuno sorbent assay (ELISA), reverse transcriptase polymerase chain reaction (RT-PCR), real-time RT PCR and polyacrylamide gel electrophoresis (PAGE). Methods First, one rotavirus group A positive sample was 10-fold serially diluted from 1×101 fold to 1×108 fold and tested by above mentioned assays for lower limit of detection (LLD) evaluation. Second, nine samples, which were confirmed to be rotavirus negative, of poliovirus vaccine strain type Ⅰ to Ⅲ, enterovirus 71, coxsackie virus A16, ECHO virus 6, norovirus type Ⅰ, norovirus type Ⅱ and astrovirus were used to evaluate the specificities of the five assays. Third, a total of 184 infantile diarrhea stool samples were collected and tested with the five assays for sensitivity and specificity evaluation. Results The LLDs of the five assays were different from each other by five orders of magnitude, i.e. 10-6 dilution for real-time RT PCR,10-3 dilution for GICA,10-2 dilution for ELISA and PAGE and 10-1 dilution for RT-PCR. The five assays had no cross reactions to the negative control samples. Based on the PAGE detection results of the clinical samples, the sensitivity was 95.45% for real-time RT-PCR,93.94% for GICA,96.97% for ELISA and 62.12% for RT-PCR, and the specificity was 82.20% for real-time RT-PCR,86.44% for GICA,82.20% for ELISA, 94.07% for RT-PCR. Conclusion PAGE, the classic assay for rotavirus detection, had the highest specificity and would be the best choice for the laboratory confirmation. Real time RT-PCR showed higher sensitivity and specificity than the other assays and could be used for the high throughout detection of rotavirus group A. GICA and ELISA assay are good screening assays because of their low cost. RT-PCR was proved to be with high specificity but low sensitivity and need improvement.
五种常用轮状病毒检测方法的评价及应用策略
罗明1, 龚成1, 史玲莉2, 吴疆1, 张合润1, 王玉梅1, 高志勇1, 黄芳1
1. 北京市疾病预防控制中心免疫预防所, 北京 100013;
2. 河北出入境检验检疫局国际旅行卫生保健中心, 河北 石家庄 050091
2. 河北出入境检验检疫局国际旅行卫生保健中心, 河北 石家庄 050091
收稿日期:2013-9-9
通讯作者:黄芳,Tel:010-64407032,Email:hhffxdd@126.com
摘要
目的 比较胶体金免疫层析法(GICA)、酶联免疫吸附试验(ELISA)、反转录-聚合酶链反应(RT-PCR)、实时荧光定量-反转录聚合酶链反应(real-time RT-PCR)和聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)5种常用的轮状病毒检测方法的准确性。方法 取A组轮状病毒阳性标本,经1×101~1×108 10倍系列稀释,采用上述5种方法平行检测,比较检测限;选择分别含有以下9种病原体且轮状病毒证实为阴性的粪便标本作为阴性对照:脊髓灰质炎病毒疫苗株Ⅰ~Ⅲ型、肠道病毒EV71、柯萨奇病毒A16、ECHO病毒6、诺如病毒Ⅰ型、诺如病毒Ⅱ型和星状病毒,采用上述5种方法平行检测,比较特异性;采用上述方法,分别对184例婴幼儿腹泻粪便标本进行检测,以PAGE检测结果作为参考标准,比较其余4种方法的灵敏度和特异性。结果 上述5种方法检测A组轮状病毒的检测限相差5个数量级,分别为:real-time RT-PCR法10-6稀释度,胶体金法10-3稀释度,ELISA和PAGE方法均为10-2稀释度,RT-PCR法10-1稀释度;5种方法对9种对照病原体均无交叉反应;以PAGE方法检测结果作为标准,real-time RT-PCR、 ELISA、胶体金和RT-PCR灵敏度分别为95.45%、96.97%、93.94%和62.12%,特异性分别为82.2%、86.44%、82.20%和94.07%。结论 PAGE作为检测轮状病毒的经典方法,具有高特异性,可用于确认实验;real-time RT-PCR方法检测A组轮状病毒的灵敏度优于其他4种方法,可用于轮状病毒的高通量检测;ELISA和胶体金方法具有良好的灵敏度与特异性,且胶体金方法成本低,可用于初筛检测;行业标准推荐的RT-PCR方法特异性较高,但灵敏度较低,有待改进。
内容大纲
1 材料与方法
1.1 标本
1.1.1 临床标本
2010年1月至2011年12月从北京市和平里医院、儿童医院收集184份儿童非细菌性腹泻(门诊/住院)病例的粪便标本,采集后及时冻存于-20 ℃,带冰状态下送往北京市疾病预防控制中心(CDC)免疫预防所实验室检测。病例纳入标准:每日排便3次或3次以上,且大便性状有改变(呈稀便、水样便等),大便常规镜检白细胞<15,未见红细胞的腹泻病例,或者病例表现为腹泻未达到3次/日,但伴有大便性状改变和呕吐症状,或以呕吐为主要症状[5]。
1.1.2 对照标本
选择与轮状病毒人体感染部位相似或者与感染后临床症状相似的病原微生物作为对照,包括脊髓灰质炎病毒疫苗株Ⅰ~Ⅲ型、肠道病毒EV71、柯萨奇病毒A16、ECHO病毒6、NOROⅠ病毒、NOROⅡ病毒、星状病毒,9种对照病原体阳性粪便标本由本实验室提供。
1.2 主要试剂和仪器
核酸提取采用QIAamp Viral RNA Mini Kit(德国,QIAGEN);RT-PCR检测采用SuperScriptTM Ⅲ One-Step RT-PCR System with Platinum Taq High Fidelity(美国,Life Technology);实时荧光定量-反转录聚合酶链反应(real-time ,RT-PCR)检测采用迅必达轮状病毒核酸检测试剂盒(北京,迅必达),在ABI 7500 fast实时荧光PCR仪(美国,Life Technology)上完成,ELISA检测采用ProSpecT Rotavirus Microplate Assay试剂盒(英国,OXOID公司),胶体金检测采用胶体金A组轮状病毒检测试剂盒(北京,万泰);PAGE检测采用BIO-RAD 垂直电泳系统(美国,BIO-RAD)。
1.3 标本处理和检测方法
1.3.1 标本处理
将粪便标本加到1.5 ml EP管中,加入标本处理液(PBS缓冲液),制备成10%的粪便悬液,振荡3次,每次10 s。然后静置10 min,再以8000 r/min离心5 min,吸取上清于-70 ℃保存[5]。
1.3.2 核酸提取
取粪便上清液,提取病毒RNA,操作按QIAamp Viral RNA Mini Kit试剂盒说明书。
1.3.3 检测方法
胶体金、酶联免疫吸附试验(ELISA)和real-time RT-PCR分别按照各自说明书操作。 聚丙烯酰胺凝胶电泳(PAGE)和 反转录-聚合酶链反应(RT-PCR)方法分别参照《感染性腹泻诊断标准》(WS 271 2007)附录B.6.2.2和B.6.3 [6]。
1.3.4 轮状病毒
RT-PCR根据病毒VP7基因的特异引物进行检测,序列分别为:Pr1 RV(+) GGT TAG CTC CTT TTA ATG TAT GGT;Pr2 RV(-) ACT GAT CCT GTT GGC CAT CC,片段大小为362 bp。
1.4 检测限评价
为比较5种方法的检测限,取1份经PAGE方法确认为A组轮状病毒的标本(标本编号2010MY-D110),用PBS缓冲液将其10倍系列稀释,从1×10-1倍稀释至1×10-8。用上述5种方法分别对其检测,重复3次,每种检测方法3次均能检测出的最大稀释倍数,即认为是这种检测方法检测A组轮状病毒的检测限。例:假如某方法可检测到的最大稀释倍数为10 000倍,则认为该方法的检测限为1×10-4,简记作-4。
1.5 对照标本评价
采用上述5种方法分别对9份对照标本进行平行检测,观察有无交叉反应。
1.6 临床标本评价
分别采用上述5种方法对184份临床标本进行检测,以PAGE检测结果作为参考标准,计算其余4种方法的灵敏度和特异性。
1.7 统计学分析
用SPSS 13.0进行统计分析,不同检测方法的一致性检验采用Kappa方法,不同检测方法检出率的差别比较采用McNemar方法。
2 结果
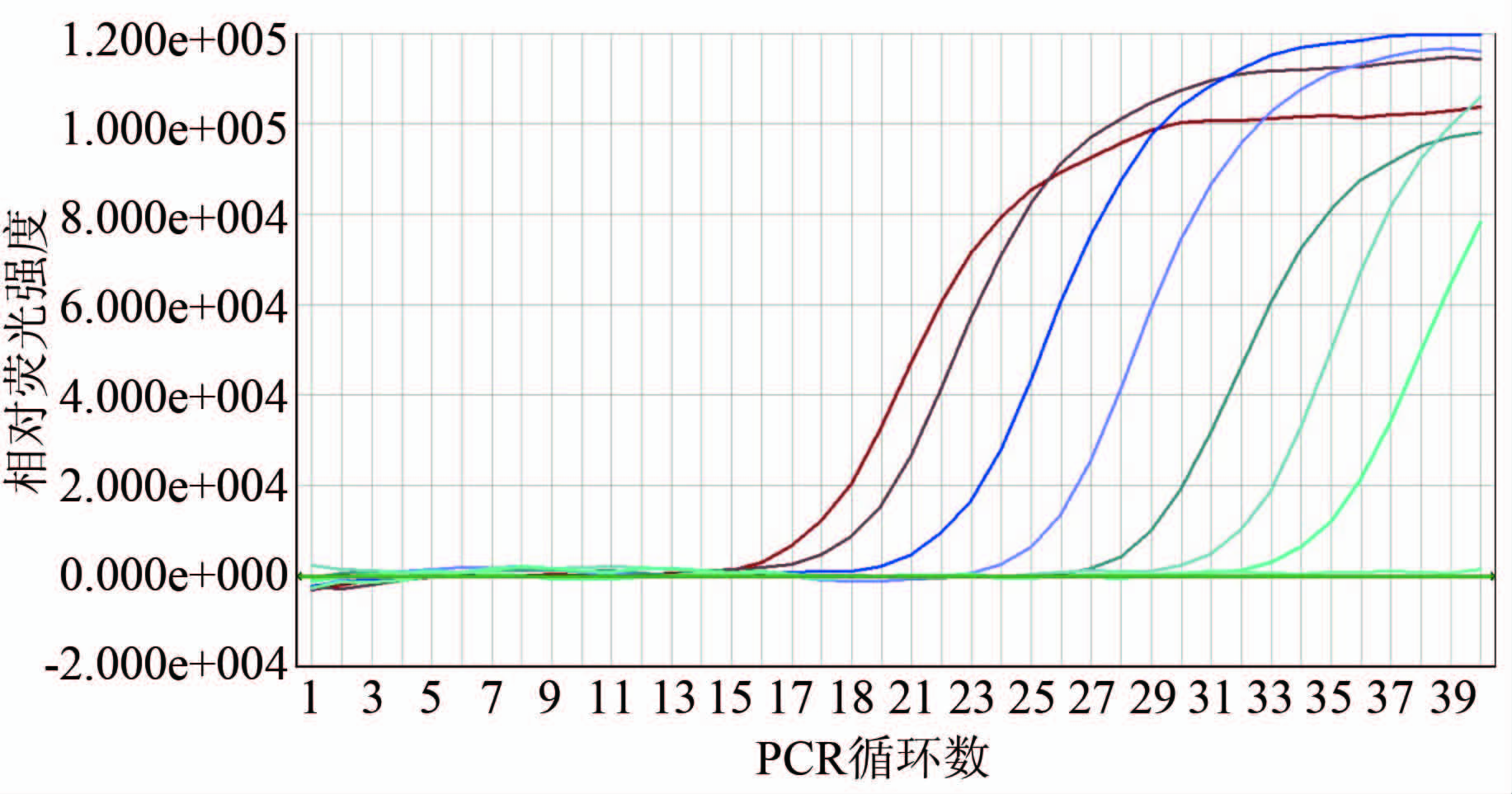
2.1 检测限评价 real-time RT-PCR检测限为10-6稀释度,远高于其余4种方法,见图1;胶体金检测限为10-3稀释度,比PAGE高10倍;ELISA与PAGE检测限均为10-2稀释度,见图2;RT-PCR方法检测限最低,仅达10-1稀释度,见图3。
图1 轮状病毒real-time RT-PCR检测方法检测限评价
Figure 1 Evaluation on detection limit of real-time RT-PCR nbsp; 注:real-time RT-PCR检测轮状病毒系列稀释液,从左至右,依次为原液、10-1~10-6稀释度扩增曲线。
图2 轮状病毒PAGE检测方法检测限评价
Figure 2 Evaluation on detection limit of PAGE 注: PAGE检测轮状病毒系列稀释液,从左至右9条泳道依次对应原液、10-1~10-8稀释度。
图3 轮状病毒RT-PCR检测方法检测限评价
Figure 3 Evaluation on detection limit of RT-PCR 注:RT-PCR检测轮状病毒系列稀释液,从左至右10条泳道依次对应分子质量标准、病毒原液、病毒10-1~10-6稀释液和阴性对照。
2.2 对照标本评价
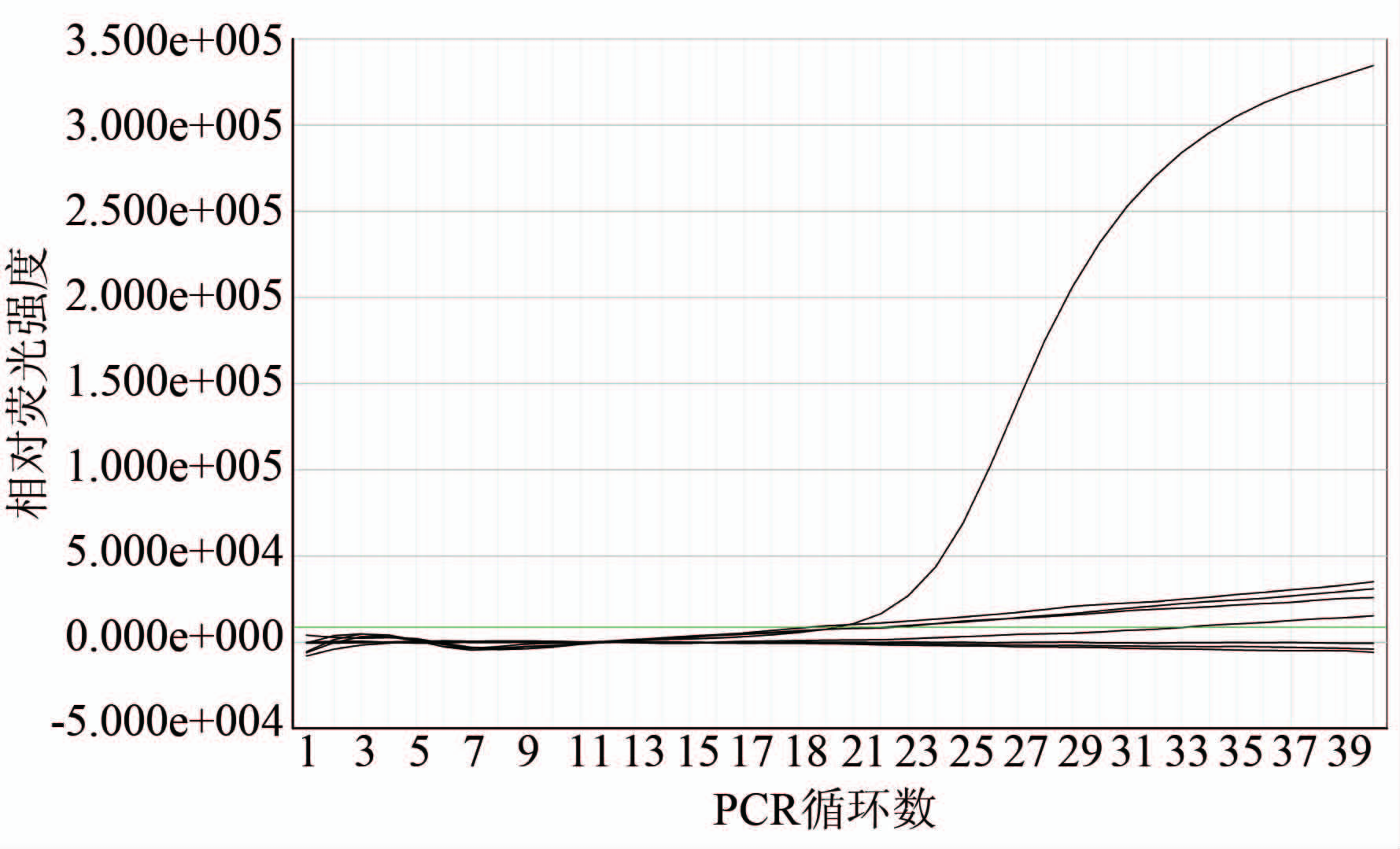
使用上述PAGE、胶体金、ELISA、RT-PCR以及real time RT-PCR 5种方法分别检测9份对照标本,结果均为阴性,见图4。
图4 轮状病毒real time RT-PCR检测方法特异性评价
Figure 4 Evaluation on specificity of real time RT-PCR 注:图中阳性扩增曲线为轮状病毒扩增曲线,9种对照病原体扩增均为阴性。
2.3 临床标本评价
本研究从184份标本中,PAGE共检出66例A组轮状病毒,1例B组轮状病毒,2例C组轮状病毒,A组轮状病毒阳性率为35.87%;real-time RT-PCR、胶体金和ELISA检测阳性率分别为45.65%、45.11%和43.48%,均高于PAGE; RT-PCR阳性率仅为26.09%,低于PAGE(表1)。5种检测方法中,real-time RT-PCR阳性率最高,见表1,与PAGE和与RT-PCR的检出率差异有统计学意义(Mcnemar test P=0.000)。
对于3例非A组轮状病毒(1例B组轮状病毒、2例C组轮状病毒),ELISA法出现2例假阳性(分别将1例B组轮状病毒和1例C组轮状病毒判为A组轮状病毒阳性)。
以PAGE检测结果作为参考标准,real-time RT-PCR、ELISA和胶体金灵敏度相当,分别为95.45%、96.97%和93.94%,RT-PCR灵敏度远低于前三者,仅为62.12%;real-time RT-PCR、ELISA和胶体金特异性也相近,分别为82.20%、86.44%和82.20%,RT-PCR特异性最高94.07%。
表1 5种常用轮状病毒检测方法检测临床标本结果
Table 1 Results of 5 assays in clinical sample detection
| 方法 | PAGE | 合计 | 阳性率(%) | 灵敏度(%) | 特异性(%) | ||||||
| 阳性 | 阴性 | ||||||||||
| PAGE | 阴性 | 66 | 0 | 66 | 35.87 | - | - | ||||
| 阳性 | 0 | 118 | 118 | ||||||||
| 胶体金 | 阴性 | 62 | 21 | 83 | 45.11 | 93.94 | 82.20 | ||||
| 阳性 | 4 | 97 | 101 | ||||||||
| ELISA | 阴性 | 64 | 16 | 80 | 43.48 | 96.97 | 86.44 | ||||
| 阳性 | 2 | 102 | 104 | ||||||||
| RT-PCR | 阴性 | 41 | 7 | 48 | 26.09 | 62.12 | 94.07 | ||||
| 阳性 | 25 | 111 | 136 | ||||||||
| real-time RT-PCR | 阴性 | 63 | 21 | 84 | 45.65 | 95.45 | 82.20 | ||||
| 阳性 | 3 | 97 | 100 | ||||||||
3 讨论
PAGE方法是轮状病毒检测的经典方法 ,具有不可替代的优势。PAGE直接对轮状病毒节段性RNA进行电泳,根据轮状病毒11个基因片段特殊分布图形进行判断,可实现A~G组轮状病毒的检测和鉴别[3];轮状病毒属于RNA病毒,容易发生变异,核酸变异可能导致PCR漏检,但不会造成PAGE方法漏检;扩增产物污染,可能导致PCR假阳性;粪便标本成分复杂,有些物质可抑制PCR反应导致假阴性,PAGE则不受这些因素限制;抗原之间交叉反应可能导致ELISA假阳性,不会对PAGE方法造成影响。综上所述,PAGE方法具有高特异性,被视为轮状病毒检测的金标准。
PAGE的局限性:基本只能手工操作,不易实现高通量检测,且无扩增过程,因此不如real-time RT-PCR方法敏感。在本研究中,PAGE检测限比real-time RT-PCR方法低104倍。以PAGE检测结果作为标准,评价其他4种方法的灵敏度和特异性,real-time RT-PCR、胶体金和ELISA特异性偏低,可能由于PAGE漏检部分病毒含量偏低的标本所致。
本研究发现real-time RT-PCR检测A组轮状病毒的检测限远高于其他4种方法,但检测临床标本时,其灵敏度和特异性与胶体金和ELISA相差并不大,推测本研究选取的184份临床标本病毒含量可能较高,不能对这3种方法检测能力的真实差异提供良好的区分度。提示需要收集更具代表性的样本,标本应该涵盖病程的轻中重,病情的早中晚,以及主要的GP分型,开展进一步评价。根据本研究的初步结果,real-time RT-PCR方法灵敏性高,且容易实现自动化,非常适合于快速检测和高通量检测[9],具有广泛的应用前景。
本研究中,胶体金检测限优于ELISA,与严寒秋等[10]报道一致,胶体金便携快速,数分钟即可获得检测结果,且成本较低,适用于快速筛查;ELSIA对9种对照病原体检测表现出很好的分析特异性,但本研究观察到ELISA将1例B组和1例C组轮状病毒标本均检测为A组轮状病毒,表明其在轮状病毒组间可能出现交叉反应,这可能与ELISA本身的局限性有关。上述2种方法,对仪器设备和检测人员技术水平的要求不高,适合在基层实验室或医疗机构推广应用。需要注意的是,不同厂商提供的试剂盒准确性相差较大,特别是胶体金,由于制作方法本身的限制,批间差异较大,选用前应先对试剂盒进行评价[11]。
值得注意的是,本研究采用的RT-PCR为《感染性腹泻诊断标准》(WS 271 2007)所推荐,但无论其检测限,还是灵敏度均低于其他4种方法,可能与该方法引物选用的VP7基因本身是一个高度变异的基因有关,提供方法的行业标准WS 271 2007距今已经有6年时间,不排除期间毒株发生了变异,因此选用时应慎重。该方法是否需要改进以提高其灵敏度,有待更具代表性的标本进一步的验证。
PAGE作为检测轮状病毒的经典方法,具有非常高的特异性,可用于确认实验;real-time RT-PCR检测A组轮状病毒的灵敏度优于其他4种方法,可用于轮状病毒的高通量检测;ELISA和胶体金具有良好的灵敏度与特异性,且胶体金成本低,非常适合于初筛检测。行业标准推荐的RT-PCR尽管特异性较高,但灵敏度偏低,有待改进。
参考文献
[1] Widdowson MA, Steele D, Vojdani J, et al. Global rotavirus surveillance: determining the need and measuring the impact of rotavirus vaccines[J]. J Infect Dis, 2009, 200 (Suppl 1):S1-8.
[2] Nelson EA, Bresee JS, Parashar UD, et al. Rotavirus epidemiology: the Asian Rotavirus surveillance network[J]. Vaccine, 2008, 26(26):3192-3196.
[3] Li F, Liu JX. Medical Microbiology[M]. Version 7.Beijing:People's Medical Publishing House, 2008. (in Chinese) 李凡, 刘晶星. 医学微生物学[M].7版. 北京:人民卫生出版社, 2008.
[4] Chinese Center For Disease Control And Prevention. Anunal report on surveillance of selected infectious diseases and vectors, China[R]. Beijing: Chinese Center for Disease Control and Prevention, 2010. (in Chinese) 中国疾病预防控制中心.中国重点传染病和病媒生物监测报告[R].北京:中国疾病预防控制中心, 2010.
[5] Chinese Center for Disease Control and Prevention. Surverlliance procedure of viral diarrhea of China[S]. Beijing: Chinese Center for Disease Control and Prevention, 2007. (in Chinese) 中国疾病预防控制中心. 全国病毒性腹泻监测方案[S]. 北京:中国疾病预防控制中心, 2007.
[6] Ministry of Health of the People's republic of China. WS 271-2007 Diagnostic criteria for infectious diarrhea[S]. Beijing:Ministry of Health of the People's republic of China, 2010. (in Chinese) 中华人民共和国卫生部. WS 271 2007 感染性腹泻诊断标准[S].北京:中华人民共和国卫生部, 2008.
[7] Herring AJ, Inglis NF, Ojeh CK, et al. Rapid diagnosis of rotavirus infection by direct detection of viral nucleic acid in silver-stained polyacrylamide gels[J]. J Clin Microbiol, 1982, 16(3):473-477.
[8] Ross J, Ostlund EN, Cao D, et al. Acrylamide concentration affects the relative position of VP7 gene of serotype G2 strains as determined by polyacrylamide gel electrophoresis[J]. J Clin Virol, 2008, 42(4):374-380.
[9] Wu BK, Xiang HM. Real-time RT-PCR test on rotavirus of group A in infants.[J]. Laboratory Medicine, 2009, 24(5):388-390.(in Chinese) 吴炳坤, 项红梅. 荧光定量逆转录聚合酶链反应检测婴幼儿粪便A组轮状病毒[J]. 检验医学, 2009, 24(5):388-390.
[10] Yan HQ, Zhang Q, Cui SX, et al. Application and Comparison of two detcetion methords on rotavirus of group A[J]. Chinese Journal of Experimental and Clinical Virology, 2009, 23(2):157.(in Chinese) 严寒秋, 章青, 崔淑娴, 等. 两种检测A组轮状病毒方法的应用比较[J]. 中华实验和临床病毒学杂志, 2009, 23(2):157.
[11] Xu YY, Wei XS, Zhang SQ, et al. Evaluation and selection strategy of detection reagents on rotavirus antigen[J]. International Journal of Laboratory Medicine, 2005, 26(10):757-758, 760.(in Chinese) 徐育云, 魏祥松, 张双庆, 等.轮状病毒抗原检测试剂的评价及选用策略[J].国外医学:临床生物化学与检验学分册, 2005, 26(10):757-758, 760.
[2] Nelson EA, Bresee JS, Parashar UD, et al. Rotavirus epidemiology: the Asian Rotavirus surveillance network[J]. Vaccine, 2008, 26(26):3192-3196.
[3] Li F, Liu JX. Medical Microbiology[M]. Version 7.Beijing:People's Medical Publishing House, 2008. (in Chinese) 李凡, 刘晶星. 医学微生物学[M].7版. 北京:人民卫生出版社, 2008.
[4] Chinese Center For Disease Control And Prevention. Anunal report on surveillance of selected infectious diseases and vectors, China[R]. Beijing: Chinese Center for Disease Control and Prevention, 2010. (in Chinese) 中国疾病预防控制中心.中国重点传染病和病媒生物监测报告[R].北京:中国疾病预防控制中心, 2010.
[5] Chinese Center for Disease Control and Prevention. Surverlliance procedure of viral diarrhea of China[S]. Beijing: Chinese Center for Disease Control and Prevention, 2007. (in Chinese) 中国疾病预防控制中心. 全国病毒性腹泻监测方案[S]. 北京:中国疾病预防控制中心, 2007.
[6] Ministry of Health of the People's republic of China. WS 271-2007 Diagnostic criteria for infectious diarrhea[S]. Beijing:Ministry of Health of the People's republic of China, 2010. (in Chinese) 中华人民共和国卫生部. WS 271 2007 感染性腹泻诊断标准[S].北京:中华人民共和国卫生部, 2008.
[7] Herring AJ, Inglis NF, Ojeh CK, et al. Rapid diagnosis of rotavirus infection by direct detection of viral nucleic acid in silver-stained polyacrylamide gels[J]. J Clin Microbiol, 1982, 16(3):473-477.
[8] Ross J, Ostlund EN, Cao D, et al. Acrylamide concentration affects the relative position of VP7 gene of serotype G2 strains as determined by polyacrylamide gel electrophoresis[J]. J Clin Virol, 2008, 42(4):374-380.
[9] Wu BK, Xiang HM. Real-time RT-PCR test on rotavirus of group A in infants.[J]. Laboratory Medicine, 2009, 24(5):388-390.(in Chinese) 吴炳坤, 项红梅. 荧光定量逆转录聚合酶链反应检测婴幼儿粪便A组轮状病毒[J]. 检验医学, 2009, 24(5):388-390.
[10] Yan HQ, Zhang Q, Cui SX, et al. Application and Comparison of two detcetion methords on rotavirus of group A[J]. Chinese Journal of Experimental and Clinical Virology, 2009, 23(2):157.(in Chinese) 严寒秋, 章青, 崔淑娴, 等. 两种检测A组轮状病毒方法的应用比较[J]. 中华实验和临床病毒学杂志, 2009, 23(2):157.
[11] Xu YY, Wei XS, Zhang SQ, et al. Evaluation and selection strategy of detection reagents on rotavirus antigen[J]. International Journal of Laboratory Medicine, 2005, 26(10):757-758, 760.(in Chinese) 徐育云, 魏祥松, 张双庆, 等.轮状病毒抗原检测试剂的评价及选用策略[J].国外医学:临床生物化学与检验学分册, 2005, 26(10):757-758, 760.