2. Southwest University, Chongqing 404100, China
2. 西南大学, 重庆 404100
-
1 材料与方法
- 1.1 材料
- 1.2 方法
- 1.2.1 重组rSLY及rSLYP353L的重组蛋白的体外表达和纯化
- 1.2.2 SLY及rSLYP353L的重组蛋白的溶血表型鉴定
- 1.2.3 小鼠腹腔巨噬细胞(Peritoneal Macrophages,PM)的分离和rSLY体外激活巨噬细胞
- 1.2.4 细胞毒性检测(LDH释放法)
- 1.2.5 ELISA检测IL-1β
- 1.2.6 聚丙烯酰胺凝胶电泳(PAGE)及Western blot
- 1.3 统计学分析
- 2.1 rSLY和rSLYP353L蛋白的表达纯化
- 2.2 蛋白溶血活性分析
- 2.3 SLY和rSLYP353L对小鼠PM的毒性检测
- 2.4 SLY诱导小鼠PM释放IL-1β的剂量效应分析
- 2.5 SLY诱导小鼠PM释放IL-1β的时间效应分析
猪链球菌可感染猪和病猪的密切接触者引起脑膜炎和败血症[1],近年更因引起病死率很高的人群暴发而备受关注[2],对养猪产业和公共卫生有重要意义。虽然对猪链球菌引起脑膜炎的研究较多,目前猪链球菌引起严重的全身感染并发生链球菌中毒性休克样症状(streptococcal toxic shock syndrome,STSS)致病机制尚未明确。
猪溶素(Suilysin,SLY)是猪链球菌分泌的外毒素,被认为是猪链球菌的重要毒力因子之一,属于依赖胆固醇的溶细胞毒素家族成员。胆固醇依赖性溶细胞毒素的共同功能是通过C段第四结构域和膜上受体(包括胆固醇)相互作用而与靶细胞膜结合,结合后形成寡聚体,改变N端部分的构象,形成跨膜的孔。既往研究发现突变体rSLY353L第353氨基酸位点突变后丧失了溶血活性,并对该突变体的免疫源性进行了体内研究[3]。据报道很多细菌毒素能够通过激活NLRP3炎性体诱导IL-1β产生,例如肺炎链球菌溶血素、单增李斯特菌的李斯特溶素和肠出血性大肠埃希菌肠溶血素都能够激活NLRP3炎性体而促进IL-1β释放[4,5,6]。
IL-1β具有多种生物学效应,是参与炎症反应的重要炎症因子。IL-1β的合成分泌包括成熟的IL-1β和IL-1β前体(pro-IL-1β)两种形式,pro-IL-1β在胞内合成后常规条件下不分泌至胞外,pro-IL-1β需在一系列炎性体活化信号通路的参与下可裂解为成熟的IL-1β,可由胞内分泌至胞外。当细胞由于毒性作用发生损伤致胞膜破裂或通透性增高时,部分pro-IL-1β可释放到胞外[7]。SLY诱导宿主细胞的细胞毒性及其炎症反应的实验数据非常有限,且机制不清。因此本研究体外重组表达了猪链球菌的猪溶素rSLY和第353氨基酸位点突变体rSLY353L,拟对比观察rSLY和突变体rSLY353L诱导小鼠腹腔巨噬细胞释放IL-1β是否存在差异,为进一步研究SLY激活炎性体分子机制奠定基础,预期的最终结果将有助于深入了解猪链球菌诱发STSS的炎症反应机制,有效干预STSS。
清洁级C57BL/6近交系小鼠,雌性,6~8周,购自中国食品药品检定研究院。RPMI 1640培养基和胎牛血清购自GIBCO公司;细胞毒性检测试剂盒购自Promega公司;小鼠细胞因子的酶联免疫吸附试验(ELISA)检测试剂盒与流式细胞检测试剂盒均购自BD公司。
1.2 方法1.2.1 重组rSLY及rSLYP353L的重组蛋白的体外表达和纯化
rSLY和rSLY353L的重组表达纯化鉴定方法详见文献[3],利用表达质粒pET30,1 mmol/L IPTG诱导分泌表达,经超声波裂解菌体后,依次进行镍亲和柱层析、阴离子交换层析、凝胶过滤层析后,再经过去除内毒素凝胶柱得到纯化蛋白,鲎试剂检测内毒素含量,结果在100 ng/ml 浓度下内毒素含量低于0.9(endotoxin units,EU)/g蛋白。
1.2.2 SLY及rSLYP353L的重组蛋白的溶血表型鉴定溶血效价定义为使50%红细胞裂解的最高稀释度或最低浓度。取3 ml健康人全血,用无菌PBS于4 ℃ 3000 r/min,离心洗涤3次后,用PBS配制2%(V/V)红细胞悬液。取毒素和突变子样品各500 μl于试管中,加等体积2%人红细胞,37 ℃温育1 h,观察溶血情况。
1.2.3 小鼠腹腔巨噬细胞(Peritoneal Macrophages,PM)的分离和rSLY体外激活巨噬细胞腹腔注射2 ml 4%的硫胶质溶液,5天后,颈椎脱臼法处死小鼠。每只注射8 ml预冷的HBSS(Hanks balance salt solution,Hanks平衡盐溶液,不含有Ca2+和Mg2+,放冰上)冲洗腹腔,4 ℃,1500 r/min,离心10 min,弃上清。用RPMI 1640培养液(含1% FBS)重悬,用台盼蓝染色计数。每孔1×106细胞铺于24孔板上,37 ℃ 在5%CO2培养2 h。洗掉漂浮细胞,贴壁细胞用流式细胞术鉴定PM标记物F4/80阳性率高于90%。每孔加入1 ml。将不同浓度(0.1~10 μg/ml) 的rSLY及rSLY353L加入24孔板每孔细胞,在RPMI 1640培养液(含2% FBS)于37 ℃、5%CO2条件下培养不同时间后,离心收集无细胞培养上清,冻存于-80 ℃冰箱,用于ELISA检测。
1.2.4 细胞毒性检测(LDH释放法)细胞培养24 h, 终止前1 h于最大量释放孔加入细胞裂解液,分自然释放量组,试验组和最大释放量组。分别取50 μl上清于96孔板,设复孔,再加入50 μl底物混合物,充分混匀,封板避光作用30 min后终止,酶标仪读取A490值, 计算公式如下:

按试剂盒说明书,将标准品和检测待测样品包被96孔板,分别加一抗和二抗孵育洗板,酶学显色。根据标准品吸光度值,得到标准曲线,从而计算出待测样品中细胞因子浓度。按照实验需求对细胞进行适当处理,离心收集细胞培养上清,按照需要对样品进行一定的稀释。按照ELISA 试剂盒的说明书进行操作处理数据。
1.2.6 聚丙烯酰胺凝胶电泳(PAGE)及Western blot按常规方法将蛋白样品上样至SDS-PAGE胶加样孔内,电泳后转模、封闭,分别加自备抗SLY兔血清一抗和荧光标记(Rockland)二抗孵育后,利用odssy 仪器,800 nm 激发光扫描检测。
1.3 统计学分析应用SPSS 17.0软件进行统计分析,数据以均数±标准差(x ±s)表示,进行配对样本t检验,One-way ANOVA 用于组内变量差异比较。
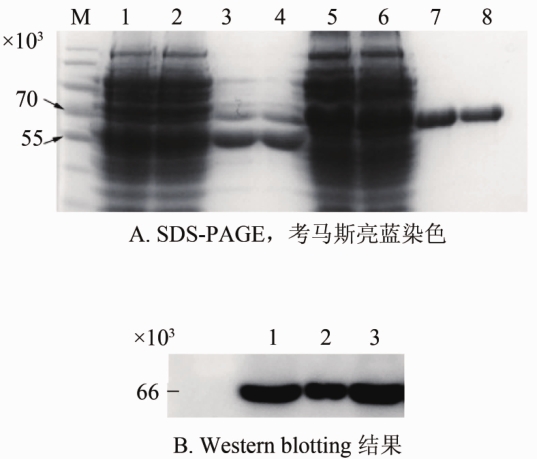
经SDS-PAGE和 Western blotting检测验证结果如图1(A和B)。在66×103处可见一条增高的蛋白条带,与SLY蛋白的分子质量相符,并且显示纯度达到90%以上。重组蛋白定量后100 μl/支分装后-20 ℃保存。避免反复冻融。
注:A.1、2条带为rSLY纯化前蛋白; 5、6条带为rSLY353L纯化前蛋白; 3、7条带分别为rSLY 一次和两次纯化后蛋白; 4、8条带分别为rSLYP353L一次和两次纯化后蛋白;M 蛋白质分子质量标准。B. 1、2 条带为rSLY纯化蛋白; 3 为rSLY353L纯化蛋白。图 1 经SDS-PAGE和 Western blotting检测验证结果
Figure 1 Results of(A) SDS-PAGE, Coomassie brilliant blue G250 staining and (B) Western blotting
2.2 蛋白溶血活性分析
溶血活性实验结果显示,本研究纯化得到的rSLY具有良好的溶血活性。rSLY在2.2 nmol/L浓度下约有50%的红细胞裂解,rSLY溶血单位初步定为2.2 nmol/L。rSLY353L则不具备溶血活性。
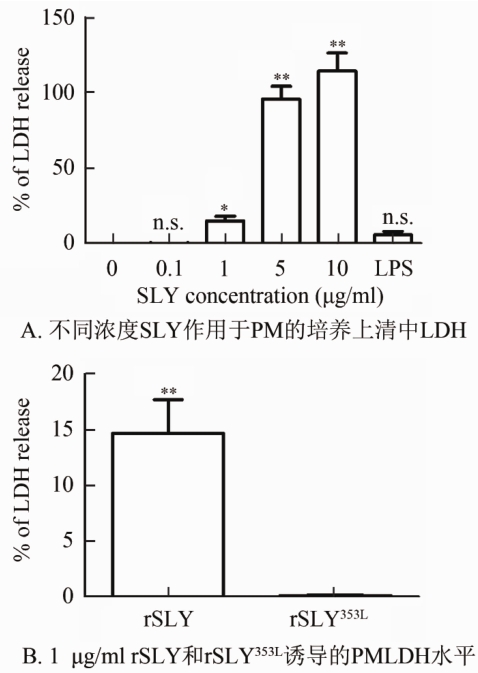
2.3 SLY和rSLYP353L对小鼠PM的毒性检测rSLY对小鼠PM的细胞毒性可以通过测定上清溶液中细胞因裂解而释放的乳酸脱氢酶(LDH)的量进行评价。由图2可见,不同浓度的rSLY诱导小鼠PM的细胞毒性呈现明显的剂量效应,1 μg/ml rSLY可引起<20%细胞毒,>5 μg/ml rSLY几乎引起的细胞毒性90%。1 μg/ml rSLY353L无显著细胞毒性。
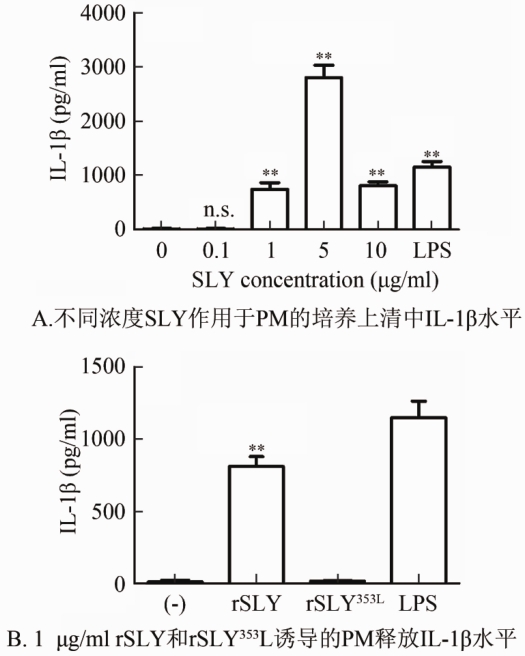
2.4 SLY诱导小鼠PM释放IL-1β的剂量效应分析由图3可见,不同浓度的rSLY刺激小鼠PM分泌的IL-1β产量有明显的剂量效应趋势,1 μg/ml SLY 可诱导PM 释放IL-1β,浓度高达750 pg/ml;5 μg/ml SLY可诱导PM产生将近2800 pg/ml IL-1β;10 μg/ml SLY诱导PM 释放IL-1β明显降低,约为800 pg/ml。鉴于5和10 μg/ml SLY引起的细胞毒太高,故认为1 μg/ml是适宜的研究炎性反应机制的刺激条件。1 μg/ml的rSLYP353L 不能诱导可检测到的IL-1β。SLY超过5 μg/ml时IL-1β产量和细胞毒呈负相关。
注:**P<0.01,与阴性对照比差异有统计学意义; n.s. P>0.05, 差异无统计学意义。图 2 不同浓度的SLY(0.1~10 μg/ml)和 1 μg/mlrSLYP353L与PM共孵育20 h诱导的LDH水平
Figure 2 LDH level of PM induced by rSLY and rSLY353L at different concentrations after 20 hours incubation
注:**P<0.01,与阴性对照相比差异有统计学意义; n.s.表示P>0.05, 差异无统计学意义。
图 3 不同浓度的SLY(0.1~10 μg/ml)与1 μg/ml rSLY353L 与PM 孵育20 h细胞培养上清中IL-1β水平
Figure 3 IL-1βproduction induced by of SLY and rSLY353L at different concentrations
2.5 SLY诱导小鼠PM释放IL-1β的时间效应分析
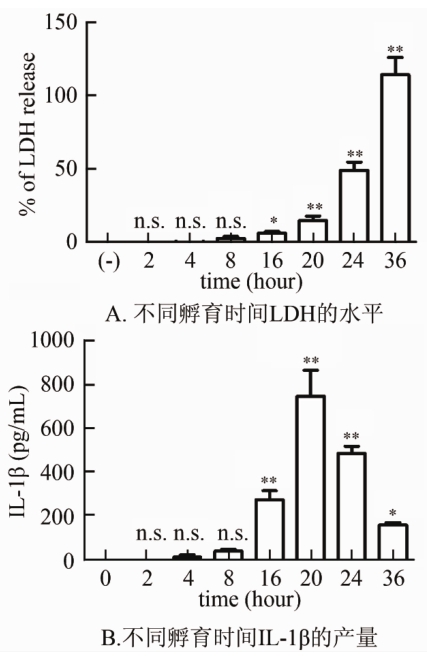
由图4可见,1 μg/ml rSLY刺激小鼠PM分泌的IL-1β产量随着孵育时间而变化,rSLY与PM共孵育少于4 h仅产生低量IL-1β(12 pg/ml);8 h达40 pg/ml;16 h高达300 pg/ml;20 h达到最高为800 pg/ml,细胞孵育24 h略有降低,约500 pg/ml;与细胞共孵育36 h,上清中IL-1β进一步降低约为150 pg/ml。因此认为rSLY与PM共孵育时间20 h是IL-1β产量的高峰。在20 h后细胞毒和IL-1β产量呈下降趋势,但细胞毒性随时间延长而不断增高。
注:**P<0.01,差异有统计学意义; n.s.P>0.05, 差异无统计学意义。图 4 rSLY (1 μg/ml)与PM 孵育不同时间细胞培养上清中LDH水平和IL-1β产量
Figure 4 LDH level and IL-1βproduction induced by 1 μg/ml of SLY and rSLY353L at different times
猪链球菌是人畜共患病原菌,可引起猪脑膜炎,对养猪产业危害严重,也可感染病猪的接触者,多是以脑膜炎为主的散发病例[1]。2005年中国四川省报道超过200人感染猪链球菌,是首次以STSS为主的大规模暴发,起病急,症状重,可导致多系统功能受损,病死率高达20%。死亡病例表现为罕见的STSS。STSS患者血清中细胞因子(IL-1β、IL-6、IL-8、 IL-12p70、 IFN-γ 和TNF-α)水平明显高于临床表现为单纯脑膜炎的患者[2]。此次暴发的代表菌株是血清2型,早期能导致患者炎症因子大量升高,这些细胞因子的过量释放可能是引起STSS 的重要原因。关于猪链球菌引起的STSS的炎症机制尚不明确,因此研究猪链球菌诱导炎症因子释放机制对干预控制STSS有重大意义。
SLY是唯一已知的猪链球菌分泌的胆固醇依赖成孔细胞毒素,由497个氨基酸残基组成,是依赖胆固醇的细胞溶素家族成员;该家族还包括产气荚膜梭菌释放的外毒素(PFO),化脓性链球菌外毒素(SLO)等[8]。其家族所有成员共同的特征是可以在富含胆固醇的细胞膜上打孔从而引起细胞通透性改变或者导致细胞裂解。据报道,SLY 可在人红细胞表面打孔,形成直径约为7 nm 的小孔,从而引起红细胞裂解因而具有溶血活性。本研究在既往研究工作基础上体外重组表达了SLY和rSLY353L并确认了二者的溶血活性差异。rSLY353L 是研究组成员筛选并确认的无溶血活性的SLY突变体,曾对其蛋白晶体结构和免疫源性进行过系统研究[3]。但是对其炎性诱导和激活机制并无深入研究。
很多成孔细菌毒素都有细胞毒性,但关于SLY的相关研究信息很少。本研究对rSLY及其突变体rSLY353L诱导单核巨噬细胞的细胞毒性进行了量效和时效的全面观察。乳酸脱氢酶是评价细胞受损的间接指标,正常状态时存在于细胞内,当细胞受到损伤时释放至胞外。结果显示rSLY对PM的细胞毒随着孵育时间和毒素剂量增加而增大,失去溶血活性的rSLY353L则丧失了细胞毒性作用。细胞毒性过高时细胞失去正常功能,产生的IL-1β有降低趋势。该细胞毒性结果解释了IL-1β的变化趋势,有助于确立最佳实验条件研究SLY诱导PM的炎症机制。
有研究报道SLY 可以刺激内皮细胞和单核巨噬细胞产生TNF、IL-6等炎症因子 。但关于rSLY诱导IL-1β释放的研究尚未见报道。IL-1β主要由活化的单核-巨噬细胞产生,具有多种生物学效应。IL-1β一方面可协同刺激抗原递呈细胞和T细胞活化,以及B细胞增殖和抗体分泌,促进免疫应答,另一方面又可参与炎症反应。IL-1β的激活和释放的分子机制和TNF、IL-6等其他细胞因子不同。IL-1β的分泌包括以下三个步骤:(1)无生物活性的pro-IL-1β的合成;(2)pro-IL-1β经caspase-1活化途径裂解产生具有生物活性的成熟IL-1β;(3)成熟IL-1β由胞内分泌至胞外[6]。本研究明确了不同浓度SLY诱导PM释放成熟IL-1β随时间变化的趋势,发现在低细胞毒条件下细胞毒和IL-1β存在正相关性,细胞毒过高时IL-1β产量反而降低。因此进一步研究SLY激活炎症体通路的激活机制,应在细胞毒较低的实验条件下完成。已报道激活NLRP3炎性体的信号通路,可引起pro-IL-1β活化为成熟IL-1β。ATP介导的离子通道的活化,导致胞内K离子外流及泛连接蛋白-1介导的细胞膜小孔的形成,从而激活NLRP3[12]。另外病原体及危险信号进入胞内,引起溶酶体的破裂,导致溶酶体内组织蛋白酶B释放致胞浆内,也引发NLRP3的活化[13]。本研究建立的体外刺激PM条件是进一步研究NLRP3信号通路激活机制的必要基础。
[2] Ye C, Zhu X, Jing H, et al. Streptococcus suis sequence type 7 outbreak, Sichuan, China[J].Emerg Infect Dis,2006, 12(8):1203-1208.
[3] Du H, Huang W, Xie H, et al.The genetically modified suilysin, rSLY(P353L), provides a candidate vaccine that suppresses proinflammatory response and reduces fatality following infection with Streptococcus suis[J]. Vaccine,2013, 31(38):4209-4215.
[4] Costa A, Gupta R, Signorino G, et al. Activation of the NLRP3 inflammasome by group B streptococci[J]. J Immunol,2012, 188(4):1953-1960.
[5] Meixenberger K, Pache F, Eitel J, et al. Listeria monocytogenes-infected human peripheral blood mononuclear cells produce IL-1beta, depending on listeriolysin O and NLRP3[J]. J Immunol,2010, 184(2):922-930.
[6] Zhang X, Chen Y, Xiong Y, et al. Enterohemorrhagic Escherichia coli specific enterohemolysin induced IL-1β in human macrophages and EHEC-induced IL-1β required activation of NLRP3 inflammasome[J]. PLoS One,2012, 7(11):e50288.
[7] Eder C.Mechanisms of interleukin-1beta release[J].Immunobiology,2009, 214(7):543-553.
[8] Kelly SJ, Jedrzejas MJ.Structure and molecular mechanism of a functional form of pneumolysin: a cholesterol-dependent cytolysin from Streptococcus pneumoniae[J]. J Struct Biol,2000, 132(1):72-81.
[9] Segura M, Stankova J, Gottschalk M.Heat-killed Streptococcus suis capsular type 2 strains stimulate tumor necrosis factor alpha and interleukin-6 production by murine macrophages[J].Infect Immun,1999, 67(9):4646-4654.
[10] Tanabe S, Gottschalk M, Grenier D. Hemoglobin and Streptococcus suis cell wall act in synergy to potentiate the inflammatory response of monocyte-derived macrophages[J]. Innate Immun,2008, 14(6):357-363.
[11] Gottschalk MG, Lacouture S, Dubreuil JD. Characterization of Streptococcus suis capsular type 2 haemolysin[J].Microbiology,1995, 141(Pt 1):189-195.
[12] Walev I, Klein J, Husmann M, et al. Potassium regulates IL-1 beta processing via calcium-independent phospholipase A2[J]. J Immunol,2000, 164(10):5120-5124.
[13] Chu J, Thomas LM, Watkins SC, et al. Cholesterol-dependent cytolysins induce rapid release of mature IL-1beta from murine macrophages in a NLRP3 inflammasome and cathepsin B-dependent manner[J]. J Leukoc Biol,2009, 86(5):1227-1238.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 任志鸿 | |
| 黄元铭 | |
| 王淑京 | |
| 杜华茂 | |
| 宋利琼 | |
| PubMed | |
| Article by REN Zhi-hong | |
| Article by HUANG Yuan-ming | |
| Article by WANG Shu-jing | |
| Article by DU Hua-mao | |
| Article by SONG Li-qiong | |