-
1 材料与方法
- 1.1 标本来源
- 1.2 标本分装保存
- 1.3 标本的核酸提取与检测
- 1.4 标本培养与检测
- 1.5 数据分析
- 2.1 标本培养与荧光PCR检测结果比较
- 2.2 肺炎支原体临床标本培养阳性时间
- 2.3 CAP病例与URTI病例中肺炎支原体阳性率比较
- 2.4 CAP病例中不同年龄段患者肺炎支原体感染情况
肺炎支原体是引起人类呼吸道感染的重要病原菌之一[1-2],不仅引起非典型肺炎,还可引起多种呼吸道疾病,其每4~8年可引起全球范围的大流行[3]。肺炎支原体感染的临床疾病引起国内临床专家与疾控工作者的重视,但目前国内对肺炎支原体的研究基础较为薄弱,导致临床研究中对肺炎支原体病原以及由其引发的疾病诊治能力不足。国内传统观点认为肺炎支原体培养困难[4],临床标本的分离率低,对肺炎支原体的分离培养开展很少;另一方面,认为肺炎支原体是引起儿童呼吸道感染的重要病因[5],对成年人感染的危害较小。这些观点多数来自国内外早期肺炎支原体的研究数据,并一直沿用至今。随着对肺炎支原体研究不断细化和深入,人们对肺炎支原体及其所致疾病有更新和更准确的认识,对一些不正确的传统观点需要纠正。因此,本研究利用2008年8月至2010年8月收集的346份临床咽拭子标本开展肺炎支原体相关研究,探讨肺炎支原体菌株特点以及其引起疾病的临床特点,为国内临床肺炎支原体的诊治提供数据支持,加深临床医生及相关工作者对于肺炎支原体及其所致疾病的了解。
346份临床急性呼吸道感染咽拭子标本均采集自2008年8月至2010年8月间北京市朝阳医院和北京市儿童医院确诊病例,其中社区获得性肺炎(CAP)标本205例,急性上呼吸道感染(URTI)标本141例,按照年龄段划分<14周岁的儿童病例为55例,≥14周岁的青少年及成人病例291例。
使用冷冻保存箱将标本运送至实验室,解冻后充分洗涤拭子并弃去,标本液进行每份400 μl分装。其中1份接种肺炎支原体选择性液体培养基进行分离培养检测,1份提取染色体进行标本核酸检测,其余1~2份分装标本保存 在-76 ℃低温冰箱备用。
使用Qiagen DNA Minikit (QIAEEN,Hilden,Germany) 提取所有标本染色体。提取的标本核酸使用实时荧光定量-聚合酶链反应(real-time fluorescence quantitative-polymerase chain reaction,real-time PCR)进行肺炎支原体检测[6]。
使用2 ml 肺炎支原体选择性液体培养基(OXOID公司)直接培养标本,每日观察培养基变色情况。如培养基48 h内发生浑浊提示细菌污染,丢弃,另取1份备份标本经450 nm滤器过滤后重新培养观察。培养基变黄提示培养阳性,记录培养阳性变色日期,连续观察30日仍未变色的标本为培养阴性。培养变色的阳性标本接种肺炎支原体固体培养基分纯培养,切取单克隆再经液体分纯培养后增菌,纯培养物提取核酸做real-time PCR进行肺炎支原体鉴定[6]。
对346份标本分离培养及荧光PCR检测结果进行比对分析;对肺炎支原体培养阳性标本培养时间进行分析;使用统计学软件对CAP和URTI两种类型呼吸道感染标本肺炎支原体检出率进行对比,对不同年龄段人群肺炎支原体感染率进行比对。
346份呼吸道标本经分离培养检测阳性标本为99份,real-time PCR检测阳性标本为111份。培养和real-time PCR检测阳性率分别为28.6%(99/346)和32.1%(111/346)。其中有2份标本培养阳性,但real-time PCR检测阴性,将培养阳性菌株提取核酸后再进行real-time PCR检测为阳性。综合培养与real-time PCR两种检测结果分析,标本总体检测阳性率为32.7%(113/346)。
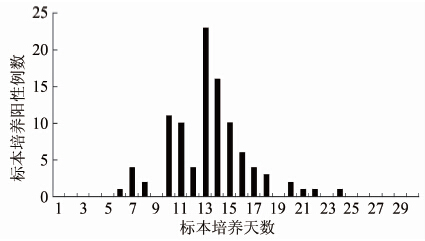
本研究共有99例标本肺炎支原体培养阳性,经分纯培养,所有培养阳性标本均获得菌株并经过核酸验证。最早能够从标本中培养出肺炎支原体的时间为6 d,最长分离时间为24 d,超过90%的阳性标本分离时间为7~18 d(图1)。
图1 99例阳性标本中肺炎支原体培养阳性时间
Figure 1 The histogram of culture positive time with 99 M.pneumoniae positive specimens
205例CAP病例标本肺炎支原体分离培养阳性率为46.3%(95/205),real-time PCR检测阳性率为51.2%(105/205);141例URTI病例标本肺炎支原体分离培养阳性率为2.8%(4/141),real-time PCR检测阳性率为4.2%(6/141)。综合培养与real-time PCR两种检测结果分析,CAP病例标本肺炎支原体检测阳性率为52.2%(107/205),URTI病例标本肺炎支原体检测阳性率为4.2%(6/141)。
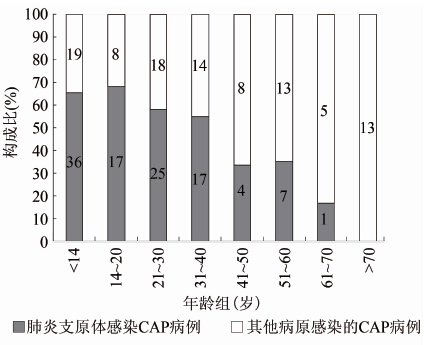
205例CAP病例中肺炎支原体人群总体感染率为52.2%(107/205),其中<14岁儿童感染率为65.5%(36/55),≥14岁青少年及成人的感染率为47.3%(71/150),各年龄组人群CAP病例中肺炎支原体感染情况见图2。
图2 不同年龄组人群CAP病例中肺炎支原体感染率分布
Figure 2 The histogram of M.pneumoniae infection in CAP cases with different age groups
标本中菌株的分离培养技术一直是制约国内肺炎支原体研究工作的最重要原因。传统观点认为肺炎支原体菌株需要使用细胞培养,培养难度高,分离率低,这种观念是不正确的。事实上,肺炎支原体的分离培养与临床标本中普通病原菌分离培养过程相似,需要正确使用选择性肺炎支原体培养基和培养方法进行菌株分离。本研究中对99份培养阳性标本进行了培养日期观察,最早能够从标本中培养出肺炎支原体的时间为6 d,这是由于肺炎支原体菌株繁殖的二分裂周期约3~8 h,比普通细菌长,故需更长的培养时间方可获得阳性结果。临床标本培养阳性的时间一般集中在1~2周之间,比肺炎支原体纯菌传代培养的时间(一般3~5 d)要长,其重要原因是由于临床标本中带菌量较少[7],且含未知的干扰物质较多引起的。此外肺炎支原体培养过程中对培养基pH值变化十分敏感[8],一旦培养阳性应及时传代到新鲜培养基中,避免其代谢产物引起培养基pH值降低导致肺炎支原体在酸性环境中迅速死亡,影响分离率。
本研究标本中的肺炎支原体培养阳性率为28.6%(99/346),与肺炎支原体检测“金标准”——real-time PCR检测率32.1%(111/346)相比,两者在统计学上使用配对χ2检验存在差异(P<0.01,χ2校正值为7.56)。real-time PCR的检测灵敏度高于培养检测是由于检测方法自身特点所决定的,但结果表明并非所有培养阳性的标本使用real-time PCR都能够检测出来,有2个培养阳性的标本使用real-time PCR检测出现假阴性结果,其培养后的real-time PCR结果阳性,说明标本中的肺炎支原体菌株并非因为核酸变异导致real-time PCR无法检测,而是标本中存在某些未知的real-time PCR反应抑制物引起的核酸检测假阴性,这表明分离培养结果可使我们的检测数据更加真实可信。此外,87.4%(97/111)的real-time PCR检测阳性标本肺炎支原体培养也为阳性,这说明只要培养方法和条件得当,肺炎支原体阳性标本的培养率是很高的。尽管分离培养技术不具备肺炎支原体的临床快速诊断能力,但菌株资源是开展肺炎支原体深入科研工作的根本,同时也是对其进行疾控监测的基础,因此肺炎支原体的分离培养具有非常重要的意义。
国内外大量文献报道,在CAP病例中肺炎支原体感染率通常为10%~40%[9-11],本研究中CAP病例中肺炎支原体的感染率为52.2%,略高于正常水平,但并非是由肺炎支原体大流行所致。笔者的监测数据表明,北京地区近几年肺炎支原体分子生物学型别并未发生变化[12-13],且在随后的年份中北京地区CAP病例中肺炎支原体感染率逐步下降,回归到正常水平(数据未发表)。另一方面,统计学数据显示CAP组和URTI病例组中肺炎支原体感染率差异有统计学意义(P<0.01,χ2=87.55)。本研究结果与Waites和Atkinson[14]报道的结果一致,说明肺炎支原体不是引起上呼吸道感染的主要病原,这对于临床有关肺炎支原体诊治及科学研究有积极的提示意义。传统观点认为肺炎支原体感染主要存在于婴幼儿及儿童病例中,成年人感染肺炎支原体的病例较少。本研究发现尽管肺炎支原体感染随年龄段递增有逐步递减的趋势,但肺炎支原体感染率在<14岁的儿童组中与三组40岁以下的成年人中相比较差异均无统计学意义。因此在临床工作中需多加关注成年人,尤其是青壮年CAP病例中对于肺炎支原体感染的诊断,避免误诊和漏诊。
本研究利用北京地区346份呼吸道感染标本对临床肺炎支原体分离培养特性及其在人群中感染特点进行了较为详细的阐述,纠正了部分对肺炎支原体感染认识的误区,有助于加深临床医生及相关工作者对于肺炎支原体及其所致疾病的认识。
[2] Kong F,Gordon S,Gilbert GL. Rapid-cycle PCR for detection and typing of Mycoplasma pneumoniae in clinical specimens[J]. J Clin Microbiol,2000,38(11):4256-4259.
[3] Kenri T,Okazaki N,Yamazaki T,et al. Genotyping analysis of Mycoplasma pneumoniae clinical strains in Japan between 1995 and 2005: type shift phenomenon of M.pneumoniae clinical strains[J]. J Med Microbiol,2008,57(Pt 4):469-475.
[4] Waites KB,Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen[J]. Clin Microbiol Rev,2004,17(4):697-728.
[5] Lee KY. Pediatric respiratory infections by Mycoplasma pneumoniae[J]. Expert Rev Anti Infect Ther,2008,6(4):509-521.
[6] Dumke R, Schurwanz N, Lenz M,et al. Sensitive detection of Mycoplasma pneumoniae in human respiratory tract samples by optimized real-time PCR approach[J]. J Clin Microbiol,2007, 45(8):2726-2730.
[7] Zhao F,Li J,He LH,et al. Effect of repeated freeze-thaw on culture and isolation of Mycoplasma pneumoniae from clinical throat swab specimen[J]. Disease Surveillance,2010, 25(10):830-832.(in Chinese) 赵飞,李晶,何利华,等. 临床咽拭子标本反复冻融对肺炎支原体分离效果的影响[J]. 疾病监测,2010,25(10):830-832.
[8] Zhao F,Li J,Tao XX,et al. Relationship between the Mycoplasma pneumoniae concentration and the pH of a liquid medium[J]. Journal of Pathogen Biology,2010,5(11):848-849.(in Chinese) 赵飞,李晶,陶晓霞,等. 肺炎支原体液体培养中pH与活菌浓度的关系研究[J]. 中国病原微生物学杂志,2010,5(11):848-849.
[9] Klement E,Talkington DF,Wasserzug O,et al. Identification of risk factors for infection in an outbreak of Mycoplasma pneumoniae respiratory tract disease[J]. Clin Infect Dis,2006,43(10):1239-1245.
[10] Waring AL,Halse TA,Csiza CK,et al. Development of a genomics-based PCR assay for detection of Mycoplasma pneumoniae in a large outbreak in New York State[J]. J Clin Microbiol,2001,39(4):1385-1390.
[11] Atkinson TP,Balish MF,Waites KB. Epidemiology, clinical manifestations,pathogenesis and laboratory detection of Mycoplasma pneumoniae infections[J]. FEMS Microbiol,2008,32:956-973.
[12] Yan XS,Zhao F,Zhang JJ. Development and application of a new p1-based genotyping method for Mycoplasma pneumoniae[J]. Acta Microbiologica Sinica,2012,52(2):262-267.(in Chinese) 闫晓苏,赵飞,张建中.新型p1基因型肺炎支原体分型方法的建立与应用[J]. 微生物学报,2012,52(2):262-267.
[13] Sun HM,Xue GH,Yan C,et al. Multiple-locus variable-number tandem-repeat analysis of Mycoplasma pneumoniae clinical specimens and proposal for amendment of MLVA nomenclature[J]. PloS One,2013,8(5):e64607.
[14] Waites KB, Atkinson TP. The role of Mycoplasma in upper respiratory infections[J]. Curr Infect Dis Rep,2009,11(3):198-206.
|
扩展功能
|
|
| 本文信息 | |
| PDF全文 | |
| HTML全文 | |
| 参考文献 | |
| 服务与反馈 | |
| 加入引用管理器 | |
| 引用本文 | |
| Email Alert | |
| 本文作者相关文章 | |
| 何利华 | |
| 顾一心 | |
| 孟凡亮 | |
| 张建中 | |
| 赵飞 | |
| PubMed | |
| Article by HE Li-hua | |
| Article by GU Yi-xin | |
| Article by MENG Fan-liang | |
| Article by ZHANG Jian-zhong | |
| Article by ZHAO Fei | |