扩展功能
文章信息
- 石伟先, 潘阳, 赵佳琛, 崔淑娟, 彭晓旻, 卢桂兰, 张代涛, 刘医萌, 吴双胜, 杨鹏, 陈丽娟, 王全意
- SHI Wei-xian, PAN Yang, ZHAO Jia-chen, CUI Shu-juan, PENG Xiao-wen, LU Gui-lan, ZHANG Dai-tao, LIU Yi-meng, WU Shuang-sheng, YANG Peng, CHEN Li-juan, WANG Quan-yi
- 一例H7N9禽流感感染病例病毒载量、耐药性与抗体水平变化分析
- Analysis on viral load, drug resistance and specific antibody level of a human case infected with influenza A (H7N9) virus in Beijing
- 疾病监测, 2014, 29(6): 458-461
- Disease Surveillance, 2014, 29(6): 458-461
- 10.3784/j.issn.1003-9961.201.06.011
-
文章历史
- 收稿日期:2014-04-10
自2013年3月31日国家卫生和计划生育委员会首次公布3例人感染H7N9禽流感病例后,国内多个省市陆续报告了人感染H7N9禽流感病例。与以往报道的H7亚型禽流感病毒轻症感染病例不同,此次H7N9禽流感病毒感染者病情进展迅速,常 由重症肺炎进展为急性呼吸窘迫综合征、感染性休克、多器官功能障碍,甚至死亡[1, 2]。由于目前该病毒感染的确诊主要依赖实验室诊断,因此结合临床,总结归纳现有病例的实验室诊断结果,对于病例的早发现、早诊断、早治疗,从而降低死亡率具有重要意义。2013年7月19日,北京市确认1例外地输入型人感染H7N9禽流感病例。该患者无慢性基础性疾病,自确诊首日起开始使用神经氨酸酶(Neuraminidase,NA)抑制剂,分别是奥司他韦1 d,剂量为2次/d,75 mg/次,而后使用帕拉米韦,累计服用18 d,剂量为1次/d,300 mg/次。经过25 d的住院抢救,患者病情一度出现稳定和好转,但最终因感染加重、多器官功能衰竭而死亡。该病例的病程进展具有代表性,本研究选择该病例不同时间点的系列样本,通过实时荧光定量反转录聚合酶链反应(real-time,RT-PCR)对病毒载量进行了测定,对治疗过程中病毒是否对NA抑制剂类药物产生耐药进行监测,同时通过血凝抑制试验对患者血清特异性抗体效价进行了分析,为进一步开展H7N9禽流感病毒研究提供依据。
1 材料与方法 1.1 标本来源每日连续收集2013年7月报告的1例北京市输入型人感染H7N9禽流感确诊病例下呼吸道道盥洗液及血清样本,至病例死亡停止采集。共收集下呼吸道盥洗液样本25份,血清23份。所有样本采集后于4 ℃保存,低温运至实验室,12 h内开展检测。
1.2 病毒核酸提取使用QIAmp viral mini Kit试剂盒(德国QIAGEN公司产)提取280 μl样本中的总RNA,提取方法按试剂盒说明书进行,病毒RNA溶于60 μl DEPC水中,立即用于real-time RT-PCR检测。
1.3 样本中H7N9病毒载量测定利用real-time RT-PCR法,使用Ag-Path ID One-step RT-PCR kit(美国Life Technologies公司产)在ABI 7500荧光PCR仪上完成。甲型流感病毒基质蛋白(Influenza A Matrix protein,AM)基因的引物探针设计参考世界卫生组织(WHO)和国家流感中心下发方案文件[3],由上海生工公司合成;反应体系配制参照试剂盒说明书。反应程序为45 ℃ 10 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 45 s,共45个循环,60 ℃ 45 s阶段收集荧光信号。使用本室制备的AM基因定量标准品(100~106 copies/ml,7个浓度梯度)进行定值。样本中AM基因拷贝数由标准品拷贝数(copies/ml)-Ct值标准曲线获得,所有定量检测重复3次,取其平均值作为最终检测结果。
1.4 样本中H7N9病毒NA抑制剂类药物耐药性检测利用real-time RT-PCR法,使用Ag-Path ID One-step RT-PCR Kit(美国Life Technologies公司产)在ABI 7500荧光PCR仪上完成。同时检测H7N9禽流感病毒上NA抑制剂类药物敏感性标志基因,NA基因NA 294R位点及耐药性标志基因NA 294K位点,其特异性引物探针序列参考Hu等[4]的设计,由上海生工公司合成;反应体系及反应程序见1.3。
1.5 病例血清中H7N9抗体检测利用血凝抑制试验,标准抗原采用灭活H7N9疫苗种子株NIBRG-268,由北京科兴生物制品有限公司提供,马血球购自北京京顺秀山养殖中心。检测步骤依照中华人民共和国卫生行业标准WS 285 2008流行性感冒诊断标准附录B进行。每份样本平行测定3次,取其平均值作为抗体滴度结果。
2 结果 2.1 病例病程中H7N9禽流感病毒载量的变化将病例下呼吸道盥洗液样本中H7N9病毒的AM基因的定量检测结果作为病毒载量,对病例病程中H7N9病毒载量变化进行统计分析,结果显示,在该病例确诊首日,即病程为6 d时,下呼吸道盥洗液中H7N9禽流感病毒载量最高,为5.25×106 copies/ml,随后随病程进展,病毒载量不断下降,至病程24 d时下降为5.49 copies/ml。其中在病程的初期病毒载量下降速度最快,6 d内即从5.25×106 copies/ml降至1.59×103 copies/ml;在病程中期(12 ~19 d),病毒载量一直维持在103 copies/ml水平上下,下降速度缓慢;自病程第20~28 d期间,病毒载量在101~102 copies/ml的低水平上有所反复,至29 d后病毒载量降低为0。整个病程中病毒载量中位数为157.76 copies/ml,见图1。
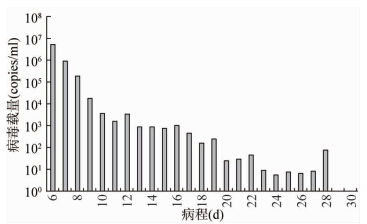
|
| 图 1 病例病程中H7N9禽流感病毒载量的变化 Fig.1 Change of H7N9 viral load during illness |
针对所有下呼吸道盥洗液样本中NA抑制类药物耐药性突变标志基因294位点,使用real-time RT-PCR法分别对药物敏感性基因NA 294R基因与耐药性基因NA 294K基因进行检测,结果显示,所有监测样本的药物敏感性基因NA 294R编码基因均为阳性;病程22、23、28 d样本耐药性基因NA 294K基因呈弱阳性,其余样本NA 294K基因为阴性,表明在病程后期患者所感染的H7N9病毒中有少部分发生了耐药性突变,见图2。
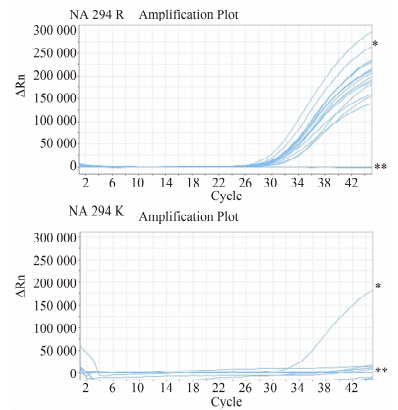
|
| 图 2 NA 294位耐药突变检测结果 Fig.2 The results of the R294K mutation on the neuraminidase gene 注: *为阳性对照;**为阴性对照。 |
对病程中采集的系列血清样本,检测其H7N9禽流感病毒特异性抗体的变化,结果显示,自病例病程为8 d起,抗H7N9病毒抗体开始逐步升高。在病程9~12 d期间,抗体滴度每日成倍增长,由10升至80,为抗体滴度增长速度最快时期。至病程达16 d后,抗体滴度达到平台期,稳定在640,直至病程达27 d时,抗体滴度升高至最高点,滴度为1280,持续3 d后,抗体滴度略有下降,但仍维持在较高水平,见图3。
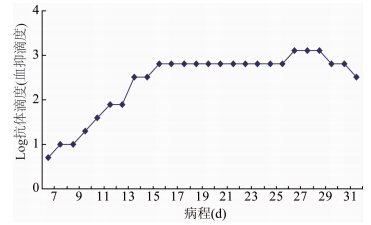
|
| 图 3 病例病程中抗H7N9病毒抗体血凝抑制滴度的变化 Fig.3 Titers of anti-H7N9 virus antibody during illness |
H7N9禽流感病毒作为一种新发的可感染人甲型流感病毒,其内部基因来源已被多项研究所揭示。该病毒可能为三重重配病毒,即病毒的节段4血凝素基因(HA)来源于A/duck/Zhejiang/12/2011(H7N3)病毒,节段6 NA基因来源于A/wild bird/Korea/A14/2011(H7N9)病毒,其余6个节段则来源于以A/brambling/Beijing/16/2012(H9N2)病毒为代表的4种不同禽源病毒[5]。WHO和国家流感中心推荐以节段4的HA基因和节段6的NA基因为H7N9特异性扩增靶标进行real-time RT-PCR PCR检测确定H7N9禽流感病毒感染,本研究中,在通过上述H7和N9基因检测确诊感染后,使用甲型流感病毒基质基因AM基因作为靶标进行real-time RT-PCR检测,同时结合患者临床表现,探讨随病程进展患者下呼吸道样本中病毒载量的变化。患者患病首日仅出现咳嗽、发热等症状,体温38 ℃,发病4 d后进展为重症肺炎,6 d时进展为急性呼吸窘迫综合征、呼吸困难,其后虽有好转但终在病程进展到32 d时因急性肾功能衰竭、感染中毒性休克死亡。本研究中因未收集到病例发病首日至发病5 d期间的样本,无此期间病毒载量变化结果,但本研究结果表明,随着病程进展及临床救治,病毒载量在患者病情迅速进展的第6天达到最高,此时开始使用流感病毒神经氨酸酶抑制剂类药物,病毒载量呈逐步下降趋势。在患者发病2周内,病毒载量下降速度最快,表明在临床救治中在病程早期的治疗效果最为显著。患者血清抗体检测结果则表明病例自确诊7 d起即出现了明显的免疫应答,随着病程持续,抗体滴度不断增加,至16 d达到平台期并保持在较高水平。此结果提示患者对该病毒应答良好,同时结合患者病毒载量变化情况,结果显示在患者发病1周后血清特异性抗H7N9抗体逐步升高的同时,其呼吸道内病毒载量也明显下降,至2周后抗体水平达到峰值时,病毒载量下降速度也呈现为在较低水平上缓慢下降,且直至发病4周时仍可检出病毒。本研究中患者一直在重症监护室,本结果是否提示当患者症状较重时,患者体内即使产生较高水平抗体,并有效抑制了病毒复制,但仍有少量病毒难以清除,仍需进一步研究核实。
目前已有研究经证实,H7N9流感病毒NA 294位基因精氨酸(R)突变为赖氨酸(K)与奥司他韦等NA抑制剂类药物的临床耐药密切相关[6]。同时由于当前人感染H7N9病毒的M2蛋白存在S31N位点突变,导致对金刚烷胺类药物普遍耐药,因此NA抑制剂对H7N9禽流感感染的治疗变得尤为重要[7]。Wu等[8]的研究显示,A/Shanghai/1/2013(H7N9)毒株NA蛋白存在R294K突变。该突变位点位于NA蛋白单体表面,可导致N2和N9亚型病毒对NA抑制剂的敏感性,从而出现耐药。但该耐药位点并没有在A/Anhui/1/2013(H7N9)等其他H7N9毒株中出现。在本研究病例中,在病程3周内样本中,NA294位点为均为仅有294K药物敏感性阳性,未发现R294K的耐药突变,提示病毒对奥司他韦等NA抑制剂敏感。但在病程后期的22、23和28 d样本中,NA294位点R基因检测阳性同时NA294位点K基因检测弱阳性。将RNase P基因作为对照基因,使用2-ΔΔCt公式进行初步推算,在病程22、23和28 d样本中分别有约0.19%、0.10%和0.39%的病毒出现NA294位点K基因变异。这一结果提示经持续的抗病毒治疗后可能有少量病毒出现NA抑制剂耐药突变,但优势病毒亚群对NA抑制剂依然敏感。
本研究中对病例血清抗体的检测使用了经典的血凝抑制试验[9, 10]。该方法所检测到的患者血清特异性抗体水平,既能用于患者免疫应答水平的评估,也可反映患者感染病毒的抗原性。对于病例对感染病毒的应答,使用自病例样本中分离到的病毒最好,但因受生物安全实验室级别所限,本实验室无H7N9病毒分离条件,因此本研究中抗体检测使用抗原为H7N9疫苗种子株NIBRG-268,而非患者自身感染病毒,这对H7N9抗体检测所造成的影响,尚待进一步证实。但本实验室同时使用该疫苗株对健康人群及禽类养殖人员,共计3000人份血清样本进行了检测,结果显示,H7N9抗体滴度均 < 5,而对另外2例H7N9确诊病例的血清抗体滴度均 > 40,表明该抗原可有效反映患者对H7N9病毒的感染情况及抗体应答情况。
综上所述,本研究通过对H7N9禽流感感染病例样本的real-time RT-PCR 检测验证了奥司他韦等NA抑制剂药物的临床疗效,同时提示实时荧光定量RT-PCR具有用于治疗监测的可能,可为人感染H7N9禽流感病毒重症患者的抗病毒治疗提供参考依据。同时本研究分析了患者血清特异性抗体水平,显示目前发现的人感染H7N9禽流感病毒株高抗原性保守,可激发人体产生有效的免疫应答。本研究针对单个病例的连续样本进行分析,研究结果不仅有利于病毒核酸扩增分 型检测和血清学检测的开展,避免因病毒变异出现假阴性结果;同时便于开展基因、蛋白溯源和分子遗传学研究,为探明病毒起源和开展疫情防控奠定基础。
| [1] | Ron A, Peter M, Frans W, et al.Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome [J]. Proc Natl Acad Sci USA,2004,101(5):1356-1361. |
| [2] | Deng Y, Pang XH, Wang QY.The situation and strategies to the human infected H7N9 avian influenza virus[J]. International Journal of Virology,2013,20(4):145-147.(in Chinese) 邓瑛,庞星火,王全意. 人感染H7N9禽流感疫情形势与应对策略[J].国际病毒学杂志,2013,20(4):145-147. |
| [3] | Organization WH. WHO CC Beijing real-time RT PCR (rRT-PCR) protocol for detection of a (H7N9) avian influenza virus . http://www.who.int/influenza/gisrs_laboratory/cnic_realtime_rt_pcr_protocol_a_h7n9.pdf. |
| [4] | Hu YW, Lu SH, Song ZG, et al.Association between adverse clinical outcome in human disease caused by novel influenza A H7N9 virus and sustained viral shedding and emergence of antiviral resistance [J]. Lancet,2013,381(9885):2273-2279. |
| [5] | Liu D, Shi WF, Wang DY, et al. Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: phylogenetic, structural, and coalescent analyses [J]. Lancet,2013,381(9881):1926-1932. |
| [6] | Sleeman K, Zhu G, Barnes J, et al. R292K substitution and drug susceptibility of influenza A(H7N9) viruses [J]. Emerg Infect Dis,2013,19(9):1521-1524. |
| [7] | Qi YH, Fan H, Qi X, et al. A novel pyrosequencing assay for the detection of neuraminidase inhibitor resistance-conferring mutations among clinical isolates of avian H7N9 influenza virus [J]. Virus Res,2013,22(179):119-224. |
| [8] | Wu Y, Bi YH, Christopher JV, et al.Characterization of two distinct neuraminidases from avian-origin human-infecting H7N9 influenza viruses [J]. Cell Res,2013,23(12):1347-1355. |
| [9] | Bian JR, Nie W, Xiu QY, et al.The developent of the laboratory detection technology on the influenza virus[J]. International Journal of Virology,2012,19(5):228-232.(in Chinese) 卞家蓉,聂蔚,修清玉,等. 流感病毒实验室检测技术研究进展[J]. 国际病毒学杂志,2012,19(5):228-232. |
| [10] | Ren ZY, Sun YL, Lyu YN, et al. Assement on applying of aldehyde fixed horse erythrocytes in hemagglutination inhibition assay[J]. International Journal of Virology,2013,20(4): 148-152.(in Chinese) 任振勇,孙玉兰,吕燕宁,等. 醛化马血球在检测禽流感病毒血凝抑制抗体中的应用[J]. 国际病毒学杂志,2013,20(4):148-152. |
 2014, Vol. 29
2014, Vol. 29


