扩展功能
文章信息
- 陈洪友, 屠丽红, 陈敏, 宋元君, 王文静
- CHEN Hong-you, TU Li-hong, CHEN Min, SONG Yuan-jun, WANG Wen-jing
- 贝类水产中副溶血性弧菌菌型分布研究
- Investigation of diversity of Vibrio parahaemolyticus in molluscs
- 疾病监测, 2014, 29(7): 522-527
- Disease Surveillance, 2014, 29(7): 522-527
- 10.3784/j.issn.1003-9961.2014.07.005
-
文章历史
- 收稿日期:2014-3-12
副溶血性弧菌(Vibrio parahaemolyticus,VP)是近海水体的自然栖生菌。VP常致人类腹泻,且多与海产品消费相关。相对其他海产品,贝类软体动物 具有更高的VP携带率 [1]。 VP种群构成复杂,有超过154种血清型,有些菌株能产耐热直接溶血素(thermostable direct hemolysin,TDH)或(和)耐热直接溶血素相关溶血素(thermostable direct hemolysin-related hemolysin,TRH),此外基于toxR-S基因序列的差异,Okura 等 [2]发明了群特异性聚合酶链反应(Group-specific polymerase chain reaction,GS-PCR),通过琼脂糖电泳来检测普通PCR有无特定扩增产物,来区分大流行株与非大流行株。另有Nasu等 [3]发现,部分VP菌株基因组中携带噬菌体,如弧菌噬菌体f237在大流行菌株中广泛存在。
此次研究将从血清型、GS-PCR、毒力基因和f237噬菌体的携带上对贝类海产品中的VP菌型分布做一探讨。
1 材料与方法 1.1 材料2013年8 10月购自水产品交易市场的贝类75份,包括双壳纲贝类(Bivalvia)61份,腹足纲(Gastropoda)贝类14份。每份标本采集250 g,其中8月21份,9月28份,10月26份。样品采集后置500 ml无菌塑料采样瓶内,于室温下当日运至实验室并立即进行检测。
对照菌株为上海市疾病预防控制中心鉴定保存的VP菌株,VP13928(O3 ∶ K6,tdh+,trh-,GS-PCR+),AQ4037(O3 ∶ K6,tdh-,trh+,GS-PCR-)。
1.2 方法 1.2.1 标本处理贝类标本的检测前处理按照《食品卫生微生物学检验 副溶血性弧菌检验》(GB/T 4789.7-2008)进行。每份标本以无菌操作取贝类贝壳内容物(包括贝肉和体液)约25 g置于无菌样品袋内,然后加入3% NaCl碱性蛋白胨水225 ml,以拍击式均质器(Bagmixer400p,法国)均质2 min,制成1 ∶ 10均匀稀释液。将1 ∶ 10均匀稀释液置37 ℃增菌培养24 h。用接种环蘸取增菌培养液一满环(约10 μl)于科玛嘉弧菌显色平板(CHROMagar vibrio)上进行划线分离,每份标本接种2块平板,于37 ℃培养24 h。
1.2.2 菌株分离每份标本从2块科玛嘉弧菌显色平板上挑取10个VP疑似克隆再次转种科玛嘉弧菌显色平板进行分纯,置37 ℃培养24 h,典型的VP克隆在科玛嘉弧菌显色平板上呈光滑、圆形、中心为粉色或紫色、边缘透明或灰白,直径约2~3 mm。每原始克隆转种的分纯平板上挑取1个纯的单克隆转种3% NaCl营养琼脂平板,置37 ℃培养18 h。分纯平板上如无纯的单克隆出现,将克隆再次转种科玛嘉弧菌显色平板直至获得纯的单克隆。3% NaCl营养琼脂平板上的新鲜培养物用于VP的DNA提取和血清分型。
1.2.3 菌株DNA提取以无菌棉拭蘸取3%NaCl营养琼脂平板上的新鲜培养物以TE缓冲液(10 mmol/L Tris:1 mmol/L EDTA,pH 8.0)于1.5 ml离心管内制成约1个麦氏浊度单位(约3×108 cfu/ml)的均匀菌悬液,置100 ℃金属加热模块上加热10 min, 12 000×g离心15 min,取上清20 μl加入180 μl TE做10倍稀释混匀后作为PCR扩增的DNA模板。
1.2.4 菌株鉴定用PCR法进行菌株鉴定,引物对为Kim等根据toxR 基因设计的VP种特异性引物,由上海生工合成,使用浓度为10 μmol/L。PCR体系为单一引物对25 μl体系:Premix Taq® (宝生物,TaKaRa Code:RR901A) 12.5 μl,上、下游引物各0.5 μl,DNA模板1.5 μl,以蒸馏水补足反应体系至25 μl。退火温度见表 1。PCR在热循环仪(ABI 9700,美国)热循环程序如下:95 ℃预变性3 min继以95 ℃ 1 min,52 ℃ 1 min,72 ℃ 1.5 min循环25次。PCR结束后取产物5 μl上样于1%琼脂糖凝胶中100 V电泳30 min,凝胶经EB染色30 min,置紫外下观察结果。
1.2.5 菌株血清分型使用VP 11种O分群血清(O1~O11)及65种K分型血清(K1~K71)(Denka-Seiken,日本)进行血清分型。K抗原分型直接取3% NaCl营养琼脂上的新鲜培养物进行玻片凝集,K不可分型记为KUT。O抗原分群以0.85%生理盐水悬浮3% NaCl营养琼脂平板新鲜培养物制成约7个麦氏单位的均匀菌悬液,121 ℃高压1 h后取裂解液进行玻片凝集,O不可分型记为OUT。血清型以O ∶ K组合的方式表示。
1.2.6 VP菌株tdh、trh、GS-PCR检测和噬菌体f237检测toxR检测阳性的菌株均进行tdh、trh、GS-PCR、f237的检测。tdh、trh毒力基因的PCR引物参考Bej的报道,GS-PCR和噬菌体f237的检测引物参考Okura等 [2]的报道。选择弧菌噬菌体f237的10个开放式阅读框中的6个作为PCR检测的靶点,包括orf3~orf8。首先以文献报道中常用的orf8_upper进行检测,考虑到噬菌体感染菌株后可能丢失部分片段,因此在orf8_upper扩增阴性时以 orf3~orf7和orf 8_lower来确认噬菌体f237是部分缺失还是未感染VP。引物对orf3+4扩增产物跨越orf3和orf4,orf6+7扩增产物跨越orf6和orf7,见表 1。
PCR体系为单一引物对25 μl体系:Premix Taq® (宝生物,TaKaRa Code:RR901A) 12.5 μl,按各引物的终浓度加入相应体积引物,DNA模板1.5 μl,以蒸馏水补足反应体系至25 μl,各PCR体系的退火温度见表 1。PCR结束后取产物5 μl上样于1%琼脂糖凝胶中100 V电泳30 min,凝胶经EB染色30 min,置紫外灯下观察结果。
| 引物名称 | 序列(5′~3′) | 终浓度(nmol/L) | 退火温度(℃) | 预期产物(bp) | |
| VP | toxR | f:gtc ttc tga cgc aat cgt tg | 200 | 52 | 367 |
| r:ata cga gtg gtt gct gtc atg | 200 | ||||
| tdh | f:gta aag gtc tct gac ttt tgg ac | 200 | 52 | 270 | |
| r:tgg aat aga acc ttc atc ttc acc | 200 | ||||
| trh | f:ttg gct tcg ata ttt tca gta tct | 400 | 52 | 486 | |
| r:cat aac aaa cat atg ccc att tcc | 400 | ||||
| toxR-S new(1) | f:taa tga ggt aga aac a | 200 | 45 | 651 | |
| r:acg taa cgg gcc tac a | 200 | ||||
| toxR-S old | f:taa tga ggt aga aac g | 200 | 45 | 651 | |
| r:acg taa cgg gcc tac g | 200 | ||||
| f237 | orf 3+4 | f:cgt cgt taa cca gta tgg caa | 200 | 52 | 380 |
| r:tta gct tga cca ccg gat acc | 200 | ||||
| orf 5_F | f:acc cat cat tcc acc gga ta | 200 | 52 | 464 | |
| r:cac caa gcc ctt tta aat cg | 200 | ||||
| orf 6+7 | f:tgc tcg aag aat atg gcg t | 200 | 52 | 470 | |
| r:aaa cct gca ttg acc gag aa | 200 | ||||
| orf 8_upper | f:gtt cgc ata cag ttg agg | 200 | 52 | 746 | |
| r:aag tac agc agg agt gag | 200 | ||||
| orf 8_lower | f:ggg act tta aag aaa caa cga | 200 | 52 | 659 | |
| r:tgc ttc ttc tag cga taa tcc | 200 | ||||
| 注:(1)toxR-S new即GS-PCR的引物。 | |||||
VP:toxR 阳性菌株;产毒株: tdh 或(和)trh阳性菌株;大流行株:GS-PCR阳性且tdh阳性;菌型:血清型、tdh、trh、GS-PCR、f237 5个指标均相同者判为同一菌型,有1个及以上不同则判为不同菌型;优势菌型:同一标本中的克隆构成最高的菌型。
2 结果 2.1 标本VP检出情况75份贝类水产中18份(24.0%)检出VP,双壳纲检出率为26.2%,腹足纲检出率14.3%,见表 2。检出阳性的标本包括彩虹明樱蛤(Moerella iridescens)5份、菲律宾蛤仔(Ruditapes philippinarum)3份、牡蛎(Crassostrea gigas)2份、小刀蛏(Cultellus attenuatus)2份、栉江瑶(Atrina pectinata)、中国圆田螺(Cipangopaludina cahayensis)、四角蛤蜊(Mactra veneriformis)、文蛤(Meretrix meretrix)、大竹蛏(Solen graudis)、环纹货贝(Monetaria annulus)各1份。 自1份文蛤中检出产毒株(trh阳性),检出率1.3%。自牡蛎、环纹货贝、菲律宾蛤仔3份标本检出GS-PCR阳性菌株,检出率4.0%。15份标本检出携带f237的VP菌株,检出率20.0%。所有标本均未检出tdh阳性的菌株,见表 3。
| 纲 | 目 | 科 | 检测数 | VP检出数 |
| 双壳纲(Bivalvia) | 帘蛤目(Veneroida) | 樱蛤科(Tellinidae) | 9 | 5 |
| 帘蛤科(Veneridae) | 17 | 4 | ||
| 刀蛏科(Cultellidae) | 4 | 2 | ||
| 蛤蜊科(Mactriidae) | 13 | 1 | ||
| 竹蛏科(Solenidae) | 2 | 1 | ||
| 牡蛎目(Osteroida) | 牡蛎科(Ostreidae) | 3 | 2 | |
| 贻贝目(Mytioida) | 江瑶科(Pinnidae) | 5 | 1 | |
| 贻贝科(Mytilidae) | 1 | |||
| 珍珠贝目(Pterioida) | 扇贝科(Pectinidae) | 5 | 0 | |
| 海螂目(Myoida) | 缝栖蛤科(Hiatellidae) | 1 | 0 | |
| 蚶目(Arcoida) | 蛤科(Arcidae) | 1 | 0 | |
| 腹足纲(Gastropoda) | 14 | 2 | ||
| 合计 | 75 | 18 |
| 编号 | 菌型数 | 血清型(1) | 来源 | PCR(2) |
| 1 | 1 | O2 ∶ K28(10) | 栉江瑶 | --- |
| 2 | 1 | O10 ∶ KUT(10) | 菲律宾蛤仔 | --- |
| 3 | 3 | O4 ∶ K42(6),O10 ∶ KUT(3),O3 ∶ K6(1) | 大竹蛏 | --- |
| 4 | 4 | O3 ∶ KUT(6) | 牡蛎 | --- |
| O3 ∶ K6(2) | -+- | |||
| O1 ∶ KUT(1),O3 ∶ KUT(1) | --+ | |||
| 5 | 5 | O2 ∶ K3(3),O2 ∶ K28(2),O2 ∶ KUT(2) | 彩虹明樱蛤 | --- |
| O2 ∶ K3(2),O1 ∶ K56(1) | --+ | |||
| 6 | 6 | O2 ∶ K28(5),O5 ∶ K30(1),O1 ∶ KUT(1),OUT ∶ K44(1) | 四角蛤蜊 | --- |
| O2 ∶ K3(1),O5 ∶ K30(1) | --+ | |||
| 7 | 6 | O1 ∶ KUT(3),O3 ∶ KUT(2),O11 ∶ KUT(2),O6 ∶ K18(1) | 小刀蛏 | --- |
| O10 ∶ KUT(1),O11 ∶ KUT(1), | --+ | |||
| 8 | 6 | O10 ∶ KUT(3),O5 ∶ KUT(2),O1 ∶ KUT(1),O4 ∶ KUT(1) | 文蛤 | --- |
| O4 ∶ KUT(2) | +-- | |||
| O10 ∶ KUT(1) | --+ | |||
| 9 | 6 | O5 ∶ KUT(2),O10 ∶ KUT(2),O5 ∶ K30(1) | 菲律宾蛤仔 | --- |
| O5 ∶ K30(3),O10 ∶ KUT(1),O11 ∶ KUT(1) | --+ | |||
| 10 | 6 | O1 ∶ KUT(3),O1 ∶ K46(1),O4 ∶ KUT(1),O11 ∶ KUT(1) | 彩虹明樱蛤 | --- |
| O5 ∶ KUT(2),O10 ∶ KUT(2) | --+ | |||
| 11 | 6 | O10 ∶ KUT(5),O1 ∶ K33(1),O5 ∶ KUT(1) | 菲律宾蛤仔 | --- |
| O1 ∶ K33(1) | -+- | |||
| O1 ∶ KUT(1),O5 ∶ K30(1) | --+ | |||
| 12 | 7 | O1 ∶ KUT(3),O3 ∶ KUT(1),O4 ∶ K42(1),O4 ∶ KUT(1),OUT ∶ KUT(1) | 环纹货贝 | --- |
| O3 ∶ K6(1) | -+- | |||
| O4 ∶ K42(2) | --+ | |||
| 13 | 8 | O2 ∶ KUT(1),O3 ∶ KUT(1),O4 ∶ KUT(1) | 牡蛎 | --- |
| O3 ∶ KUT(3),O1 ∶ K56(1),O2 ∶ KUT(1),O4 ∶ K4(1),O4 ∶ K42(1) | --+ | |||
| 14 | 8 | O1 ∶ KUT(2),O10 ∶ KUT(2),O3 ∶ KUT(1),O11 ∶ K5(1),OUT ∶ KUT(1) | 中国圆田螺 | --- |
| O1 ∶ K33(1),O4 ∶ K42(1),O8 ∶ KUT(1) | --+ | |||
| 15 | 9 | O1 ∶ KUT(1),O2 ∶ K3(1),O3 ∶ KUT(1),O4 ∶ KUT(1) | 小刀蛏 | --- |
| O4 ∶ KUT(2),O1 ∶ KUT(1),O3 ∶ KUT(1),O5 ∶ K30(1),O11 ∶ KUT(1) | --+ | |||
| 16 | 9 | O10 ∶ KUT(2),O4 ∶ K13(1),O4 ∶ K34(1),O11 ∶ KUT(1) | 彩虹明樱蛤 | --- |
| O1 ∶ K36(1),O1 ∶ K45(1),O1 ∶ KUT(1),O2 ∶ KUT(1),O10 ∶ KUT(1) | --+ | |||
| 17 | 9 | O3 ∶ KUT(2),O1 ∶ K25(1),O1 ∶ K46(1),O1 ∶ KUT(1),O4 ∶ K42(1), O5 ∶ KUT(1),O10 ∶ K52(1) O1 ∶ KUT(1),O8 ∶ KUT(1) | 彩虹明樱蛤 | --- --+ |
| 18 | 9 | O3 ∶ KUT(2),O1 ∶ KUT(1),O3 ∶ K45(1),O5 ∶ KUT(1),O6 ∶ K18(1), O10 ∶ KUT(1),O11 ∶ KUT(1),OUT ∶ KUT(1) O5 ∶ KUT(1) | 彩虹明樱蛤 | --- --+ |
| 注:(1)括号内数字为该血清型的克隆数; (2)依次为trh、GS-PCR、f237的PCR结果。 | ||||
18份检出VP的标本中由科玛嘉弧菌显色平板上共挑取180株单克隆,均经toxR PCR确认为VP。这些克隆共可分为28种血清型,在总菌群构成中以K抗原不可分型的居多,其中O ∶ K抗原均可分型66株,占36.7%,O和K抗原均不可分型3株,占1.7%,仅K抗原不可分型110株,占61.1%,仅O抗原不可分型1株。
trh阳性2株检自O4 ∶ KUT血清型克隆,占总克隆构成的1.1%。GS-PCR阳性克隆株血清型为O3 ∶ K6(3株)、O1 ∶ K33(1株),占总菌群构成的2.2%。携带噬菌体f237的47株,占26.1%,见表 3。
综合血清型、tdh、trh、GS-PCR、f237共5个指标,所有的克隆株可分为42种菌型。VP阳性标本中菌型构成不同,最多时可于同一标本中检出9种菌型,最少时仅检出1种,平均菌型数6.1(中位数6.0)。仅有1/3的标本中优势菌型在克隆构成上超过50%,其余标本中优势菌型与非优势菌型在克隆构成上差异并不明显。各标本中优势菌型均不携带毒力基因,也不具有流行菌株的分子特征。
国际大流行株中常见的血清型O3 ∶ K6、O1 ∶ K25、O1 ∶ K36 [4],在贝类标本中也有检出,但检出的这3种血清型 的菌株不具毒力基因,在对应的标本中均不是优势菌型,4株O3 ∶ K6(检自3份标本)在相应标本中的构成分别为2/10、1/10、1/10,且有1株GS-PCR阴性,O1 ∶ K25构成为1/10(检自1份标本),O1 ∶ K36构成为1/10(检自1份标本)。
2.3 VP噬菌体f237的特征f237噬菌体在标本和菌群中具有广泛的分布。被f237感染的VP在血清型上未见明显的聚集趋势,被感染的血清型包括O1 ∶ K33、O1 ∶ K36、O1 ∶ K45、O1 ∶ K56、O1 ∶ KUT、O10 ∶ KUT、O11 ∶ KUT、O2 ∶ K3、O2 ∶ KUT、O3 ∶ KUT、O4 ∶ K4、O4 ∶ K42、O4 ∶ KUT、O5 ∶ K30、O5 ∶ KUT、O8 ∶ KUT。各血清型克隆株被f237感染的构成不同,在10种克隆数超过3个的被感染血清型中,O5 ∶ K30血清型菌株被感染比例最高,占75%,见图 1。但产毒克隆株、GS-PCR阳性克隆株未见被感染。
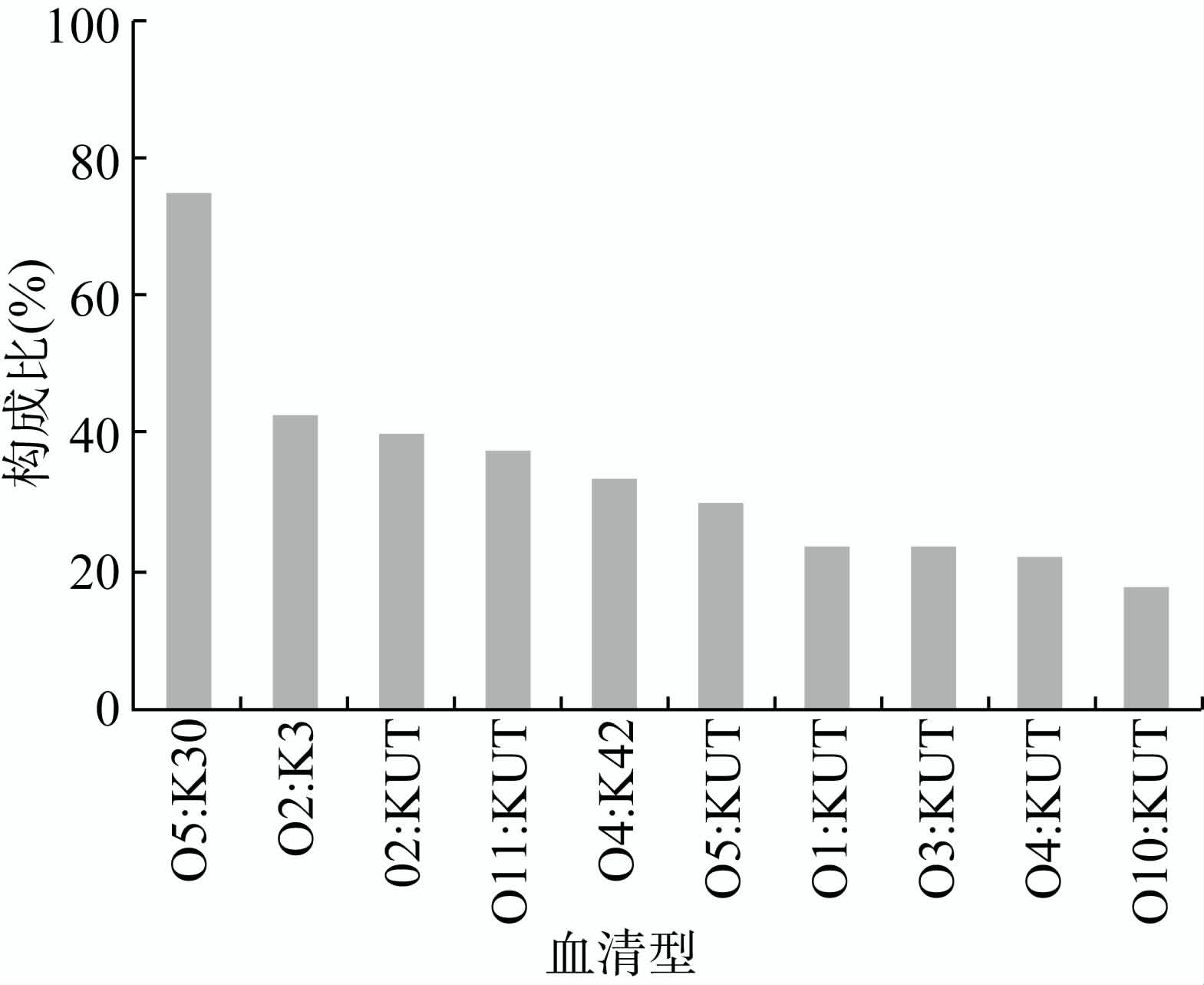
|
| 图 1 VP噬菌体f237在10种血清型中的构成 Figure 1 Proportion of V. parahaemolyticus of phage f237 in 10 serotypes |
此外PCR结果显示了这些VP克隆中的噬菌体的共同特征:具有orf3-7对应的片段,但不具有orf8,见图 2。对orf 8 基因的上游(orf 8_upper)和下游(orf 8_lower)区段分别进行PCR扩增,两区域均未见有扩增产物产生,因此orf8基因在此f237噬菌体中应为完全缺失。
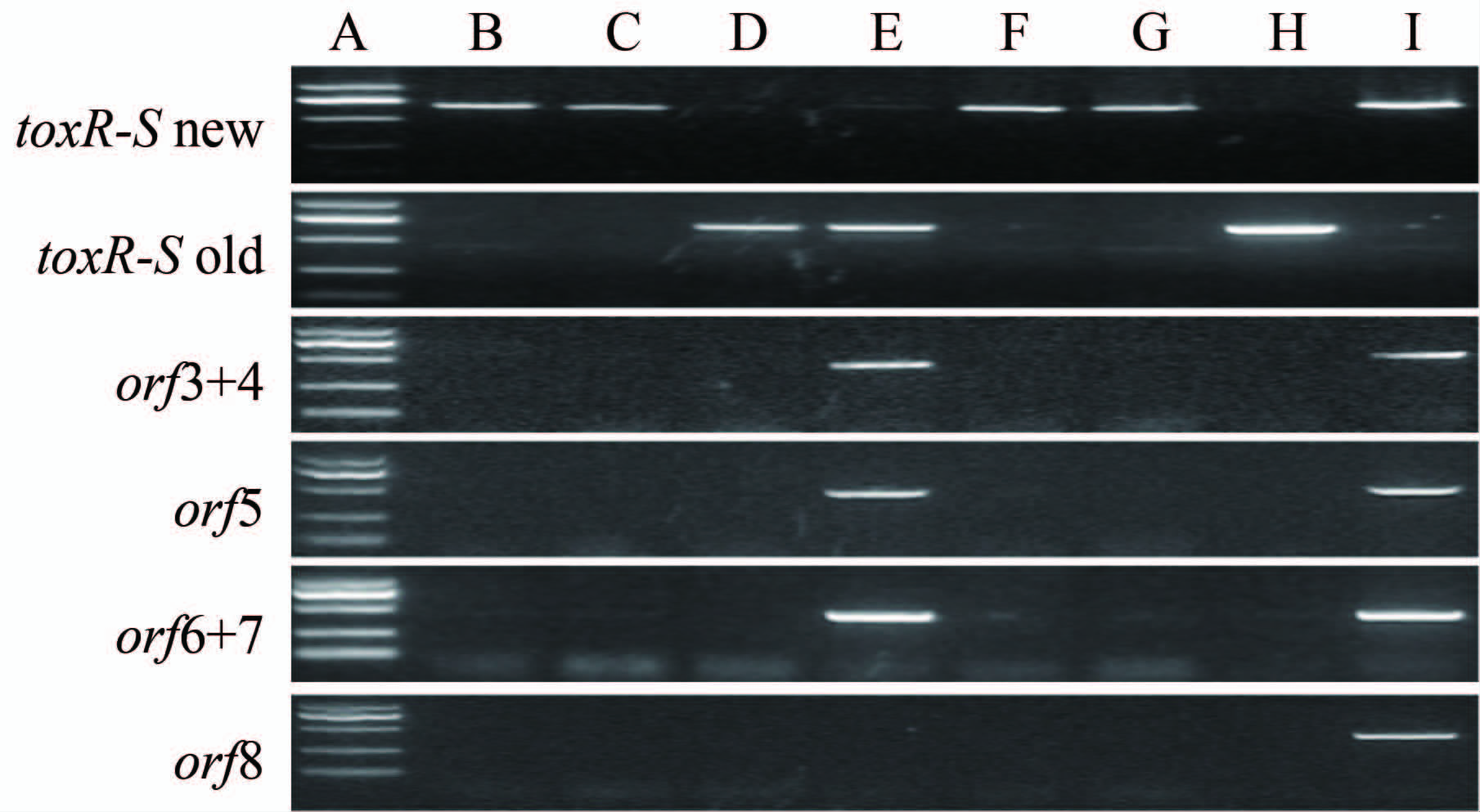
|
| 注:A:DNA长度参照,自下而上分别为100、250、500、750、1000 bp; B:检出自牡蛎,O3 ∶ K6; C:检出自牡蛎,O3 ∶ K6; D:检出自大竹蛏,O3 ∶ K6; E:检出自四角蛤蜊,O5 ∶ K30; F:检出自菲律宾蛤仔,O1 ∶ K33; G:检出自环纹货贝,O3 ∶ K6; H:对照菌株AQ4037; I:对照菌株VP13928。 图 2 检出VP的toxR-S、f237噬菌体PCR产物 琼脂糖凝胶电泳 Figure 2 Agarose gel electrophoresis results of PCR products of V. parahaemolyticus with toxR-S,phage f237 |
Nakaguchi [1]采用PCR检测方法调查了越南、马来西亚、印度尼西亚3国水产品中VP携带情况,数据表明相较于鱼类、虾类、蟹类等水产,贝类具有最高的VP携带率,为66.7%~89.2%。此次研究采用分离培养法,结果显示约有1/4的贝类标本携带VP,由于此次研究贝类种类局限可能是导致检出率与其他研究不一致的原因。
此次研究显示贝类携带的VP在种群上构成复杂,每份标本携带约6种菌型,不同贝类中优势菌型存在差异,有些贝类中优势菌型与其他菌型在构成上差异明显,而有些贝类中各菌型的构成差异不明显。贝类标本中各菌型VP的构成反应的是在自然状态下VP对贝类的污染情况,据文献报道,不同地区的VP在遗传上是存在差异的 [5],由于此次调查并未收集贝类的产地信息,且各科的贝类标本数量较少,因此尚无法评价导致这些差异的原因。
Nasu等 [3]于O3 ∶ K6大流行株中分离到弧菌噬菌体f237,并且发现orf8对O3 ∶ K6菌株具有特异性。研究数据显示 [6],orf8在大流行株中分布广泛。有学者自O4 ∶ K68血清型VP中分离到f237的同源噬菌体VfO4K68,该噬菌体具有f237的orf1~7,但由于其他序列的插入导致orf8的部分缺失,并且此噬菌体仍可感染O3 ∶ K6菌株,所以认为该噬菌体具有传递遗传元件的作用,并在VP的大流行中起了一定的作用 [7]。
此次调查,贝类中检测到的噬菌体均具有f237的orf3~7,从PCR结果上看应为同一种噬菌体。但是该噬菌体缺失了f237的orf8片段。orf 8 基因上、下游区段的PCR检测显示,orf8基因为完全缺失。我们认为这种噬菌体是f237的orf8缺失变种。此次研究结果表明,环纹货贝中存在该orf8完全缺失噬菌体,但该标本中的O3 ∶ K6克隆并不能被感染,由此推断orf8可能在感染O3 ∶ K6血清型VP上起到一定作用。
此次研究中20%的贝类可检测到该噬菌体,表明该噬菌体在贝类中具有广泛的分布。我们认为f237、VfO4K68和此次检测到的噬菌体为同源噬菌体,但由于此次研究并未分离到噬菌体,因此该噬菌体的全基因组结构及其宿主范围尚不能明确测定。
临床株与食品株在血清型、毒力基因携带上常不一致,是VP监测中的常见问题 [8]。此次研究显示, 临床常见血清型的菌株或产毒株在相应食品中并非优势菌株,其构成约为1/10~2/10。但由于目前的VP检测方法的选择性对于不同的VP菌型不具针对性,因此贝类中某种菌型的检出概率取决于该菌型在标本中的原始构成。此次研究显示, 临床常见血清型菌型或产毒菌型在 贝类标本中的构成低于其他菌型,这是否是导致临床常见菌型在食品标本中难以检出的原因?由于此次检测的贝类种类和数量有限,因此明确这一疑问尚需进一步扩大检测贝类的种类和数量。
有研究表明同一临床标本中也存在同时检出多种菌型的VP,但产毒株的构成明显高于非产毒株,血清型上也多为临床常见血清型 [5]。说明人体对摄入的VP具有选择性作用,常能抑制或消除非致病VP菌型,而对致病性菌型常不具抑制作用。致病菌株能利用人体进行增值,进而在肠道内成为优势菌型,使临床标本更易于检出致病菌型。这可能也是临床株与食品株在血清型、毒力基因携带上常不一致的原因。
由于贝类具有滤食性,且滤水量较高,如牡蛎的滤水量可达5~25 L/h,扇贝可达3~5 L/h,因此贝类滤食器官鳃对病原微生物的富集具有重要作用,但此次研究检测的是贝类的贝壳内容物,并未考虑贝类不同器官对VP检测的影响。此外,此次研究贝类的种类主要为双壳纲,种类偏少,曾在上海等沿海地区引起甲型病毒性肝炎流行的毛蚶并未在检测范围之内,周缀琴等 [9]报道毛蚶中VP的检出率可达40%,这也是本研究的局限之一。
总之,食品中VP的检验需建立在对人致病的主要菌型掌握的基础上,检测应充分考虑血清型、基因型。相对于已经废止的检测标准(GB/T 4789-2003、SN 0173-1992等),目前已有部分检测标准(GB/T 4789.7-2013、SN/T 0173-2010等)已考虑到血清分型和毒力因子检测在VP检测中的重要作用,但这些目前仍不是必检项目。
| [1] | Nakaguchi Y. Contamination by Vibrio parahaemolyticus and its virulent strains in seafood marketed in Thailand, Vietnam, Malaysia, and Indonesia[J]. Trop Med Health,2013,41(3):95-102. |
| [2] | Okura M, Osawa R, Iguchi A, et al. Genotypic analyses of Vibrio parahaemolyticus and development of a pandemic group-specific multiplex PCR assay[J]. J Clin Microbiol,2003,41(10):4676-4682. |
| [3] | Nasu H, Iida T, Sugahara T, et al. A filamentous phage associated with recent pandemic Vibrio parahaemolyticus O3:K6 strains[J]. J Clin Microbiol,2000,38(6):2156-2161. |
| [4] | Nair GB, Ramamurthy T, Bhattacharya SK,et al. Global dissemination of Vibrio parahaemolyticus serotype O3:K6 and its serovariants[J]. Clin Microbiol Rev, 2007, 20(1):39-48. |
| [5] | Urmersbach S, Alter T, Koralage MS, et al. Population analysis of Vibrio parahaemolyticus originating from different geographical regions demonstrates a high genetic diversity[J]. BMC Microbiol,2014,14(1):59. |
| [6] | Chen HY, Sheng YY, Song YJ,et al. Serotypes and molecular characteristics of Vibrio parahaemolyticus pandemic strains in Shanghai[J]. Chinese Journal of Food Hygiene,2014,26(1):5-9. (in Chinese) 陈洪友,盛跃颖,宋元君,等. 上海地区副溶血性弧菌大流行菌株血清型及分子特征研究[J]. 中国食品卫生杂志,2014,26(1):5-9. |
| [7] | Chan B, Miyamoto H, Taniguchi H, et al. Isolation and genetic characterization of a novel filamentous bacteriophage, a deleted form of phage f237, from a pandemic Vibrio parahaemolyticus O4:K68 strain[J]. Microbiol Immunol,2002,46(8):565-569. |
| [8] | Chen HY, Sheng YY, Tu LH, et al. Serotypes and virulence genes distribution among Vibrio parahaemolyticus in Shanghai[J].Journal of Microbes and Infections,2012,9(1):37-42. (in Chinese) 陈洪友,盛跃颖,屠丽红,等. 2012年上海地区副溶血性弧菌血清分型和毒力基因携带状况研究[J]. 微生物与感染,2014,9(1):37-42. |
| [9] | Zhou ZQ, Yu Y, Shi YS,et al. Detection and analysis of Vibrio vulnificus and Vibrio parahaemolyticus in 7 seafoods in Zhoushan markets[J]. Chinses Journal of Health Laboratory Technology,2013,23(17):3432-3435.(in Chinese) 周缀琴,虞艳,石亚素,等. 舟山市七种市售海产品中创伤弧菌、副溶血性弧菌等检测分析[J]. 中国卫生检验杂志,2013,23(17):3432-3435. |
 2014, Vol. 29
2014, Vol. 29


