扩展功能
文章信息
- 吴庆, 陈栎江, 徐春泉, 邹安庆, 王赛芳, 张雪青
- WU Qing, CHEN Li-jiang, XU Chun-quan, ZOU An-qing, WANG Sai-fang, ZHANG Xue-qing
- 万古霉素耐药肠球菌的药敏表型及基因特性研究
- Susceptibility phenotypes and genetic characteristics of vancomycin-resistant Enterococci
- 疾病监测, 2014, 29(8): 656-659
- Disease Surveillance, 2014, 29(8): 656-659
- 10.3784/j.issn.1003-9961.2014.08.016
-
文章历史
- 收稿日期:2013-12-12
近年来抗菌药物的广泛应用,使肠球菌对多种抗菌药物产生耐药,并成为导致医院感染的重要病原菌,特别是近年出现的万古霉素耐药肠 球菌 (vancomycin-resistant enterococci,VRE)给临床治疗造成困难。VRE可将耐药性传递给其他肠球菌或其他种类的细菌,尤其是毒力更强的甲氧西林耐药金黄色葡萄球菌 (methicillinresistant staphylococcus aureus,MRSA),导致万古霉素耐药金黄色葡萄球菌(vancomycin-resistant Staphylococcus aureus,VRSA)的出现[ 1, 2 ]。一旦VRSA出现并造成传播,革兰阳性球菌的感染治疗将受到严峻考验。近年来VRE分离率迅速增加,因此,亟须对我国VRE菌株特征及耐药传播机制进行研究,从而控制我国VRE菌株传播以及预防和控制VRSA菌株在我国的出现和流行。
1 材料与方法 1.1 菌株来源2011年1月至2012年12月在温州医科大学附属第一医院收集的不同临床标本中分离到万古霉素耐药肠球菌23株。经生物梅里埃公司 VITEK 2 COMPACT全自动微生物分析仪及其配套的GP鉴定卡鉴定,均为屎肠球菌。药敏试验质控菌株粪肠球菌(ATCC29212),购自卫生部临床检验中心。
1.2 试剂MH琼脂干粉、哥伦比亚琼脂干粉、脑心浸出液(BHI)琼脂干粉:购自英国Oxiod公司。细菌鉴定的GP卡和药物敏感试验的GP67卡:购自法国生物梅里埃公司。 聚合酶链反应(PCR)试剂盒:购自上海生工生物工程技术服务有限公司,包括: Taq酶、 dNTPs、 MgCl2、buffer缓冲液、引物。万古霉素为中国药品生物制品检定所标准品。抗生素浓度梯度条(Etest条):万古霉素、替考拉宁购自瑞典AB Bio Disk公司。
1.3 菌株鉴定通过菌落形态、革兰染色镜检、触酶等试验后,经VITEK 2 COMPACT全自动微生物分析仪及其配套鉴定卡鉴定至种。
1.4 VRE的筛选根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)操作规则,采用琼脂筛选法,用含万古霉素6 μg/ml的BHI琼脂平板,接种细菌106 cfu/点于平板上,35 ℃培养24 h,点种处即便有1个菌落生长则为VRE。
1.5 药物敏感性试验采用VITEK 2 COMPACT全自动微生物鉴定系统和抗生素浓度梯度条(Etest条)法检测细菌的耐药性,结果判定根据CLSI推荐的标准,药敏试验质控菌株为粪肠球菌(ATCC29212),购自卫生部临床检验中心。
1.6 VRE基因的检测用煮沸法提取PCR的模板,运用PCR的方法检测VRE基因型。PCR引物的设计:根据文献[ 3 ]设计引物,PCR引物及产物长度见表 1。PCR反应体系采用50 μl体系:10×buffer 5 μl,dNTP 100 μmol/L,Mg2+1.5 mmol/L,正反向引物各大0.1 μmol/L,5 U/ μl的rTaq聚合酶0.2 μl,模板DNA 4 μl,ddH2O 加至50 μl。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,退火温度为55 ℃ 30 s,72 ℃延伸30 s,共30个循环,最后一个循环延伸10 min。PCR产物取5 μl于1%琼脂糖凝胶电泳,电泳结束后,使用synGene公司的Gene Genius Bio imaging system 紫外凝胶分析系统检测结果,若出现与阳性模板分子量相同的条带即为阳性。并拍下照片分析。
| 基因 | 引物序列 | 产物分子质量(bp) |
| VanA | 5′-GCT ATT CAG CTG TAC TC-3′ | 783 |
| 5′-CAG CGG CCA TCA TAC GG-3′ | ||
| VanB | 5′-ATG GGA AGC CGA TAG TC-3′ | 635 |
| 5′-GAT TTC GTT CCT CGA CC-3′ | ||
| VanC1 | 5′-GGT ATC AAG GAA ACC TC-3′ | 822 |
| 5v-CTT CCG CCA TCA TAG CT-3′ | ||
| VanC2/3 | 5′-CTC CTA CGA TTC TCT TG-3′ | 439 |
| 5′-CGA GCA AGA CCT TTA AG-3′ |
分别随机抽取5份VanA基因阳性的PCR产物,由上海生工 生物工程技术服务有限公司进行核苷酸序列测定,测序结果在GenBank序列数据库进行基因相似性分析(Blast),见表 1。 2 结果 2.1 VRE的筛选结果
经重新鉴定均为屎肠球菌,且均能在含6 μg/ml万古霉素的BHI筛选平板上生长,为VRE。
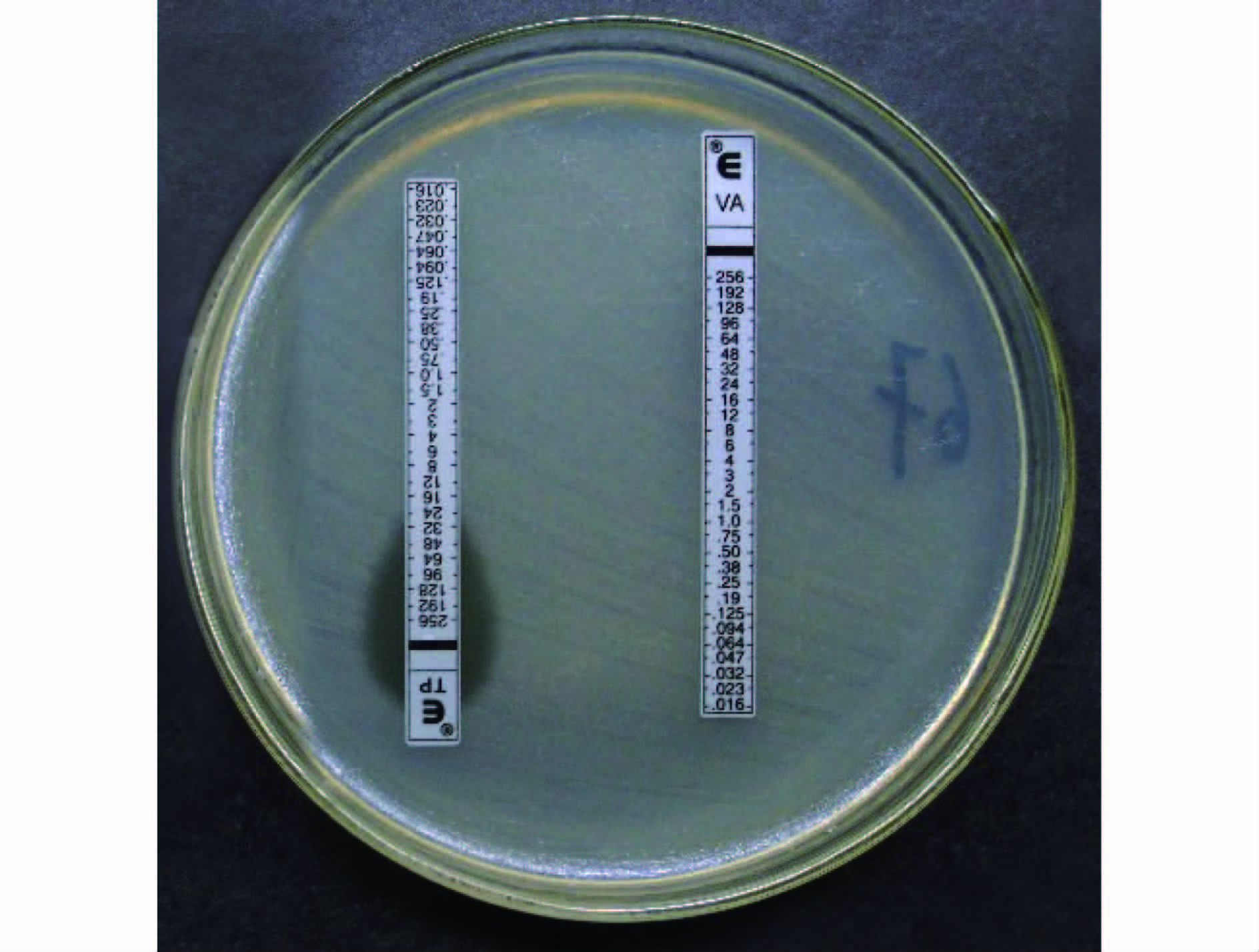
2.2 6种抗菌药物对VRE的抗菌活性23株VRE对糖肽类抗菌药物万古霉素的 最小抑菌浓度(MIC)>256 μg/ml;替考拉宁MIC≥32 μg/ml的有19株(图 1),MIC 为24 μg /ml有4株 (图 2)。23株VRE的临床分布特征及抗菌药物的最低抑菌浓度见表 2。

|
| 注:万古霉素和替考拉宁均为耐药。 图 1 万古霉素的MIC>256 μg/ml; 替考拉宁MIC≥32 μg/ml的菌株 Figure 1 Strains of Vancomycin MIC>256 μg/ml; teicoplanin MIC≥32 μg/ml |
|
| 注:万古霉素耐药,替考拉宁中介。 图 2 万古霉素的MIC>256 μg/ml; 替考拉宁MIC=24 μg/ml的菌株 Figure 2 Strains of Vancomycin MIC>256 μg/ml; teicoplanin MIC=24 μg/ml |
| 标本号 | 标本类型 | 患者性别 | 病区 | Etest法 | VITEK 2 COMPACT | |||||
| VA | TP | LEV | AMP | TE | E | |||||
| 1 | 尿液 | 女 | 呼吸内科 | >256 | 96 | ≥8 | ≥16 | 4 | ≥8 | |
| 2 | 尿液 | 女 | ICU | >256 | 32 | ≥8 | ≥16 | 4 | ≥8 | |
| 3 | 粪便 | 男 | 神经内科 | >256 | >256 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 4 | 尿液 | 女 | ICU | >256 | 24 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 5 | 尿液 | 女 | ICU | >256 | 64 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 6 | 粪便 | 男 | ICU | >256 | >256 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 7 | 尿液 | 女 | 肾内科 | >256 | 64 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 8 | 粪便 | 男 | 呼吸内科 | >256 | 24 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 9 | 尿液 | 男 | ICU | >256 | 32 | ≥8 | ≥16 | 2 | ≥8 | |
| 10 | 粪便 | 女 | 新生儿科 | >256 | 64 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 11 | 粪便 | 女 | 呼吸内科 | >256 | 128 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 12 | 痰液 | 女 | 呼吸内科 | >256 | 24 | 2 | 2 | ≤1 | ≥8 | |
| 13 | 尿液 | 女 | ICU | >256 | 32 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 14 | 粪便 | 男 | 神经外科 | >256 | 64 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 15 | 胆汁 | 女 | ICU | >256 | 128 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 16 | 粪便 | 女 | 神经内科 | >256 | 24 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 17 | 引流液 | 男 | ICU | >256 | 96 | ≥8 | ≥16 | 2 | ≥8 | |
| 18 | 尿液 | 女 | 呼吸内科 | >256 | 32 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 19 | 尿液 | 男 | 呼吸内科 | >256 | >256 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 20 | 痰液 | 男 | ICU | >256 | 24 | ≥8 | ≥16 | ≤1 | ≥8 | |
| 21 | 粪便 | 女 | 创伤外科 | >256 | 64 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 22 | 胆汁 | 女 | 呼吸内科 | >256 | 96 | ≥8 | ≥16 | ≥16 | ≥8 | |
| 23 | 粪便 | 男 | 神经内科 | >256 | 32 | ≥8 | ≥16 | 8 | ≥8 | |
| 注:VA(万古霉素),TP(替考拉宁),LEV(左旋氧氟沙星),AMP(氨苄西林),TE(四环素),E(红霉素)。 | ||||||||||
结果显示:23株VRE对红霉素均耐药(100%),22株对左旋氧氟沙星和氨苄西林耐药(95.6%),11株对四环素耐药(47.8%)。
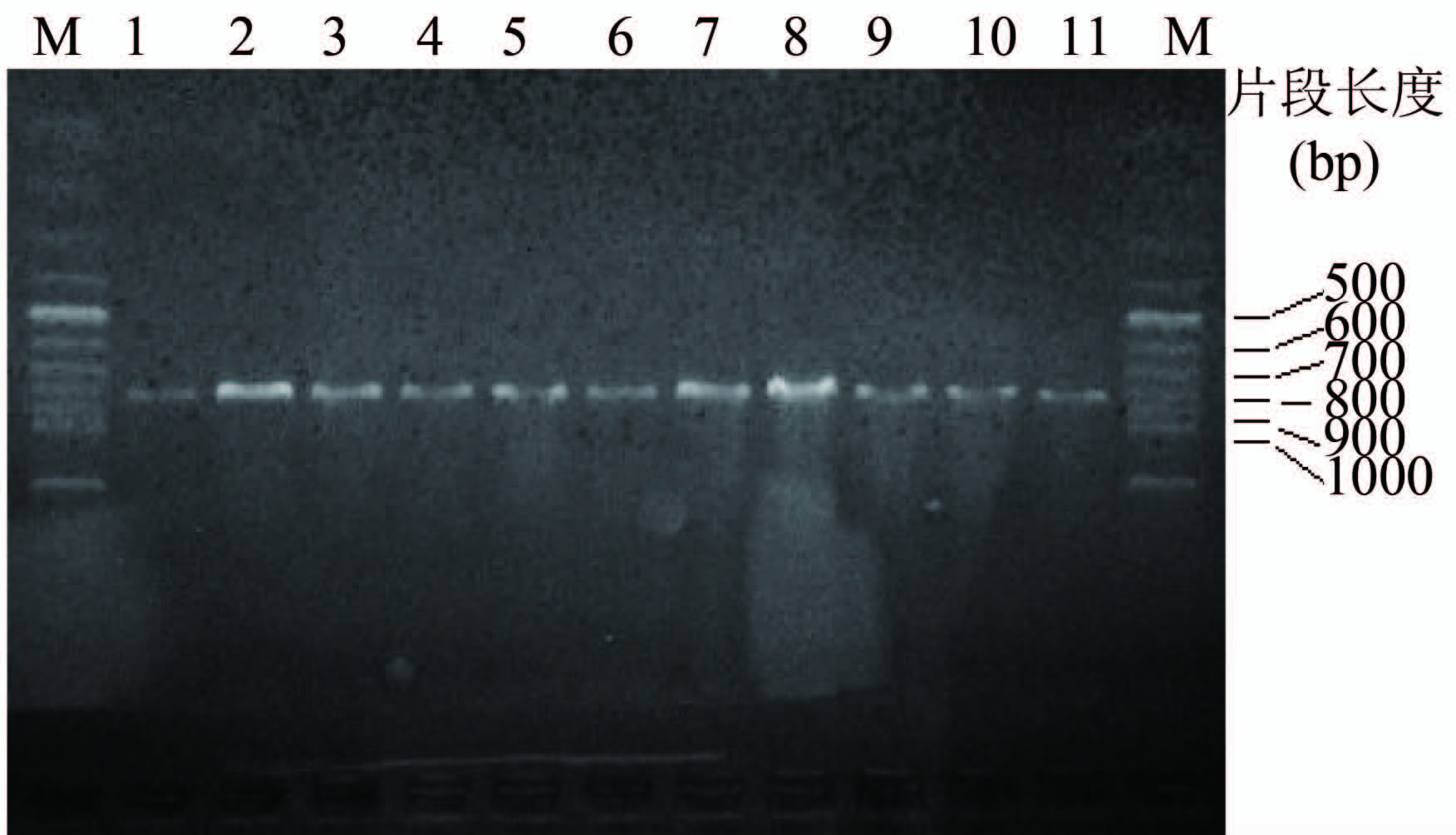
2.3 万古霉素耐药基因检测结果经PCR扩增,均获得VanA基因阳性片段,未检测到VanB、VanCl及VanC2/3基因,见图 3。
|
| 注:1~11:VRE菌株,M:Marker 图 3 VRE菌株VanA PCR扩增电泳结果 Figure 3 Gel electrophoresis results of PCR amplification of VanA gene of VRE strains |
VanA基因的PCR产物,进行核苷酸序列测定,测定结果在GenBank序列数据库进行序列比对(Blast),结果显示,本研究所测得的VanA基因序列与GenBank序列数据库的已知序列一致(GenBank M97297)。
3 讨论美国2004年对670家医院的耐药监测显示VRE位于医院耐药菌第2位[ 4 ],到2005年VRE发生率为28%左右[ 5 ],而另一项由28个国家700个临床微生物实验室参加的欧洲1999 2002年的EARSS[ 6 ]监测资料报道,粪肠球菌的万古霉素耐药菌株为7%,屎肠球菌为37%。我国近年细菌耐药监测结果表明,各地VRE发生率有较大差异,在0~10%左右[ 7, 8 ]。
糖肽类抗菌药物(万古霉素和替考拉宁)通过阻止细胞壁合成,使细菌死亡。肠球菌对万古霉素的耐药基于细胞产生了一种前体,其末端基因变化, 万古霉素无法与之结合而不能抑制细胞壁的合成。VRE的分类基于对万古霉素和替考拉宁的耐药水平、诱导性及转移性的不同,可将VRE基因型分为VanA、VanB、VanC(C1、C2、C3)、VanD、VanE、VanG等6种表型。其中只有VanA和VanB型有重要临床意义。VanA和VanB型VRE不仅具有较高的万古霉素耐药性,而且其耐药因子能转移,是引起感染和流行的主要病原体。
VanA型耐药菌株是最先被报道的,对其耐药机制研究的比较清楚。该型耐药菌株多见于屎肠球菌和粪肠球菌,可被万古霉素和替 考拉宁诱导产生,当VRE所在的环境中有糖肽类抗菌药物存在时,位于膜上的VanS蛋白发生自我磷酸化而激活,并将信号传递给细胞质中VanR蛋白而使其 活化。活化的VanR蛋白的DNA结合域与调节基因vanR和抗性基因VanH的启动子PR和PH的调节区相结合,从而激活抗性基因和调节基因的转录活性,使其大量表达。VanA型耐药性由转座子Tn1546及其类似的转座子介导。Tn1546及其类似的转座子有的位于VRE的某些质粒上(如pHKK100),有的位于VRE的染色体上。携带这些转座子的质粒通过肠球菌的接合作用将VanA 型耐药因子转移给别的肠球菌或其他革兰阳性菌。VRE耐药因子转移机制相当复杂,除了目前研究较为清楚的Tn1546系列转座子外,还发现一类介导耐药因子转移的结合型转座子Tn916。Tn916 转座子是一种相容性非常高的转座子,不仅在G+ 菌中有广泛的宿主,甚至在G-菌中也有宿主。因此这种能介导耐药因子转移的转座子极有可能引起VRE感染的暴发和形成各种多重抗药性菌株[ 9 ]。本实验中的23株VRE均为VanA型的屎肠球菌,基因型和表型一致,由此看出VanA 型是临床上常见的耐药类型。
VRE对糖肽类抗菌药物万古霉素甚至替考拉宁均呈不同程度耐药,对左旋氧氟沙星(22/23)、氨苄西林(22/23)和红霉素(23/23)也表现出高 度耐药,只有对四环素表现出一定的敏感性(23株VRE中,对四环素敏感的有12株)。说明VRE具有多重耐药性。肠道中携带的VRE是造成医院感染和耐 药菌株散播的潜在危险因素。本研究中,23株VRE9株来自重症监护室(ICU),7株来自呼吸内科,3株来自于神经内科(表 2), 这些病区的患者均属于重症患者或者手术后患者,需要长时间住院患者。广谱抗生素的大量使用,破坏了肠道内的微生态平衡,使肠黏膜上的许多细菌定植靶位暴露 出来,由于肠球菌对头孢菌素、克林霉素、磺胺类、氨基糖苷类等抗菌药物呈多重耐药,并且屎肠球菌对抗菌药物的耐药率明显高于粪肠球菌。从而使屎肠球菌被选 择为优势菌群,进而可导致肠源性感染的发生。本次研究中的23株VRE中,9株来自于菌群失调患者的粪便标本,9株来自于尿液标本(7株来自于女性患 者),说明VRE可能来自于内源性感染。
肠球菌属为条件致病菌,临床上广谱抗菌药物的 使用破坏了正常菌群的保护作用,降低了消化道对外源微生物的抵抗力,有利于肠球菌属的定植并过度生长,增加了其感染的危险性。此外,VRE 的耐药基因可通过质粒转移给其他肠球菌属或其他种类的细菌如金黄色葡萄球菌,产生多重耐药性。临床实验室在发现可疑VRE菌株后应加以确证,采用合适的药 敏方法准确测定其MIC;鉴于VRE治疗困难且多重耐药严重,实验室需要及时与临床医生联系,并提供药敏结果做参考以避免经验用药贻误病情;实验室有必要 向临床医生宣传万古霉素应用指征,以防止滥用万古霉素而导致VRE出现,同时联系医院感染管理部门采取隔离VRE患者、实验室和病房严格消毒以及严格医疗 操作等措施控制VRE传播。
| [1] | Dahl KH, Simonsen GS, Olsvik O, et al.Heterogeneity in the VanB gene cluster of genomically diverse clinical strains of vancomycin—resistant enterococci[J].Antimicrob Agents Chemother, 1999, 43(5):1105-1110. |
| [2] | Barnaud G, Bingen E.Genotypic characterization of endemic VanA Enterococcus faecium strains isolated in a paediatric hospital[J].J Med Microbiol, 2000, 49(9):793-799. |
| [3] | Depaidieu F, Perichon B, Courvalin P.Detection of the van alphabet and identification of enterococci and staphylococci at the species level by multiplex PCR[J].J Clin Microbiol, 2004, 42(12):5857-5860. |
| [4] | Diekema DJ, BootsMiller BJ, Vaughn TE, et al.Antimicrobial resistance trends and outbreak frequency in United States hospitals[J]. Clin Infect Dis, 2004, 38(1):78-85. |
| [5] | Tenover FC, McDonald LC.Vancomycin-resistant staphylococci and enterococci: epidemiology and control[J]. Current Opinion in Infectious Diseases, 2005, 18(4):300-305. |
| [6] | EARSS annual Report 2002[EB/OL].(2013-09-15).http://www.earss.rivm.nl. |
| [7] | Bian JD, Li XM, Liu YL. The clinical distribution and analysis of drug resistance of 565 Enterococcus strains[J].Shandong Medical Journal, 2005, 45(19):17. (in Chinese) 边进东, 李秀敏, 刘玉琳.565株肠球菌分布及耐药性分析[J]. 山东医药, 2005, 45(19):17. |
| [8] | Ma Y, Li JY, Zhang XM, et al. Antimicrobial resistance of clinical bacteria in national surveillance network in 2002[J]. Chinese Journal of Laboratory Medicine, 2004, 27(1):38-45. (in Chinese) 马越, 李景云, 张新妹, 等.2002年临床常见细菌耐药性监测[J]. 中华检验医学杂志, 2004, 27(1):38-45. |
| [9] | del Campo R, Tenorio C, Jiménez-Díaz R, et al.Bacteriocin production in vancomycin-resistant and vancomycin-susceptible Enterococcus isolates of different origins[J]. Antimicrob Agents Chemother, 2001, 45(3):905-912. |
 2014, Vol. 29
2014, Vol. 29


