扩展功能
文章信息
- 王鸣柳, 闫梅英, 阚飙, 樊粉霞
- WANG Ming-liu, YAN Mei-ying, KAN Biao, FAN Feng-xia
- 基于单一基因的反转录-环介导等温核酸扩增技术快速检测甲型副伤寒沙门菌
- Rapid detection of Salmonella paratyphi A by reverse transcription loop-mediated isothermal amplification
- 疾病监测, 2014, 29(9): 752-757
- Disease Surveillance, 2014, 29(9): 752-757
- 10.3784/j.issn.1003-9961.2014.09.021
-
文章历史
- 收稿日期:2014-7-2
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. Chinese Center for Disease Control and Prevetnion, Beijing 102206, China
伤寒、甲型副伤寒是发展中国家威胁人群健康的重要公共卫生问题,在非洲、东南亚以及我国广西、贵州等地持续多发,并引起暴发流行。甲型副伤寒是由甲型副伤寒沙门菌感染引起的以发热症状为主的全身感染性疾病,与由伤寒沙门菌引起的伤寒及其他引起人类发热症状的病原菌(统称非沙门菌)在临床表现上难以区分,目前也没有很好的分子生物学技术能够特异性的、简单快捷的区分甲型副伤寒沙门菌与伤寒沙门菌及其他非沙门菌。目前对于甲型副伤寒沙门菌、伤寒沙门菌及其他非沙门菌的鉴别主要通过细菌培养、生化反应和血清型鉴定,需时较长。因此,对伤寒、甲型副伤寒的快速灵敏诊断一直是该病以及相关传染病检测、监测和应急中亟待解决的问题。
已有研究报道了针对甲型副伤寒沙门菌的基于核酸扩增的聚合酶链反应(PCR)检测方法[1, 2, 3, 4],但需要同时扩增多个基因进行甲型副伤寒沙门菌与其他沙门菌的甄别,增加了实验操作及结果判定的复杂性。环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是近年来发展起来的一种灵敏、特异、方便快捷的核酸扩增技术,扩增产物不经过电泳,通过肉眼观察或浊度计即可判定结果。由于该技术与PCR一样具有扩增效率高、反应灵敏、特异性强的特点,加之其不需要特殊仪器,更适应于基层推广应用,因而被应用到多种细菌及病毒的基因检测[5, 6]。本研究根据甲型副伤寒沙门菌的单一特异性基因hsdM,通过对多个沙门菌血清型及多种病原的检测评价,筛选到了一组特异性好、灵敏度高的LAMP引物用于甲型副伤寒沙门菌核酸检测,能够很好的鉴别甲型副伤寒沙门菌。 1 材料与方法 1.1 实验用菌株
本研究所用的沙门菌属菌株、霍乱弧菌、金黄色葡萄球菌、副溶血弧菌均为本实验室保存,其中甲型副伤寒沙门菌130株,伤寒沙门菌10株,乙型和丙型副伤寒沙门菌以及其他31种非伤寒沙门菌血清型共306株,见表 1,血清分型均使用丹麦SSI沙门菌诊断血清。另外,其他肠道常见病原菌及引起发热并可在血液标本中分离到的肺炎链球菌、伯氏疏螺旋体、钩端螺旋体、嗜肺军团菌、脑膜炎奈瑟菌、立克次体、布鲁氏菌等菌株(表 1)作为检测甲型副伤寒沙门菌的特异性评价,来自中国疾病预防控制中心传染病预防控制所。
| 沙门菌属 | RT-LAMP | 沙门菌属 | RT-LAMP | 病原体 | RT-LAMP | ||||
| 血清型 | 株数 | 血清型 | 株数 | 血清型 | 株数 | ||||
| S. Paratyphi A | 130 | + | S. Montevideo | 1 | - | Enteric pathogens | |||
| S. Typhi | 10 | - | S. Stanly | 1 | - | V. cholerae serogroup O1 | 2 | - | |
| S. Paratyphi B | 2 | - | S. Pomona | 1 | - | V. cholera serogroup O139 | 2 | - | |
| S. Paratyphi C | 1 | - | S. Potsdam | 1 | - | V. parahaemolyticuss | 2 | - | |
| S. Cholera suis | 1 | - | S. Mbandaka | 1 | - | Shigella spp. | 4 | - | |
| S. Typhimurium | 32 | - | S. Istanbul | 1 | - | ETEC | 1 | - | |
| S. Enteritidis | 32 | - | S. Hvittingfoss | 1 | - | - | |||
| S. Derby | 21 | - | S. Litchfield | 1 | - | Febrile pathogens | - | ||
| S. Thompson | 15 | - | S. Indiana | 1 | - | S. aureus | 5 | - | |
| S. Senftenberg | 2 | - | S. Gateshead | 1 | - | S. peumoniae | 1 | - | |
| S. Weltevreden | 2 | - | S. Virchow | 1 | - | Borrelia burgdorferi | 1 | - | |
| S. Agona | 10 | - | S. Wilhelmsburg | 1 | - | Leptospira | 1 | - | |
| S. Aberdeen | 1 | - | S. Wandsworth | 1 | - | Legionella | 1 | - | |
| S. Anatum | 1 | - | S. Schwarzengrund | 1 | - | N. meningitis | 1 | - | |
| S. Meleagridis | 1 | - | S. Livingston | 1 | - | Rickettsia | 1 | - | |
| S. Sandiego | 1 | - | S. Liverpool | 1 | - | Brucella | 3 | - | |
| S. Uganda | 1 | - | S. Stanlyville | 1 | - | ||||
| S. Kentukey | 1 | - | |||||||
经全基因组序列比对及普通PCR扩增产物测序(PCR引物SPA-48F、SPA-48R,见表 2),发现hsdM是甲型副伤寒沙门菌的特 异基因,且保守性达100%(10/10)。根据GenBank中甲型副伤寒沙门参考株ATCC9150的hsdM基因序列,利用LAMP Primer Explorer 4软件(日本荣研公司)设计相应的RT-LAMP引物(表 2),主要包括外引物F3、B3,内引物FIP、BIP,环引物Loop F、Loop B。
| 引物 | 序列(5′~ 3′) |
| SPA-48F | TGG GTG CAA TGT ACA TTG CTG |
| SPA-48R | GGA GCG TAA ATC GAG TGT ATT |
| SPA-48-5-F3 | CCT GTT AGA AGT GTT TAC AAC TT |
| SPA-48-5-B3 | GCT AAA CCA CCA AAT TGT GT |
| FIP | CCA ATA GAA ATC CTC GGC CAG-CCG AGT TTT GAT AAG GAT GAT TG |
| BIP | AAC CCT TCA AAA CTA CCA AGT CC-GAA TCT TTA ACA CGC AAC TTT C |
| Loop F | TGA GGT TGG ATT CCA T |
| Loop B | ATT GAG TGG GTT AAC AAA |
从平板上挑取甲型副伤寒菌株单克隆培养过夜,按1 ∶ 100重新培养,A=0.6左右收集菌液提取总RNA,使用RNeasy Mini Kit(QIAGEN公司),操作步骤均严格按照说明书进行。纯菌总RNA提取测定浓度后,对总RNA 进行稀释,最后选取0.001、 0.01、 0.1、 1、 10 ng/μl共5个浓度梯度,从各浓度各取5 μl作为检测模板,检测LAMP引物的灵敏度。 1.4 血模拟标本的制备及RNA提取
取新鲜培养4~6 h细菌(最终菌落计数为3.5×108 cfu/ml),10倍梯度系列稀释为101 ~106 cfu/ml,取各稀释度菌液2 ml分别与同体积新鲜人抗凝血混匀,室温放置30 min后,作为全血模拟标本。利用QIAamp UCP PurePathogen Blood fieldtest Kit(QIAGEN公司)对上述模拟标本进行甲型副伤寒沙门菌RNA的提取,具体操作步骤严格按照说明书进行。同时以不加甲型副伤寒沙门菌的血液作为阴性对照(NC)平行进行RNA提取。 1.5 粪便模拟标本制备及RNA提取
(1)取新鲜培养4~6 h细菌(最终菌落计数为8.0×108 cfu/ml),梯度系列稀释为104~101、5、 1、 0.5、 0.25、 0.125 cfu/ml。然后取以上菌液各500 μl与3 g健康人粪便混匀。
(2)取(1)中的混合样品0.2 g,加入200 μl TE,蜗旋振荡,1000 r/min 离心1 min,去掉沉淀,上清8000 r/min 离心5 min,弃上清,沉淀用1 ml TE 重悬,振荡,8000 r/min 5 min,弃上清,保留沉淀,用100 μl TE 悬菌,水煮10 min,8000 r/min 5 min,保留上清,去沉淀。此上清为增菌前样品粗提核酸。
(3)在(1)中的样品中各加入SC增菌液5 ml,混匀,37 ℃ 培养过夜。第二天取增菌后样品1 ml,按步骤(2)操作,制备增菌后样品核酸粗提品。 1.6 临床血液样本RNA提取
取甲型副伤寒患者血液标本4~5 ml,利用QIAamp UCP PurePathogen Blood fieldtest Kit(QIAGEN公司)进行病原菌总RNA的提取,具体操作步骤严格按照说明书进行。最终提取的RNA溶解到50 μl不含RNase的无菌纯水中,取其中5 μl作模板进行反转录-环介导恒温扩增反应(Reverse transcription loop-mediated isothermal amplificatio,RT-LAMP)反应。 1.7 LAMP 反应
利用Loopamp RNA Amplification Kit(日本荣研公司)试剂进行 RT-LAMP体系的设立,总反应体系为25 μl,其中2×reaction mix buffer 12.5 μl ,两条外引物F3、B3各5 pmol/L,两条内引物FIP、BIP各40 pmol/L,两条环引物各20 pmol/L,1 μl的酶混合物,5 μl的模板RNA。在日本荣研公司的Realtime Turbidimeter LA-320C仪器上进行等温扩增反应并记录结果,本研究甲型副伤寒沙门菌RT-LAMP反应条件为65 ℃,60 min,对于比浊度<0.1的扩增结果判定为RT-LAMP反应阳性。以时间(min)为横轴,模板RNA拷贝数或细菌数量的对数值为纵轴,绘制标准曲线方程。 1.8 实时荧光定量反转录-聚合酶链反应 (real time fluorescent quantitative reverse transcription-polymerase chain reaction,rRT-PCR) 以模拟标本提取的病原菌RNA为模板,取5 μl加入rRT-PCR反应体系中,利用RT-LAMP中两条外引物F3、B3作为rRT-PCR的引物,使用One Step SYBR Primerscript RT-PCR Kit Ⅱ(TaKaRa)进行血模拟标本的RNA反转录和进一步的核酸扩增。使用CFX96荧光PCR仪,扩增条件为42 ℃ 30 min;94 ℃ 30 s,60 ℃ 15 s,共40个循环。对于Ct值≤30的扩增结果判定为阳性。 2 结果 2.1 甲型副伤寒沙门菌
RT-LAMP体系的优化及建立,利用生物信息学软件,通过比对GenBank中所有甲型副伤寒沙门菌已知序列,获得它们共有的基因序列后再与其他血清型沙门菌及人类基因组进行比对,进而获得甲型副伤寒沙门菌特有而与人类及其他沙门菌无共有序列的特异基因hsdM,以该基因为靶点,设计合成普通PCR引物,选择我国不同时间及地点分离的47株甲型副伤寒进行全基因扩增,结果均得到900 bp大小的目的条带(图 1),随机选择10个PCR产物进行序列测定,经Blast比对,结果序列一致性为100%,说明该基因在甲型副伤寒沙门菌中高度保守。同时利用表 1中其他血清型沙门菌及非沙门菌进行扩增,结果均为阴性,进一步说明hsdM为甲型副伤寒沙门菌的特异基因。上述结果表明hsdM为甲型副伤寒沙门菌特异而保守的基因,适于作为发展特异性核酸诊断的靶标。
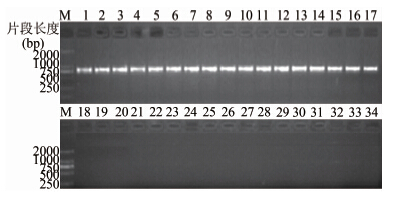
|
| 图 1 部分甲型副伤寒沙门菌PCR产物电泳 Figuer 1 Electrophoretogram of PCR products of S. paratyphi A on agarose gel 注:M:DNA分子质量Marker; 1~17: 17株甲型副伤寒沙门菌PCR扩增结果; 18~33:16株非甲型副伤寒沙门菌PCR扩增结果; 34:阴性对照。 |
利用LAMP Primer Explorer 4软件设计针对hsdM基因3个区域的RT-LAMP引物,以提取纯化的ATCC9150总RNA为模板,利用针对每个区域的6条引物、Loopamp RNA Amplification Kit试剂及其推荐的常用引物浓度(方法1.7),在60~65 ℃进行RT-LAMP扩增,结果SPA-48-5系列引物扩增时间最短,在30 min内出现扩增阳性,而其他引物出现扩增阳性的时间均在50 min以上,且温度对扩增结果无明显影响,说明SPA-48-5系列引物较适于RT-LAMP反应,并选用65 ℃为反应条件。 2.2 实验室条件下甲型副伤寒沙门菌
RT-LAMP特异性及灵敏性检测。本研究共进行了48种306株细菌的RT-LAMP检测(表 1),其中130株甲型副伤寒沙门菌均阳性,琼脂糖电泳见典型的阶梯状条带(图 2)。34种沙门菌属其他血清型均扩增阴性。对其他常见腹泻病原(霍乱弧菌、副溶血弧菌、志贺菌、致泻性大肠埃希菌)亦扩增阴性。而且,临床其他常见发热病原菌包括金黄色葡萄球菌、肺炎链球菌、伯氏疏螺旋体、钩端螺旋体、嗜肺军团菌、脑膜炎奈瑟菌、立克次体、布鲁氏菌均扩增阴性,说明本研究筛选到的RT-LAMP引物具有较高的菌种和血清型特异性。
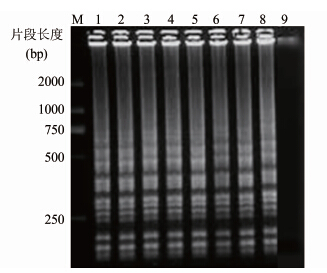
|
| 图 2 部分甲型副伤寒沙门菌RT-LAMP产物电泳 Figuer 2 Electrophoretogram of RT-LAMP products of some S. paratyphi A on agarose gel 注:M:DNA分子质量Marker; 1~8: 8株甲型副伤寒沙门菌RT-LAMP扩增结果; 9:阴性对照。 |
提取甲型副伤寒沙门菌标准株ATCC9150培养物的总RNA作为阳性模板,对模板进行10倍系列稀释,检测RT-LAMP反应的敏感性,结果如图 3A所示,RT-LAMP检测hsdM靶基因的敏感性为 50 pg/反应,约为19 000个拷贝/反应,与文献报道其他病原菌检测敏感性一致[6]。以时间(min)为横轴,模板RNA拷贝数的对数为纵轴,获得标准曲线方程为y=-0.13x+6.949,R2=0.9816,说明引物扩增效率较高。本实验进行了3次独立重复实验,结果一致。
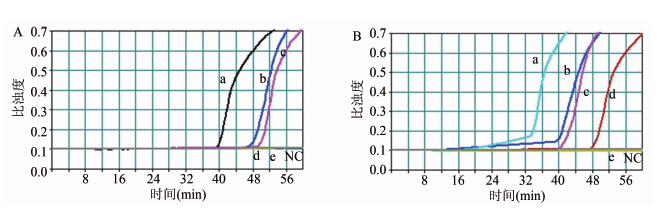
|
| 图 3 RT-LAMP敏感性检测 Figuer 3 Sensitivity of RT-LAMP for detecting S. paratyphi 注:A: 纯菌RNA敏感性反应曲线 a: 50 ng/test; b: 5 ng/test; c: 500 pg/test; d: 50 pg/test; e: 5 pg/test。 NC: 阴性对照。B: 模拟血标本敏感性反应曲线 a: 8×103 cfu/ml; b: 8×102 cfu/ml; c: 8×101 cfu/ml; d:4×101 cfu/ml; e: 8×100 cfu/ml. NC: 阴性对照。 |
把新鲜血液与不同浓度的甲型副伤寒沙门菌混匀,室温放置30 min后,进行病原微生物RNA的提取,最终提取的RNA溶解到50 μl不含RNase的无菌纯水中,取其中5 μl作模板,进行RT-LAMP 反应。同时,取系列稀释菌液进行菌落计数,测定模拟标本中准确细菌含量。然后进行RT-LAMP敏感性检测(图 3B)。从图中可以看出RT-LAMP对血液样本的最低检测限为80 cfu/ml。 2.3.3 粪便模拟标本RT-LAMP反应敏感性
自粪便模拟标本中粗取的核酸作为模板进行RT-LAMP检测,结果显示RT-LAMP对增菌前样本的最低检测限度为500 cfu/g,对增菌后样品的最低检测限为0.8 cfu/g(表 3)。本实验进行了3次独立重复实验,结果一致。
| 扩增结果 | 模拟菌含量 | |||||||||||
| 增菌前(cfu/g) | 增菌后(cfu/g) | |||||||||||
| 1×104 | 1×103 | 5×102 | 102 | 50 | 10 | 102 | 50 | 10 | 5 | 1.7 | 0.8 | |
| RT-LAMP(1) | 33.80 | 40.60 | 46.40 | NA(3) | NA | NA | 12.40 | 13.70 | 15.10 | 16.80 | 20.60 | 31.60 |
| rRT-PCR(2) | 27.12 | 30.26 | NA | NA | NA | NA | 20.02 | 22.13 | 26.37 | 29.04 | 33.82 | 37.41 |
| 注:(1)RT-LAMP: 比浊度达到0.1时所需反应时间;(2) rRT-PCR:Ct值;(3)NA:样品扩增阴性。 |
门菌标准株ATCC9150培养物的总RNA、血模拟标本中提取的RNA作为阳性模板,进行rRT-PCR检测,为保证扩增效率的一致性及可比性,rRT-PCR采用RT-LAMP反应的外引物F3、B3进行扩增反应,结果(表 4)显示:rRT-PCR对纯菌样本的最低检测限为50 pg/反应,约为19 000个拷贝/反应,标准曲线方程为y=-2.154x+41.334,R2=0.9929,说明引物扩增效率较高。rRT-PCR对血液样本的最低检测限度相当于80 cfu/ml,与RT-LAMP扩增效率相当。但在对纯菌及血模拟检测中,rRT-PCR最低检测浓度的Ct值与阈值(Ct=30)非常接近,对比RT-LAMP中阳性阈值出现较早均于48 min左右比浊度超过0.1(图 3)的现象,说明RT-LAMP扩增结果优于rRT-PCR。对粪便模拟标本的检测中(表 3),对增菌前样品即原始样品检测下限为1000 cfu/g以上;增菌后样品检测下限为5 cfu/g,显著低于RT-LAMP检测低限。所以不管对纯菌样本,还是血及粪便模拟标本的检测,rRT-PCR灵敏度比RT-LAMP低2~10倍。另外,rRT-PCR反应的特异性与RT-LAMP一致,即除甲型副伤寒沙门菌扩增阳性外,其余菌株均扩增阴性。
| 纯菌核酸浓度 (pg/test) | rRT-PCR Ct值 | 血模拟标本中 细菌数量 (cfu/ml) | rRT-PCR Ct值 |
| 500 | 26.19 | 1600 | 23.65 |
| 50 | 29.79 | 160 | 26.97 |
| 5 | 33.93 | 80 | 30.31 |
| 0.5 | 37.15 | 40 | 33.62 |
| NC | NA | 20 | 37.11 |
| NC | NA |
| 注:NC:阴性对照; NA:样品扩增阴性。 |
为保证检测结果的可信性,避免其他难培养或未知病原微生物的干扰影响,本研究选取经血培养确诊即血培养阳性的甲型副伤寒及伤寒患者血液样品进行检测评价。 分别对提取的20份甲型副伤寒患者血液核酸及10份伤寒患者血液核酸进行RT-LAMP检测,结果20份甲型副伤寒患者血液目的核酸hsdM检测阳性,10份伤寒患者血液hsdM核酸检测阴性,与血液细菌分离培养结果一致。 3 讨论
甲型副伤寒沙门菌感染人体后,在人体肠道内繁殖并通过肠道M细胞,侵入血液造成菌血症,引起患者发热、无力等症状。发病期间,患者可通过粪便、尿液等排出病原菌。因此检测发热患者血中、粪便中病原菌的存在能够早期快速地诊断该病、采取有限的治疗控制措施。RT-LAMP除具有LAMP的普遍优势,如不需PCR仪等特殊昂贵的设备,只利用水浴锅等类似恒温仪器即可外,因为反应体系中所用的模板为 提取的RNA,扩增结果阳性表明所检测的甲型副伤寒沙门菌处于活的增殖状态,应用于现场或临床时,更能体现样本中的活菌状态及疾病的急性感染期。克服目前血液分离培养甲型副伤寒沙门菌时间长、手工分离培养率偏低的弊端。本研究小组前期建立了基于 STY3671 基因的伤寒沙门菌RT-LAMP检测方法[7],考虑伤寒与甲型副伤寒在临床症状上难以区分,且两者对临床常用氟喹诺酮类药物的敏感性不同,而如果通过特异基因的检测能够实现二者快速鉴别的话,将对疫苗应用及临床用药起到早期指导作用。通过比对GenBank中所有甲型副伤寒沙门菌已知序列,获得它们共有的基因序列后再与其他血清型沙门菌及人类基因组进行比对,进而获得甲型副伤寒沙门菌特有而与人类及其他沙门菌无共有序列的特异基因hsdM,以该基因为靶点,设计合成多对RT-LAMP引物,通过纯菌RNA扩增反应,最后获得扩增效率最高及扩增时间最短的本文中所列引物,进行特异性、敏感性及实际标本检测评价。同时考虑患者血液中细菌含量相对较少,本研究应用QIAamp UCP PurePathogen Blood fieldtest Kit在很大程度上减少了病原微生物的损耗,为实验的顺利开展提供了条件。
笔者根据hsdM基因序列设计3对引物,可特异地识别靶序列上的8个区域,而且只有当引物与8个区域严格配对时靶序列才会得到大量扩增,所以理论上该反应不易受到非靶序列DNA的影响,可保证其特异性。在实际菌株检测中,经过大量试验菌株扩增检测,这3对引物能将甲型副伤寒沙门菌与沙门菌属中其他常见的沙门菌血清型区分开,并且在肠道其他常见致泻性细菌,包括霍乱弧菌、志贺菌、副溶血弧菌、致泻性大肠埃希菌中均无扩增。且在模拟粪便检测中表现出较高的敏感性,为该RT-LAMP体系应用于实际粪便标本检测提供了基础。作为以发热为主要表现的甲型副伤寒疾病,特别需要与其他以发热为主的主要病原进行鉴别诊断,本研究建立的RT-LAMP对临床常见的以发热为主的8种主要病原均扩增阴性,且在实际甲型副伤寒患者血液标本检测中特异性、敏感性均达100%。因此利用该基因建立的甲型副伤寒沙门菌RT-LAMP反应在以发热症状为主的症候群监测中,具有潜在的应用价值。虽然利用RT-LAMP反应对临床血液标本检测的特异性及灵敏性均较高,但由于选用标本均为病原菌培养阳性标本,且数量相对较少,缺少实际发热患者在病原未知情况下,血液检测灵敏性及特异性的评估,因此需进一步扩大样本数量及种类,如同时检测可疑甲型副伤 寒患者早期血液及粪便样品,同时与病原分离培养及其他金标准检测方法进行比较,以便更好地完善或推广该方法的应用。另外,与PCR相比,RT-LAMP敏感性明显增高,高于rRT-PCR检测底限为2.5×102 cfu[8] 及多重PCR检测底限为1×105 cfu[3]的报道,且在粪便检测中表现出明显优于PCR的优势。虽然本研究建立的甲型副伤寒沙门菌RT-LAMP的检测下限低于我们建立的伤寒沙门菌(血液标本检测限为7 cfu/ml)RT-LAMP方法,但均优于使用相应引物的rRT-PCR。不同病原菌RT-LAMP检测下限的不同,可能与基因本身及病原菌基因组构成的差异有关。
综上所述,笔者在实验室中建立了简便快捷、特异性好、敏感性高的适用于血液及粪便的甲型副伤寒沙门菌RT-LAMP检测方法,并将通过大量临床样品的实际检测进一步完善或推广该技术的应用。
| [1] | Alia A, Haque A, Haque A, et al. Multiplex PCR for differential diagnosis of emerging typhoidal pathogens directly from blood samples[J]. Epidemiol Infect,2009,137(1):102-107. |
| [2] | Levy H, Diallo S, Tennant SM, et al. PCR method to identify Salmonella enterica serovars typhi, paratyphi A, and paratyphi B among Salmonella isolates from the blood of patients with clinical enteric fever[J]. J Clin Microbiol,2008,46(5):1861-1866. |
| [3] | Grace YN, Li MN, Raymond L, et al. Development of a novel multiplex PCR for the detection and differentiation of Salmonella enterica serovars Typhi and Paratyphi A[J]. Res Microbiol,2010,161(4):243-248. |
| [4] | Kenji H, Itoh KI, Nakajima H, et al. Selective amplification of tyv (rfbE), prt (rfbS), viaB, and fliC genes by multiplex PCR for identification of Salmonella enterica Serovars Typhi and Paratyphi A[J]. J Clin Microbiol,2002,40(2):633-636. |
| [5] | Zhang L, Fan FX, Yan MY, et al.Identification of Salmonella typhi and Salmonella paratyphi A by PCR amplication of gene STY3671[J]. Disease Surveillance,2012,27(3):181-199. (in Chinese) 张力,樊粉霞,闫梅英,等. 聚合酶链反应扩增STY3671基因鉴别伤寒与甲型副伤寒沙门菌[J]. 疾病监测,2012,27(3):181-199. |
| [6] | Meng S, Xu JG, Xiong YW, et al. Rapid and sensitive detection of plesiomonas shigelloides by loop-mediated isothermal amplification of the hugA gene[J]. PLoS One,2012,7(10):e41978. |
| [7] | Fan FX, Kan B,Yan MY. Detection of Salmonella Typhi by RT-LAMP[J].Chin J Biochem Mol Biol,2013,29(7):682-689.(in Chinese) 樊粉霞, 阚飙,闫梅英.利用RT-LAMP技术鉴别伤寒沙门菌[J].中国生物化学与分子生物学报,2013,29(7):682-689. |
| [8] | Tran N, Abhilasha K, Sabina D, et al. The sensitivity of real-time PCR amplification targeting invasive Salmonella serovars in biological specimens[J]. BMC Infect Dis,2010, 10(5):125-133. |
 2014, Vol. 29
2014, Vol. 29


