扩展功能
文章信息
- 杨小蓉, 黄伟峰, 谢晓丽, 黄玉兰, 吕虹, 李莉, 雷高鹏, 何树森
- YANG Xiao-rong, HUANG Wei-feng, XIE Xiao-li, HUANG Yu-lan, LYU Hong, LI Li, LEI Gao-peng, HE Shu-seng
- 一例由阪崎肠杆菌感染引起腹泻患儿的溯源分析
- Source trace of Enterobacter sakazakii infection in an infant with repeated diarrhea
- 疾病监测, 2014, 29(10): 794-796
- Disease Surveillance, 2014, 29(10): 794-796
- 10.3784/j.issn.1003-9961.2014.10.010
-
文章历史
- 收稿日期:2014-07-02
2. 成都市妇女儿童中心, 四川 成都 610000
2. Chengdu Women and Children Center, Chengdu 610000, Sichuan, China
阪崎肠杆菌(Enterobacter sakazakii)是人和动物肠道内寄生的一种革兰阴性无芽胞杆菌。作为肠杆菌科的一种,一直被称为黄色阴沟肠杆菌,直到1980年才更名为阪崎肠杆菌[1]。该菌在自然界的污染来源尚不清楚。但在一定条件下可引起人和动物致病,因而被称为条件致病菌[1]。阪崎肠杆菌可引起任何年龄段的人群发病,但从目前所报道的资料,婴幼儿(主要是1 岁以下),特别是出生28日龄以内、早产儿、低体重儿或免疫缺陷的婴幼儿更容易被感染,能引起严重的新生儿脑膜炎、小肠结肠炎和菌血症,并且可引起神经系统后遗症和死亡。由阪崎肠杆菌感染引起的脑膜炎和坏死性小肠结肠炎的死亡率高达40%~80% 和10%~55%[2, 3]。本实验室在开展腹泻病原菌监测工作中,从1例反复腹泻的4月龄幼儿样本中重复检出阪崎肠杆菌,现报告如下。
患儿首次出现腹泻症状为2014年4月14日,年龄为4个月零7 天,至2014年5月18日至采样医院就诊期间多次外院就医,反复稀便,为黄色水样便,血常规、大便常规均无异常,轻度脱水,至5月28日陆续以秋泻灵合剂、杜拉宝、氨曲南对症治疗,后经敏感性治疗后康复。 1实验室检测 1.1样本采集
分别在患儿出现腹泻症状后的第34、44和48天及敏感性治疗的第3天采集其粪便样本,采集患儿手部、奶嘴、奶瓶、药勺和患儿母亲手部拭子各1份,患儿从初次腹泻至采样时所食用的奶粉样本4份,米粉样本1份,放置奶瓶、奶粉罐、药勺桌面涂抹拭子1份。 1.2病原菌分离
粪便样本直接划线接种mCCDA平板、弧菌显色平板和和麦康凯平板分离弯曲菌,副溶血性弧菌、创伤弧菌、志贺菌、致泻性大肠埃希菌,将剩余样本分别接种SBG增菌液、EC肉汤、碱性蛋白胨水和mLST-Vm进行增菌培养后分别接种沙门菌显色培养基,大肠埃希菌O157显色培养基、4号琼脂和阪崎肠杆菌显色培养基分离沙门菌、大肠埃希菌O157 ∶ H7、霍乱弧菌和阪崎肠杆菌。分别从选择平板上挑取可疑菌落进行菌株鉴定。粪便直接镜检检测隐孢子虫、阿米巴和蓝氏贾第鞭毛虫,患儿手部拭子、安抚奶嘴拭子、奶瓶拭子、患儿母亲手部拭子、奶粉样本、米粉样本和放置奶瓶、奶粉罐、药勺桌面涂抹拭子按照GB 4780.40-2010进行阪崎肠杆菌分离培养。样本经蛋白胨水37 ℃增菌18 h,转种至mLST-Vm 44.5 ℃增菌24 h,划线阪崎肠杆菌显色平板分离阪崎肠杆菌,可疑菌落用VITEK 2 Compact 系统进行生化鉴定。 1.3药敏试验
对分离的病原菌选用四环素、环丙沙星、萘啶酸、头孢西丁、头孢噻肟、庆大霉素、氯霉素、甲氧苄啶/磺胺甲恶唑8种抗生素,采用最低抑菌浓度(MIC)值的测定方法,药物敏感性实验分析结果按照美国临床实验室标准化委员会(CLSI)2010年版标准[4]进行判定,药敏质控菌株大肠埃希菌ATCC25922为本实验室保存。 1.4脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)实验
按照美国疾病预防控制中心公布的阪崎肠杆菌脉冲场电泳标准分型方法[5],对从桌面涂抹样和病例样本中分离的阪崎肠杆菌进行PFGE分子分型试验。过夜培养菌株制成麦氏浓度4.2的菌悬液,200 μl菌悬液中加入10 μl蛋白酶K(20 mg/ml)和200 μl 1%Seakem Gold: 1%SDS 琼脂糖制备Plug。然后用CLB/蛋白酶K裂解液裂解Plug胶块中包被的细菌,然后用灭菌纯水洗胶块2次,用TE洗胶块4次。切取2 mm宽洗涤后的胶块用限制性内切酶Xba Ⅰ(酶量为40 U/胶块)酶切2 h。把酶切后胶块放置到梳子齿上,倒入1% SeaKem Gold制胶。使用mapper型脉冲场电泳仪进行电泳,电泳参数为:Xba Ⅰ酶切,low MW: 30 kb,high MW: 700 kb,电泳时间:19 h。电泳结束后,用0.1 μg/ml GelRed染色30 min,纯水洗脱30 min后,用BioRed凝胶成像系统拍摄电泳图片。 1.5聚类分析方法
使用BioNumerics(Version 6.0)数据库软件进行聚类分析,方法采用非加权组平均法,聚类相似性系数(距离)采用的是基于条带比较的Dice。Dice=2×N(N+M),式中N表示能匹配的条带的个数,M表示所有条带的个数(2个菌带型上的条带个数总和,再减去匹配的条带个数)。根据聚类结果,按不同菌株的相似性系数进行分型,<90%的定为不同的型,>90%而<100%的为不同的亚型,相似系数等于100%的不同菌株为同一亚型。 2结果 2.1病原菌分离情况
对4次采集的粪便样本进行常见腹泻致病菌和寄生虫检测,从第1、第2和第3次采集的粪便样本中以及从患儿家中放置患儿奶瓶、奶粉罐和药勺的桌面涂抹样中检出可疑阪崎肠杆菌,4株可疑菌株经VITEK2全自动微生物鉴定系统鉴定均为阪崎肠杆菌,可信度均为99%,生化反应均相同,经敏感性治疗后采集的第4次粪便样本中未检出任何常见腹泻病原菌。幼儿及其母亲手部拭子、药勺、奶嘴、奶瓶、奶粉、米粉等样本中均未检出阪崎肠杆菌。 2.2药敏结果
从患儿3次样本和桌面分离的共4株阪崎肠杆菌对四环素、环丙沙星、萘啶酸、头孢西丁、头孢噻肟、庆大霉素、氯霉素、甲氧苄啶/磺胺甲恶唑8种抗生素敏感试验结果均为敏感。 2.3PFGE分型结果
从患儿3次粪便样本和桌面涂抹样中分离出的4株阪崎肠杆菌基因组DNA经XbaⅠ酶切后,将PFGE图谱进行聚类分析,结果显示来自患者和桌面涂抹样中的共4株阪崎肠杆菌具有相同的PFGE带型(图 1)。
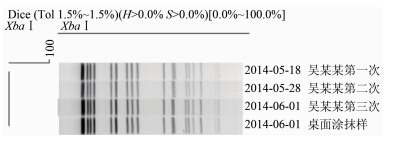
|
| 图 1 4株阪崎肠杆菌分离株PFGE聚类分析图谱 Figuer 1 PFGE patterns of 4 strains of E. Sakazaki |
阪崎肠杆菌作为一种肠道条件致病菌,在食品 和环境中广泛存在,虽然现在还不能确定阪崎肠杆菌的传播模式,但在一些新生儿阪崎肠杆菌感染事件的调查中发 现婴儿配方奶粉是主要的感染渠道[6, 7]。 此外,冲调环境和器皿的污染也是重要的传 染源[8]。国内尚未见由配方奶粉或冲调器皿及相关环境引起的阪崎肠杆菌感染病例报道。 本实验室所监测的患病婴儿年龄较低,食品单一,患病时间较长,反复腹泻,说明被反复感染,经对患儿从出现腹泻至采样时所有食用的奶粉、米粉样本、使用的安抚奶嘴、奶瓶、药勺等相关器皿及放置这些物品的桌面涂抹样进行病原菌分离培养,从桌面涂抹样中检出阪崎肠杆菌,与幼儿3次粪便样本中检出的阪崎肠杆菌PFGE型别一致。患儿家长卫生意识不强,药勺、安抚奶嘴直接置于未经消毒处理的桌面,并且使用前仅用自来水进行简单冲洗或者简单擦拭。在家长将桌面和桌面上婴儿所有器皿消毒处理,患儿经敏感性治疗康复回家后,未再次出现腹泻,由此结合实验室病原分离及分子分型实验分析,可以推测导致此婴儿反复腹泻患病的污染源为桌面污染的阪崎肠杆菌,家长在给幼儿喂食奶粉和药物时污染所致。
由于阪崎肠杆菌可通过配方奶粉、冲调器皿及相关环境引起婴幼儿严重疾患,因此及时的药物敏感实验对指导临床治疗至关重要,早期报道阪崎肠杆菌对各种抗生素敏感,但自1987年以来,有关该菌耐药性的报道不断增加[9],应引起临床医师的高度重视和警惕。国内近几年也陆续有阪崎肠杆菌耐药的报道,裴晓燕等[10]对国内从婴幼儿配方奶粉中分离得到的16株阪崎肠杆菌用Kirby-Bauer纸片扩散法进行了药敏分析,共选择了6大类28种抗生素,其结果显示所有菌株对青霉素G、苯唑西林、万古霉素3种抗生素均有耐药性,崔晶花等[11]对国内从婴幼儿配方奶粉或米粉中分离到的60株阪崎肠杆菌用Kirby-Bauer纸片扩散法进行了药敏分析,共选择了7大类14种抗生素,其结果显示除了有4株菌对所有的7大类抗生素新一代青霉素类、β-内酰胺类、头孢菌素类、碳青霉烯类、氨基糖苷类、氟化喹诺酮类、甲氧苄氨嘧啶-磺胺甲 异恶唑都具有耐 药性,这种情况非常少见。龚燕和顾学章[12]对64例阪崎肠杆菌肺炎的临床药敏分析也显示临床分离株对临床常用的抗生素均有不同程度的耐药性,耐药率达4.8%~95.8%,因此,为了快速及时的治疗由阪崎肠杆菌感染引起疾病,阻止疾病的进一步发展,应尽早进行病原菌分离培养和抗生素药敏敏感实验,以指导治疗。
| [1] | Farmer JJ, Asbury MA, Brenner DJ, et al. Enterobacter sakazakii: a new species of Enterobacteriaceae isolated from clinical specimens[J].Int J System Bacteriol,1980,30:569-584. |
| [2] | Muytjens HL, Zanen HC, Sonderkamp HJ, et al. Analysis of eight cases of neonatalmen ingitis and sepsis due to Enterobacter sakazakii[J].J Clin Microbiol,1983,18:115-120. |
| [3] | Forsythe SJ. Enterobacter sakazakii and other bacteria in powdered infant milk formula [J]. J M ater Child Nutr,2005,1:44-50. |
| [4] | Clinical and Laboratory Standards Institute(CLSI). Performance standards for Antimicrobial susceptibility testing[S]. M100-S22,2012. |
| [5] | PulseNet protocols[EB/OL].[2010-07-21].http://www.ode.gov/pulsenet/protocols.htm. |
| [6] | van Acker J,de Smet F,Muyldermans G,et al. Outbreak of necrotizing enterocolitis associated with Enterobacter sakazakii in powdered milk formula[J].J Clin Microbiol,2001,39(1):293-297. |
| [7] | Asakura H, Morita Ishihara T, Yamamoto S, et al. Genetic characterization of thermal tolerance in Enterobacter[J].Sakazakiil Microbio J Immunol,2007,51(7):671-677. |
| [8] | Joint FAO/WHO Workshop.Enterobacter sakazakii and salmonella in powdered infant formula [M].Rome:FAO,2006. |
| [9] | Sheri K, Dennison,Joseph Morris.Multiresistant Enterobacter sakazakii Wound Infection in an Adult[J].Infect Med,2002,19:533-535. |
| [10] | Pei XY, Guo YC, Xu J, et al. Drug susceptibility of Enterobacter sakazakii isolated from infant powder formula [J]. Journal of Hygiene Research,2007,36(1):63-65.(in Chinese) 裴晓燕,郭云昌,徐进,等.婴幼儿配方奶粉中阪绮肠杆菌分离株的药敏分析[J].卫生研究,2007,36(1):63-65. |
| [11] | Cui JH, Yang XR, Du XL, et al. Drug susceptibility of 65 Cronobacter spp. strains [J]. Disease Surveillance,2012,27(5):409-411.(in Chinese) 崔晶花,杨小蓉,杜小莉,等.60株克罗诺杆菌的药敏分析[J].疾病监测,2012,27(5):409-411. |
| [12] | Gong Y, Gu XZ. Clinical drug susceptibility of 64 pneumonia caused by Enterobacter sakazakii [J]. Shanghai Medical Journal,2005,28(12):1047-1048.(in Chinese) 龚燕,顾学章.阪崎肠杆菌肺炎64例临床及药敏分析[J].上海医学,2005, 28(12):1047-1048. |
 2014, Vol. 29
2014, Vol. 29


