扩展功能
文章信息
- 刘丽云, 夏胜利, 孙晖
- LIU Li-yun, XIA Sheng-li, SUN Hui
- 潜在致病性的弗氏枸橼酸杆菌的筛查
- Screening of potential pathogenic Citrobacter freundii
- 疾病监测, 2015, 30(2): 92-96
- Disease Surveillance, 2015, 30(2): 92-96
- 10.3784/j.issn.1003-9961.2015.02.004
-
文章历史
- 收稿日期:2014-09-24
2. 河南省疾病预防控制中心, 河南 郑州 450016
2. Henan Provincial Center for Disease Control and Prevention, Zhengzhou 450016, Henan, China
黏附到胃肠黏膜是几乎所有的肠道病原菌致病的关键步骤之一。聚集性黏附是重要的致病模式之一。肠聚集性大肠埃希菌(EAEC)是聚集性黏附的典型代表[1]。弗氏枸橼酸杆菌定植在人类和动物的肠道中,是条件致病菌。已有文献报道,弗氏枸橼酸杆菌的一些分离株由于获得毒力基因而引起人类的腹泻和其他感染症状[2]。Pereira等[3]分离到1株与腹泻相关的聚集性黏附弗氏枸橼酸杆菌(EACF),研究发现这株EACF可以与traA阳性的EAEC菌株相互作用,增加生物膜的形成。包括志贺样毒素和热稳定毒素在内的毒素是腹泻相关的弗氏枸橼酸杆菌通常携带的毒力因子[3]。 Kauffmann等[6]通过克隆测序的方式在1株引起儿童腹泻的弗氏枸橼酸杆菌中检测到霍乱毒素B亚基同源序列。
本研究对从河南省睢县分离到的36株弗氏枸橼酸杆菌进行黏附实验、细胞毒实验和毒力基因检测,目的筛查出具有细胞毒性的弗氏枸橼酸杆菌,来评估其致病性。
1 材料与方法 1.1 材料 1.1.1 菌株和细胞来源菌株:河南省睢县分离的弗氏枸橼酸杆菌36株,分别来源于腹泻患者、羊、蝇、鹅、猪和鸡粪便,以及腹泻患者家的案板。参考菌株包括:肠聚集性黏附大肠埃希菌(Enteroaggregative E. coli,EAEC)042和17-2,肠致病性大肠埃希菌(Enteropathogenic E. coli,EPEC)E2348/69和大肠埃希菌HB101。其中肠致病性大肠埃希菌EAEC17-2作为细胞毒性的阳性对照株,HB101作为无细胞毒性的阴性对照株。细胞:HEp-2细胞(人喉癌细胞系)和5637细胞(膀胱癌细胞系)购自ATCC。
1.1.2 主要试剂和仪器实验所用Taq DNA聚合酶、T4连接酶、高保真酶、dNTPs、DNA Marker为TaKaRa公司产品;Gimesa染液,Cyto-Tox 96 Cytoxicity Kit (美国 Promega);1640培养基和小牛血清购自GIBCO.Thermo Forma Steri-Cycle CO2 培养箱;OLYMPUS BX51正置显微镜;Bio-Rad公司电泳仪和凝胶成像仪。
1.2 方法 1.2.1 培养基及培养条件弗氏枸橼酸杆菌的常规培养条件为:LB液体培养基(1%胰蛋白胨、0.5%酵母提取物、1%NaCl,调节pH至7.4)及LBA固体平板(LB液体培养基中加入1.5%琼脂),37 ℃培养。HEp-2细胞和5637细胞的培养条件为:含10%小牛血清的1640培养基,37 ℃,5% CO2 的温箱孵育。
1.2.2 弗氏枸橼酸杆菌黏附和细胞毒实验HEp-2 细胞或5637细胞接种于24孔细胞板,培养液为1640(含10%小牛血清),培养过夜。细菌感染细胞的MOI为100 ∶ 1,在37 ℃,5%CO2 的温箱中共同孵育3 h后,经过PBS清洗、冰甲醇固定和1% Giemsa (Sigma-Aldrich)染液作用 30 min,纯水清洗、封片和显微镜观察。每个样品有3个平行,并且进行至少2次重复实验。肠聚集性黏附大肠埃希菌042作为聚集性黏附的对照菌株,肠致病性大肠埃希菌E2348/69作为局灶性黏附的对照菌株和HB101作为不黏附的对照菌株。黏附指数指在1000放大倍数的油镜下随机观察10个视野下黏附至细胞上的细菌数,计算每个细胞黏附的平均细菌数[7]。黏附指数<1,为不黏附或弱黏附,黏附指数1<100,为中等黏附;黏附指数>100,为强黏附。
乳酸脱氢酶(LDH)实验按照Cytotox96 kit (Promega)操作说明进行。具体步骤如下:HEp-2细胞接种于96孔板,培养液为1640含10%FBS,培养过夜;次日,细菌感染细胞的MOI为100 ∶ 1,在37 ℃,5% CO2 的温箱中共同孵育10 h。离心,移取每孔上清50 μl 至另一96 孔板,并在每孔加入50 μl LDH 反应液,避光反应30 min(室温15~25 ℃);每孔加入50 μl LDH 终止液,酶标仪测吸光度,测量波长为490 nm,参考波长为630 nm。低对照组为不加细菌的细胞培养液,高对照组为细胞被加入lysis完全裂解(promege 试剂盒带,在显色前40 min加入1×lysis)。LDH释放量=(A样品-A低对照)/(A高对照-A低对照)×100%。每个样品有3个平行,并且进行至少2次重复实验。其中肠致病性大肠埃希菌EAEC17-2作为细胞毒性的阳性对照株,HB101作为无细胞毒性的阴性对照株。
1.2.3 统计学分析SPSS软件包版本为13.0 (SPSS Inc.,Chicago,IL,USA)进行所有数据的统计学分析。非参数检验(Mann-Whitney U-test)用于组间的差异比较分析,P<0.05为差异有统计学意义。
2 结果 2.1 36株弗氏枸橼酸杆菌对HEp-2细胞的黏附作用通过比较36株弗氏枸橼酸杆菌对HEp-2细胞的黏附差异,如图 1所示,16株弗氏枸橼酸杆菌几乎没有黏附性,黏附指数<1;18株弗氏枸橼酸杆菌具有中等强度的黏附性,黏附指数1<100;2株弗氏枸橼酸杆菌(CF65和CF74)具有强的黏附性,黏附指数>100,且这2株弗氏枸橼酸杆菌呈现聚集性黏附类型。作为无黏附的阴性对照HB101几乎没有细菌黏附,黏附指数<1;作为强黏附的阳性对照肠致病性大肠埃希菌042黏附性很强,黏附指数>100。
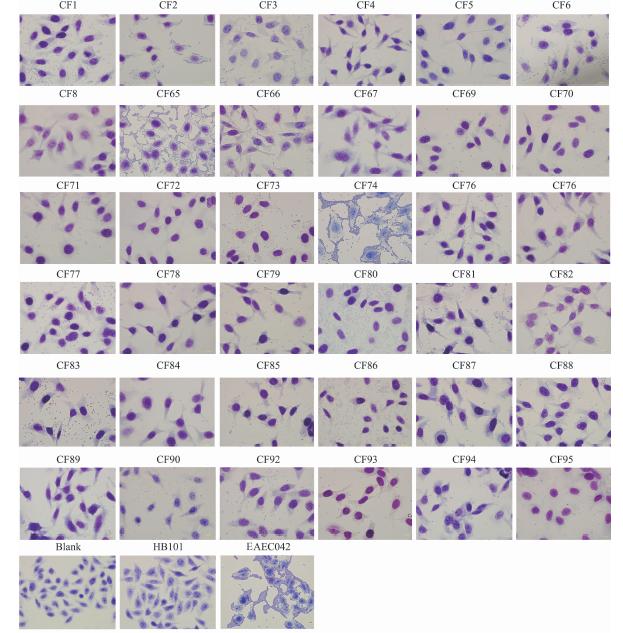
|
| 图 1 弗氏枸橼酸杆菌黏附HEp-2细胞的结果 Fig. 1 Adhesion of C. freundii on HEp-2 cell 注:光学显微镜下观察36株弗氏枸橼酸杆菌黏附HEp-2细胞的情况。不加菌的细胞作为黏附的空白对照,HB101作为无黏附的阴性对照,肠致病性大肠埃希菌042作为强黏附的阳性对照。Bar: 10 mm。(革兰染色,×1000) |
通过比较36株弗氏枸橼酸杆菌对HEp-2细胞的细胞毒作用,发现CF74在与HEp-2细胞作用10 h后,LDH的释放量大约为24%,其余的35株弗氏枸橼酸杆菌LDH的释放量很低,与阴性对照HB101 LDH释放量(5.02%)很相近,说明除了CF74,其余的弗氏枸橼酸杆菌不具有细胞毒性(图 2)。
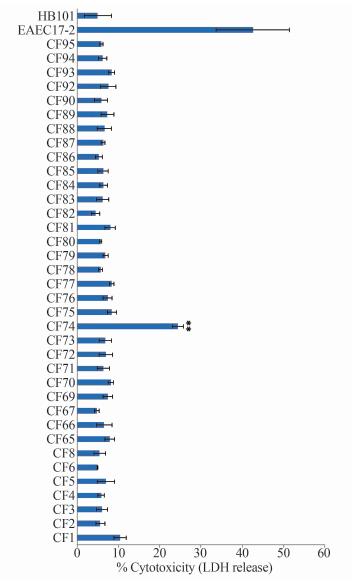
|
| 图 2 弗氏枸橼酸杆菌对HEp-2细胞的细胞毒作用结果统计分析 Fig. 2 Cytotoxicity of C. freundii to HEp-2 cell 注: HEp-2细胞暴露于36株弗氏枸橼酸杆菌10 h后,采用非参数检验(Mann-Whitney U-test)比较分析CF74与其他35株弗氏枸橼酸杆菌引起LDH释放量,**双尾P检验为0.00。EAEC17-2作为阳性对照菌,HB101作为阴性对照菌。 |
采用非参数检验(Mann-Whitney U-test)比较分析CF74与其他35株弗氏枸橼酸杆菌引起LDH释放量,其差异具有统计学意义(P<0.01)。
2.3 弗氏枸橼酸杆菌CF74具有和EAEC相类似的黏性类型和细胞毒性为了解CF74的黏附类型, 同时检测了EAEC 042和 EPEC 2348/69黏附5637细胞的情况,HB101作为阴性对照。结果显示,CF74具有和EAEC042一样的聚集性黏附类型,并且都具有强的黏附性;2348/69具有典型的局灶性黏附类型,CF72具有弱的黏附性(图 3)。
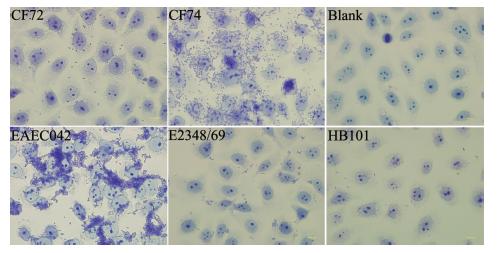
|
| 图 3 弗氏枸橼酸杆菌黏附5637细胞的结果 Fig. 3 Adhesion of C. freundii on 5637 cell 注:光学显微镜下观察弗氏枸橼酸杆菌CF72、CF74、EAEC 042、肠致病性EPEC 2348/69和阴性对照菌株HB101。Bar: 10 mm。(革兰染色,×1000)。 |
同时比较CF74与弱黏附性弗氏枸橼酸杆菌CF72、 EAEC 17-2、2348/69和HB101暴露于HEp-2细胞10 h后的LDH释放情况。如图 4所示,EAEC 17-2具有最强的细胞毒性,CF74其次,CF72与阴性对照HB101相近。CF74的LDH释放率明显高于CF72、2348/69和HB101(P<0.01)。说明CF74具有一定的细胞毒性。
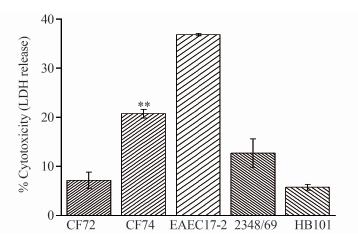
|
| 图 4 弗氏枸橼酸杆菌对HEp-2细胞的细胞毒作用结果统计分析 Fig. 4 Cytotoxicity of C. freundii to HEp-2 cell 注:HEp-2细胞暴露于CF72、CF74、EAEC17-2、2348/69和HB10110 h后,采用非参数检验(Mann-Whitney U-test)比较分析CF74与CF72、2348/69和HB101引起LDH释放量,**双尾P检验为0.00。 |
黏附性是病原菌致病的重要毒性特征,黏附性的检测已经是体外检测法的一种[1]。对从河南省睢县分离到的36株弗氏枸橼酸杆菌黏附性检测结果表明,CF65和CF74这2株弗氏枸橼酸杆菌具有强的黏附性,黏附指数>100。其余34株弗氏枸橼酸杆菌无黏附性或弱的黏附性。强黏附株CF74与 EAEC 042和 EPEC 2348/69黏附类型比较,发现CF74具有和EAEC042相同的黏附类型,即聚集性黏附类型,并且都具有强的黏附性[8]。
进一步检测36株弗氏枸橼酸杆菌的细胞毒性。发现CF74具有强的细胞毒性,其余35株菌具有弱的细胞毒性。由于CF65黏附类型和强度同CF74一样,而细胞毒性明显低于CF74。上述结果表明黏附性是细菌致病的重要因素,但强黏附性不一定具有强的细胞毒性。通过比较CF74与EAEC 17-2的细胞毒性,发现CF74细胞毒性虽然弱于17-2,而明 显强于其他测试的细菌。说明CF74具有一定的细胞毒性。
已有文献报道,弗氏枸橼酸杆菌通过获得毒力基因而变成致病菌[4,5,6]。笔者检测了包括志贺样毒素、热稳定毒素和霍乱毒素在内的毒力基因,结果发现CF74和其他35株弗氏枸橼酸杆菌均不含有这些毒力基因(结果没有显示)。通过对CF74进行全基因组测序,发现CF74获得了一个具有完整的六型分泌系统的毒力岛,在其他35株弗氏枸橼酸杆菌中没有检测到这个完整的六型分泌系统的存在。已有文献报道六型分泌系统在多种病原菌中存在,其分泌的效应蛋白是病原菌的重要毒力因子[9,10,11,12]。这个六型分泌系统毒力岛是否贡献于CF74的强的黏附性和细胞毒性,还需进一步的实验验证。
本研究通过对河南省睢县分离到的36株弗氏枸橼酸杆菌进行黏附和细胞毒实验,筛选出1株具有强的黏附性和细胞毒性的弗氏枸橼酸杆菌CF74。提示CF74可能是1株潜在的致病菌,对其致病机制还需要进一步的实验验证。
| [1] | Mange JP, Stephan R, Borel N, et al. Adhesive properties of Enterobacter sakazakii to human epithelial and brain microvascular endothelial cells [J]. BMC Microbiol,2006,6:58. |
| [2] | Guerrant RL, Dickens MD, Wenzel RP, et al. Toxigenic bacterial diarrhea: nursery outbreak involving multiple bacterial strains [J]. J Pediatr,1976,89:885-891. |
| [3] | Pereira AL, Silva TN, Gomes AC, et al. Diarrheaassociated biofilm formed by enteroaggregative Escherichia coli and aggregative Citrobacter freundii: a consortium mediated by putative F pili [J]. BMC Microbiol,2010,10:57. |
| [4] | Tschape H, Prager R, Streckel W, et al. Verotoxinogenic Citrobacter freundii associated with severe gastroenteritis and cases of haemolytic uraemic syndrome in a nursery school: green butter as the infection source [J]. Epidemiol Infect,1995,114: 441-450. |
| [5] | Guarino A, Capano G, Malamisura B, et al. Production of Escherichia coli STa-like heat-stable enterotoxin by Citrobacter freundii isolated from humans [J]. J Clin Microbiol,1987,25: 110-114. |
| [6] | Kauffmann F, Moller E. A new type of Salmonella (S. ballerup) with Viantigen [J]. J Hyg(Lond),1940,40:246-251. |
| [7] | Mange JP, Stephan R, Borel N, et al. Adhesive properties of Enterobacter sakazakii to human epithelial and brain microvascular endothelial cells [J]. BMC Microbiol,2006,6:58. |
| [8] | Yamamoto T, Koyama Y, Matsumoto M, et al. Localized, aggregative, and diffuse adherence to HeLa cells, plastic, and human small intestines by Escherichia coli isolated from patients with diarrhea [J]. J Infect Dis,1992,166:1295-1310. |
| [9] | Schwarz S, West TE, Boyer F, et al. Burkholderia type Ⅵ secretion systems have distinct roles in eukaryotic and bacterial cell interactions [J]. PLoS Pathog,2010,6:e1001068. |
| [10] | Murdoch SL, Trunk K, English G, et al. The opportunistic pathogen Serratia marcescens utilizes type Ⅵ secretion to target bacterial competitors [J]. J Bacteriol,2011,193:6057-6069. |
| [11] | Schell MA, Ulrich RL, Ribot WJ, et al. Type Ⅵ secretion is a major virulence determinant in Burkholderia mallei [J]. Mol Microbiol,2007,64:1466-1485. |
| [12] | Solomon JM, Rupper A, Cardelli JA, et al. Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions [J]. Infect Immun,2000,68:2939-2947. |
 2015, Vol. 30
2015, Vol. 30


