扩展功能
文章信息
- 任红宇, 周海健, 李马超, 朱兵清, 邵祝军, 秦天
- REN Hong-yu, ZHOU Hai-jian, LI Ma-chao, ZHU Bing-qing, SHAO Zhu-jun, QIN Tian
- 206株中国环境分离嗜肺军团菌1型菌株基因序列分型研究
- Sequence based typing of Legionella pneumophila serotype 1 isolated from natural environment in China, 2008-2012
- 疾病监测, 2015, 30(2): 97-102
- Disease Surveillance, 2015, 30(2): 97-102
- 10.3784/j.issn.1003-9961.2015.02.005
-
文章历史
- 收稿日期:2014-11-17
军团菌(Legionella)是引起军团菌病的病原体[1,2]。现已发现的军团菌有52种70多个血清型,并不断有新的菌种从环境中分离。约一半军团菌种与人类疾病有关,而90%以上的军团菌病由嗜肺军团菌引起,其中又以血清1型为主[3]。军团菌普遍存在于各种水环境中,尤其是空调冷却塔和供水系统等人工水环境中较为常见[4]。军团菌病在1976年首次暴发于美国费城的一次军人聚会[5]。此后,相继出现由社区、医院和旅行相关的军团菌病的暴发。空调冷却塔水、温泉水、宾馆医院的公共供水系统,浴室等水源经军团菌污染后成为散发或者暴发军团病的重要来源。军团菌污染的水体通过一定形式的作用以气溶胶的形式被吸入呼吸道,进而侵染肺泡巨噬细胞,并在巨噬细胞中生存繁殖,导致军团菌病的发生[6]。
水环境中军团菌的检出率比较高。在之前的研究中,应用不同的检测方法对不同类型水体里军团菌的阳性率进行了比较,冷却塔、温泉水、管道水系统中军团菌的阳性率分别为26.39%、54.44%、18.94%[4]。嗜肺军团菌血清1型是冷却塔和温泉水中最常见的血清型[4,7]。
嗜肺军团菌基因序列分型方法(Sequence based typing,SBT)是由欧洲军团菌感染工作组(The European Working Group for Legionella Infections,EWGLI)建立的一种和多位点序列分型(multilocus sequence typing,MLST)原理相同的分子分型方法,在之前的报道中显示了很好的分型能力,已经广泛地应用于环境和临床菌株以及临床标本的分型[8,9]。在本研究中,应用SBT对中国3种类型的环境水体分离的嗜肺军团菌1型菌株进行了分子分型和种群结构分析。此外,把中国菌株的SBT结果与其他国家菌株进行了比较。
1 材料与方法 1.1 实验菌株本研究选取本实验室保存的于2005 2012年从全国14个城市分离的206株嗜肺军团菌血清1型菌株,其中包括冷却塔水分离株130株、温泉水分离株49株、管道水分离株27株。实验菌株均为环境水日常监测分离菌,菌株详细分离地点、分离年份见表 1。
| 年份 | 冷却塔水 | 温泉水 | 管道水 | 总计 | |||||||||
| 采样点 | 菌株数 | 采样点 | 菌株数 | 采样点 | 菌株数 | 采样点 | 菌株数 | 采样点 | 菌株数 | ||||
| 2005 | 北京市 | 11 | 深圳市 | 20 | 重庆市 | 2 | 北京市 | 17 | 50 | ||||
| 2006 | 北京市 | 1 | 杭州市 | 8 | 马鞍山市 | 2 | 北京市 | 1 | 17 | ||||
| 南宁市 | 1 | 银川市 | 4 | ||||||||||
| 2007 | 银川市 | 6 | 6 | ||||||||||
| 2008 | 呼和浩特市 | 2 | 南昌市 | 5 | 秦皇岛市 | 1 | 上海市 | 18 | 69 | ||||
| 上海市 | 26 | 石家庄市 | 17 | ||||||||||
| 2009 | 济南市 | 5 | 马鞍山市 | 1 | 济南市 | 8 | 22 | ||||||
| 南昌市 | 1 | 无锡市 | 6 | 秦皇岛市 | 1 | ||||||||
| 2010 | 无锡市 | 10 | 10 | ||||||||||
| 2011 | 北京市 | 17 | 17 | ||||||||||
| 2012 | 深圳市 | 15 | 15 | ||||||||||
| 合计 | 130 | 49 | 27 | 206 | |||||||||
DNA提取试剂盒(德国Qiagen公司)、Taq酶(大连TaKaRa公司)。PCR扩增仪和凝胶成像仪均为美国伯乐公司生产,测序仪为ABI 3730 测序仪,由美国ABI公司生产。
1.3 SBT分型SBT分型方案依据Gaia等[8]和Ratzow等[9]建立的方法。对7个基因(flaA、pilE、asd、mip、mompS、proA、neuA)进行聚合酶链反应(PCR)扩增、测序和序列比对,引物序列参照文献。细菌基因组DNA提取按照试剂盒说明操作。PCR反应体系为:50 μl总体积中含1× PCR缓冲液、各200 μmol/L的dNTPs、各0.4 μmol/L的上下游引物、1个单位的Taq聚合酶、20 ng左右的DNA模板。PCR反应条件为94 ℃预变性5 min;94 ℃变性40 s、55 ℃退火30 s、72 ℃延伸45 s,30个循环;72 ℃终末延伸5 min。PCR产物纯化后用ABI 3730 测序仪进行序列测定。把双向测序结果上传至SBT数据库(http://www.ewgli.org)进行在线数据分析,得到等位基因号和基因型别。
1.4 国外嗜肺军团菌1型菌株SBT分型数据的获得本研究使用的国外嗜肺军团菌1型菌株SBT分型数据总结993株,包括来自亚洲:日本156株、韩国104株、 新加坡10株、 以色列4株、科威特2株;欧洲:英国204株、德国175株、西班牙133株、意大利33株、瑞士33株、俄罗斯26株、捷克共和国8株、挪威7株、波兰4株、希腊1株;美洲:美国50株、加拿大20株;非洲:南非20株、莱索托王国1株、纳米比亚1株。其中韩国、美国、西班牙3个国家的数据来源于已发表文献[10,11,12],其余国家的数据来源于EWGLI SBT数据库(http://www.ewgli.org)。
1.5 数据分析BioNumerics软件(5.10版本)用来构建最小生成树。在最小生成树中,每一个圈代表一个ST型别,圈的大小代表该ST型包含的菌株数,两个圈之间直线的长度代表两个ST型别的差异大小。
用Simpson差异指数(IOD)来评价分型方法的分辨力,其计算公式为IOD=1-Σ[nj(nj-1)]/ [N(N-1)],nj表示属于第j个型别的菌株数量,N是用于分析的菌株的总数[13]。用Nei指数来评价各SBT位点的多态性,其计算公式为Nei's index=1-Σ (allele frequency)2[14]。
2 结果 2.1 不同自然环境来源分离株的多态性比较206株嗜肺军团菌1型菌株通过SBT分型分成54个ST型(IOD=0.7205),其中16个型别包含2株或更多菌株,38个型别只包含1株菌(图 1)。包含菌株数最多的是ST1,包含分离自13个城市的108株菌,占总菌株数的52.4%。59.2%(77/130)的冷却塔水、12.2%(6/49)的温泉水、92.6%(25/27)的管道水分离株属于ST1型。其次是ST154,包含10株菌,其中6株分离自温泉水、4株分离自冷却塔水。
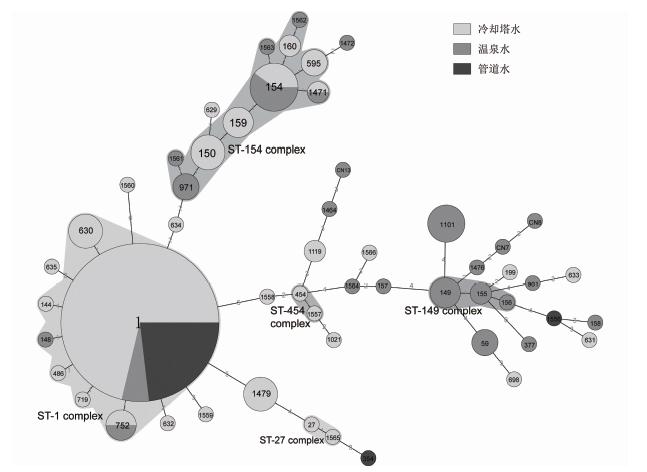
|
| 图 1 206株中国环境分离的嗜肺军团菌1型菌株SBT分型最小生成树 Fig. 1 Minimum spanning tree of 206 L. pneumophila serogroup 1 strains isolated in China |
通过查询EWGLI SBT数据库(http://www.ewgli.org),54个型别中有34个型别为中国特有;11个型别包含国外的临床菌株,其中1个型别(ST59)包含中国的临床菌株;有3个型别(ST1、ST59、ST154)分布超过3个国家,其中ST1分布于全球25个国家,ST59分布于12个国家,ST154分布于8个国家。
不同水源类型分离的嗜肺军团菌1型菌株SBT分型多态性差异大(表 2)。温泉水分离株多态性最大,49株温泉水分离株分成25个ST型(IOD=0.9498),各位点Nei指数为0.7721~0.8563;冷却塔水分离株多态性次之,130株冷却塔水分离株分成31个ST型(IOD=0.6453),各位点Nei指数为0.4227~0.4970;管道水分离株多态性最小,27株管道水分离株分成3个ST型(IOD=0.1453),各位点Nei指数为0.1425~0.1453。
| 基因类型 | 冷却塔水(130株) | 温泉水(49株) | 管道水(27株) | ||||||||
| 型别数 | 菌株数/型别 | Nei指数 | 型别数 | 菌株数/型别 | Nei指数 | 型别数 | 菌株数/型别 | Nei指数 | |||
| flaA | 9 | 14.4 | 0.4821 | 9 | 5.4 | 0.8563 | 3 | 9.0 | 0.1453 | ||
| pilE | 5 | 26.0 | 0.4834 | 6 | 8.2 | 0.7764 | 3 | 9.0 | 0.1453 | ||
| asd | 10 | 13.0 | 0.4970 | 6 | 8.2 | 0.7798 | 2 | 13.5 | 0.1425 | ||
| mip | 11 | 11.8 | 0.4227 | 7 | 7.0 | 0.7866 | 3 | 9.0 | 0.1453 | ||
| mompS | 11 | 11.8 | 0.4965 | 8 | 6.1 | 0.8333 | 3 | 9.0 | 0.1453 | ||
| proA | 11 | 11.8 | 0.4644 | 8 | 6.1 | 0.7721 | 3 | 9.0 | 0.1453 | ||
| neuA | 8 | 16.3 | 0.4756 | 9 | 5.4 | 0.7857 | 3 | 9.0 | 0.1453 | ||
对206株嗜肺军团菌1型菌株根据54个ST型构建最小生成树。如图 1,54个ST型形成5个克隆群,分别为ST-1 complex、ST-27 complex、ST-149 complex、 ST-154 complex、ST-454 complex。其余29个ST型别未形成克隆群。ST-1 complex是最大的克隆群,包含7个ST型的121株菌,其中57株为冷却塔水分离株、24株为管道水分离株、9株为温泉水分离株;其次为ST-154 complex,包含10个ST型的32株菌,其中19株为冷却塔水分离株、17株为温泉水分离株;ST-149 complex包含3个ST型的7株菌,均为温泉水分离株;ST-27 complex和ST-454 complex分别包含2个ST型的2株菌,均为冷却塔水分离株。
2.3 中国环境菌株和国外环境菌株的综合分析把本研究的206株嗜肺军团菌1型菌株SBT数据和文献报道以及EWGLI SBT数据库(http://www.ewgli.org)中分离自其他20个国家的总计993株的数据进行比较。1199株菌分为304个ST型别,其中274个型别只包含1个国家的菌株,其余30个型别包含多个国家的菌株。ST1 是包含菌株数最多的型别,包含490株菌,占总分析菌株的40.87%,分离自19个国家。其他型别包含1~60株菌。
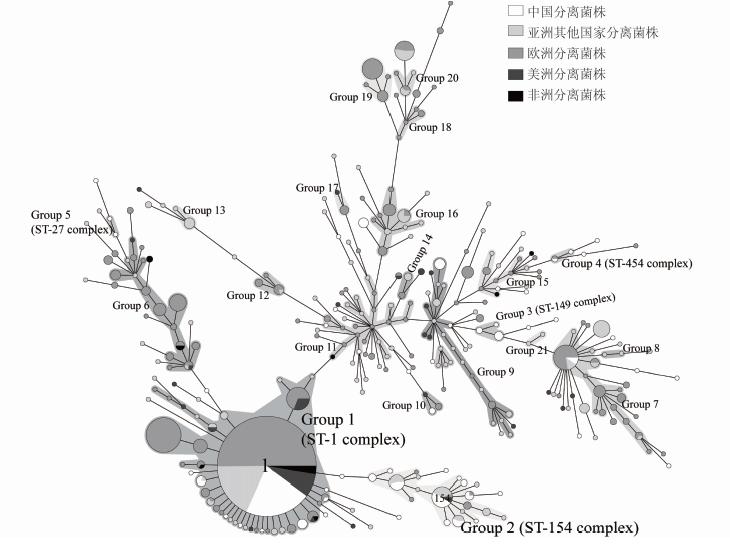
|
| 图 2 1199株全球21个国家环境分离的嗜肺军团菌1型菌株SBT分型最小生成树 Fig. 2 Minimum spanning tree of 1199 L. pneumophilaserogroup 1 strains isolated in 21 countries |
1199株菌根据ST型构建最小生成树,形成21个序列群(Group1~Group21)。其中Group 1(ST-1 complex)为最大的序列群,包含35个ST型的648株菌,分离自20个国家(除纳米比亚之外的所有国家)。以洲为单位分析,除Group 1(ST-1 complex)之外的序列群的分布有地域性。如Group 2 (ST-154 complex)包含68株菌,其中86.76%(59/68) 来自亚洲国家(中国34株、日本14株、韩国10株、科威特1株);Group 6、Group 7、Group 11、Group 12、Group 15、Group 18、Group 19主要包含来自欧洲的菌株;Group 6、Group 13、Group 21主要包含来自亚洲的菌株。
3 讨论我们对中国环境监测分离的206株来自不同自然环境的嗜肺军团菌1型菌株进行SBT分型,结果显示环境分离的嗜肺军团菌1型菌株SBT多态性大(IOD=0.7205),与国外环境分离株的多态性相似,如日本133株环境分离株分为50个ST型别,IOD为0.886[15];美国50株环境分离株分为21个ST型别,IOD为0.822[11];西班牙133株环境分离株分为30个ST型别,IOD为0.749[12]。SBT结果显示的多态性也与我们之前的PFGE分型结果一致[16]。这些结果表明,环境军团菌基因多态性大,提示军团菌为了适应环境,在选择压力下,菌株基因组变异较大。
环境军团菌在呈现基因多态性的同时也存在优势型别。在本研究中,ST1型占分析菌株的52.4%,为优势型别。ST1是全球范围内的一个流行菌型。日本、韩国、美国、西班牙的水体环境分离的嗜肺军团菌1型菌株中分别有43.0%、48.1%、40.0%、47.4%为ST1型[10,11,12,15]。美国、意大利、日本开展的研究表明ST1型在临床菌株中也属于优势型别[11,17,18,19]。日本的调查结果显示,ST1型在人工水体环境中的比率要高于自然环境[15]。在本研究中,管道水和冷却塔水分离株中分别有92.6%和59.2%为ST1型,而温泉水分离株中只有12.2%为ST1型。这与日本的研究结果一致。以上结果提示,ST1型菌株已经在水体环境中,尤其是人工水体环境,如管道水、冷却塔水中适应并定植,而ST型菌株在自然环境如温泉水、土壤中的定植能力相对较弱。
在本研究中,不同类型水系分离的菌株多态性差异较大。这可能与不同类型水体的特征,比如水温和pH值有关系。温泉水作为自然水体,与冷却塔水和管道水相比,特征比较复杂。在之前的研究中,温泉水的水温跨度为31~49 ℃,pH值为7.80~8.04[20];相比而言,冷却塔水和管道水的理化特征比较稳定,特别是管道水,在统一的处理措施下理化特征比较一致。温泉水中军团菌基因多态性更大的原因可能是,更复杂的环境要求军团菌具有更强的适应能力,导致军团菌不断的改变自身基因组去适应环境。
SBT与其他分型方法相比的优势之一是既可作为流行病学调查工具,又可分析菌株的菌群结构;另一个优势是不同实验室的结果可以很便捷地进行比对交流和综合分析。本研究中把中国菌株的结果和其他20个国家的菌株数据进行了比对和综合分析。结果显示,约90%(274/304)型别为某一国家特有,而ST1型几乎存在于每个国家(19/21),表明环境军团菌在具有很大的基因多态性的同时,也存在克隆化的特征。同时,不同的序列群的分布具有地域性,说明不同的军团菌克隆在不同地区定植传播。
环境分离的嗜肺军团菌1型菌株具有高度复杂的基因多态性和种群结构,并且在不同类型的水体环境里具有不同的多态性。ST1是我国也是全球环境菌株的优势型别,而另外有一部分型别和序列群只存在于特定的地区和国家。环境水体,如本研究涉及的冷却塔水、温泉水、管道水,是人体感染军团菌的主要来源,了解不同环境水体中军团菌的存在状况和菌群结构,有利于揭示军团菌的流行特征和外环境生存的生态学,为军团菌和军团菌病的防控提供理论基础。
| [1] | Diederen BMW. Legionella spp. and Legionnaires' disease[J]. J Infect,2008,56(1):1-12. |
| [2] | Fields BS, Benson RF, Besser RE. Legionella and Legionnaires' disease: 25 years of investigation[J]. Clin Microbiol Rev,2002,15(3):506-526. |
| [3] | Yu VL, Plouffe JF, Castellani-Pastoris M, et al. Distribution of Legionella species and serogroups isolated by culture in patients with sporadic community-acquired legionellosis: an international collaborative survey[J]. J Infect Dis,2002,186(1):127-128. |
| [4] | Qin T, Tian Z, Ren H, et al. Application of EMA-qPCR as a complementary tool for the detection and monitoring of Legionella in different water systems[J]. World J Microbiol Biotechnol,2012,28(5):1881-1890. |
| [5] | Fraser DW, Tsai TR, Orenstein W, et al. Legionnaires' disease: description of an epidemic of pneumonia[J]. N Engl J Med,1977,297(22):1189-1197. |
| [6] | Breiman RF, Cozen W, Fields BS,et al. Role of air sampling in investigation of an outbreak of Legionnaires' disease associated with exposure to aerosols from an evaporative condenser [J]. J Infect Dis,1990,161(6):1257-1261. |
| [7] | Lin H, Xu B, Chen Y, et al. Legionella pollution in cooling tower water of air-conditioning systems in Shanghai, China [J]. J Appl Microbiol,2009,106(2):606-612. |
| [8] | Gaia V, Fry NK, Afshar B, et al. Consensus sequence-based scheme for epidemiological typing of clinical and environmental isolates of Legionella pneumophila[J]. J Clin Microbiol,2005,43(5):2047-2052. |
| [9] | Ratzow S, Gaia V, Helbig JH, et al. Addition of neuA, the gene encoding N-acylneuraminate cytidylyl transferase, increases the discriminatory ability of the consensus sequence-based scheme for typing Legionella pneumophila serogroup 1 strains[J]. J Clin Microbiol,2007,45(6):1965-1968. |
| [10] | Lee HK, Shim JI, Kim HE, et al. Distribution of Legionella species from environmental water sources of public facilities and genetic diversity of L. pneumophila serogroup 1 in South Korea[J]. Appl Environ Microbiol,2010,76(19):6547-6554. |
| [11] | Kozak NA, Benson RF, Brown E, et al. Distribution of lag-1 alleles and sequence-based types among Legionella pneumophila serogroup 1 clinical and environmental isolates in the United States[J]. J Clin Microbiol,2009,47(8):2525-2535. |
| [12] | Sánchez-Busó L, Coscollá M, Pinto-Carbó M, et al. Characterization of Legionella pneumophila Isolated from a Common Watershed in Comunidad Valenciana, Spain[J]. PLoS One,2013,8(4):e61564. |
| [13] | Hunter PR, Gaston MA. Numerical index of the discriminatory ability of typing systems: an application of Simpson's index of diversity[J]. J Clin Microbiol,1988,26(11):2465-2466. |
| [14] | Malorny B, Junker E, Helmuth R. Multi-locus variable-number tandem repeat analysis for outbreak studies of Salmonella enterica serotype Enteritidis[J]. BMC Microbiol,2008,30(8):84. |
| [15] | Amemura-Maekawa J, Kikukawa K, Helbig JH, et al.Working Group for Legionella in Japan. Distribution of monoclonal antibody subgroups and sequence-based types among Legionella pneumophila serogroup 1 isolates derived from cooling tower water, bathwater, and soil in Japan[J]. Appl Environ Microbiol,2012,78(12):4263-4270. |
| [16] | Qin T,Ren HY,Zhou HJ,et al.Molecular typing of Legionella pneumophila isolates from China with pulsed field gel electrophoresis[J]. Chinese Journal of Epidemiology,2011,32(3):285-289.(in Chinese) 秦天,任红宇,周海健, 等. 中国嗜肺军团菌分离株脉冲场凝胶电泳分型分析以及数据库的建立[J]. 中华流行病学杂志,2011,32(3):285-289. |
| [17] | Kozak-Muiznieks NA, Lucas CE, Brown E, et al. Prevalence of sequence types among clinical and environmental isolates of Legionella pneumophila serogroup 1 in the United States from 1982 to 2012[J]. J Clin Microbiol,2014,52(1):201-211. |
| [18] | Iatta R, Cuna T, De Giglio O, et al. Sequence based typing of Legionella pneumophila sg 1 isolated in nosocomial acquired infections in Apulia, Southern Italy[J]. J Prev Med Hyg,2013,54(3):167-169. |
| [19] | Amemura-Maekawa J, Kura F, Helbig JH, et al. Working Group for Legionella in Japan. Characterization of Legionella pneumophila isolates from patients in Japan according to serogroups, monoclonal antibody subgroups and sequence types[J]. J Med Microbiol,2010,59(6):653-659. |
| [20] | Qin T, Yan G, Ren H, et al. High prevalence, genetic diversity and intracellular growth ability of Legionella in hot spring environments [J]. PLoS One,2013,8:e59018. |
 2015, Vol. 30
2015, Vol. 30


