扩展功能
文章信息
- 辛丽, 白天, 周剑芳, 唐静, 陈永坤, 陈涛, 史景红, 李晓丹, 李燕, 朱闻斐, 高荣保, 王大燕, 舒跃龙
- XIN Li, BAI Tian, ZHOU Jian-fang, TANG Jing, CHEN Yong-kun, CHEN Tao, SHI Jing-hong, LI Xiao-dan, LI Yan, ZHU Wen-fei, GAO Rong-bao, WANG Da-yan, SHU Yue-long
- 中国职业暴露人群感染H9N2禽流感病毒血清学调查
- Serological study of human infection with avian influenza A (H9N2) virus in population with occupational exposure in China
- 疾病监测, 2015, 30(5): 368-371
- Disease Surveillance, 2015, 30(5): 368-371
- 10.3784/j.issn.1003-9961.2015.05.007
-
文章历史
- 收稿日期:2015-02-05
禽流感是由禽流行性感冒病毒引起的一种禽类(家禽和野禽)传染病。在我国家禽中,高致病性H5N1和低致病性H9N2禽流感病毒最为流行[1]。H9N2病毒最早是美国于1966年从火鸡中分离出来的[2],随后传播到亚洲、欧洲、中东和非洲[3]。HA序列的基因进化树分析结果表明,H9N2病毒可以分为4个系,即G1系、G9系、Y430和北美系[4]。G9是近年来在中国流行的最主要的系别,其流行地域覆盖全国[3]。
1998年我国报道了首例人感染H9N2禽流感病例[5]。之后,全球共报告人感染H9N2病例22例,其中20例来自中国。我国分离的H9N2禽流感病毒的HA基因受体结合位点226位(H3 numbering)上出现Q226L的突变[6],提示H9N2病毒增强了与人源受体的结合能力。H9N2禽流感病毒可感染一系列哺乳动物,包括猪[7]、犬和猫[8],且在实验条件下可在雪貂间接触传播[9]。近期研究表明,H9N2病毒增加了其在鸡中的感染性[10]。H9N2禽流感病毒在禽间的广泛流行,极大的增加了与其他亚型流感病毒重配的概率。近年来,多个人感染的新型重配禽流感病毒,如H5N1[11]H7N9[12]和H10N8[13],其内部基因均来自H9N2。H9N2和H3N2病毒重配可提高其在雪貂中的传播力[9],而H9N2与2009年流感大流行H1N1[14]或H5N1[15]病毒的内部基因重配可提高其致病性。因此,H9N2病毒具有潜在流感大流行威胁。
人感染H9N2禽流感病毒的临床症状较轻,较易逃避流感样病例的监测。开展全国范围的血清学调查对于系统评估人感染H9N2禽流感病毒的风险因素具有重要意义。
1 材料与方法 1.1 血清和抗原本研究所用血清来自2009 2011年中国“职业暴露人群血清学和环境高致病性禽流感监测”,按照该监测方案的要求,血清采集对象包括活禽市场、家禽规模养殖场、家禽散养户、家禽屠宰加工厂和野生候鸟栖息地禽类暴露人员。本次血清学调查采样省份为22个省,包括11个南方省份和11个北方省份。本研究的抗原选取中国动物卫生与流行病中心陈继明教授实验室分离的H9N2禽流感病毒G9系毒株A/Chicken/AK4/Anhui/2011。
1.2 血凝抑制实验血清用火鸡浓红血球10 μl吸附1 h后离心,取上清血清,再用4倍受体破坏酶(RDE,国家流感中心制备)处理血清,37 ℃水浴16~18 h后置56 ℃水浴灭活30 min,以去除血清中非特异性抑制素。血凝抑制实验(hemoglutination inhibition assay,HI assay)的实验方法遵照世界卫生组织颁布的流感病毒实验室确认和病原学监测手册,使用96孔V底微量板(Corning),每孔加入25 μl PBS,首孔加入25 μl血清,之后每孔倍比稀释。为做好质量控制,每板加入阳性对照血清(雪貂血清,经中国疾病预防控制中心病毒病预防控制所动物伦理委员会审批)和阴性对照血清。每孔加入25 μl配置好的4个血凝单位的灭活抗原(0.5‰β-丙内酯灭活),轻轻拍打96孔板混匀后室温孵育20 min。每孔加入50 μl 1%火鸡红细胞悬液,室温孵育30 min。HI滴度≥40被判定为可疑阳性,并将继续开展微量中和实验复核。
1.3 微量中和实验微量中和实验(microneutraliz-ation assay,MN assay) 的实验方法遵照世界卫生组织颁布的流感病毒实验室确认和病原学监测手册[16]。人血清56 ℃灭活30 min,雪貂血清经4倍体积RDE处理。系列2倍稀释的血清加入50 μl 100 TCID50 (用含1% BSA的MEM细胞培养液配制)后37 ℃孵育1 h,加入100 μl 1.5×105 MDCK 细胞/ml,37 ℃孵育18 h。使用80%的丙酮固定细胞,用酶联免疫吸附(ELISA)方法检测NP蛋白,一抗为两种甲型流感NP单抗的混合物(Millipore,cat. #MAB8257 and MAB8258)。Reed-Muench方法计算血清中和抗体滴度。MN滴度≥40被判定为阳性。
1.4 统计分析使用chi-square or Fishers exact tests分析血清阳性率(GraphPad Prism5 software 5.00),P<0.05被判定为差异有统计学意义。
2 结果本研究采用HI初筛,HI滴度≥40的血清标本进行MN复核,结果MN检测为阳性的标本数为56份,血清阳性率为0.41%(表 1)。从不同暴露人群来看(表 1),除野生候鸟栖息地暴露人群的578份血清标本中未检出阳性标本外,其余各家禽暴露组均有阳性标本检出。活禽市场暴露人群血清阳性率显著高于其他各组暴露人群(P<0.05),为0.76%(29/504)。家禽规模养殖场、家禽散养户和屠宰加工厂暴露人群血清阳性率差异无统计学意义(P>0.05),分别为 0.32%(12/3787)、0.24%(10/4122)和0.2%(2/1017)。
| 职业人群 | 血清数 | MN≥40 | 血清阳性率(%) | 95%CI |
| 总人群 | 13 715 | 56 | 0.41 | 0.40~0.42 |
| 活禽市场 | 3 817 | 29 | 0.76 | 0.74~0.78 |
| 家禽规模养殖场 | 3 787 | 12 | 0.32 | 0.31~0.33 |
| 家禽散养户 | 4 122 | 10 | 0.24 | 0.23~0.24 |
| 禽类屠宰加工厂 | 1 017 | 2 | 0.20 | 0.19~0.21 |
| 野生候鸟栖息地 | 578 | 0 | 0.00 | - |
| 其他 | 394 | 3 | 0.76 | 0.69~0.83 |
| 性别 | ||||
| 女性 | 6 591 | 27 | 0.41 | 0.40~0.42 |
| 男性 | 7 124 | 29 | 0.41 | 0.40~0.42 |
| 年龄组(岁) | ||||
| 儿童 (0~) | 65 | 0 | 0.00 | - |
| 青年(15~) | 1 008 | 5 | 0.50 | 0.47~0.53 |
| 成年(25~) | 10 929 | 47 | 0.43 | 0.42~0.44 |
| 老年(60~) | 1 554 | 4 | 0.26 | 0.25~0.27 |
| 未登记年龄 | 159 | 0 | - | - |
| 地区 | ||||
| 南方 | 9 790 | 41 | 0.42 | 0.41~0.43 |
| 北方 | 3 925 | 15 | 0.38 | 0.37~0.39 |
从性别来看(表 1),男性和女性职业暴露人群血清阳性率差异无统计学意义(P=0.9121)。从不同年龄组人群来看(表 1),除儿童组无阳性标本检出外,其他各年龄组均有阳性标本检出(血清阳性率在0.25%~0.5%之间),且各组间差异无统计学意义(P=0.5617)。
从地域分布来看(图 1),22个标本采集省份中有7个省/直辖市(4个北方省/直辖市,3个南方省/直辖市)未检测到H9N2阳性血清,分别是青海、河北、黑龙江、陕西、安徽、江苏和重庆。上海的职业暴露人群血清阳性率最高,为1.42% (14/986),其余各省市均低于1%(表 2)。从各省的血清阳性率来看,H9N2禽流感病毒在我国多省市大范围存在,但人感染呈高度散发。按照南北方统计发现南方地区血清阳性率高于北方,分别为0.42%和0.38%,X2检验显示南北方阳性率差异无统计学意义(P=0.7611)。
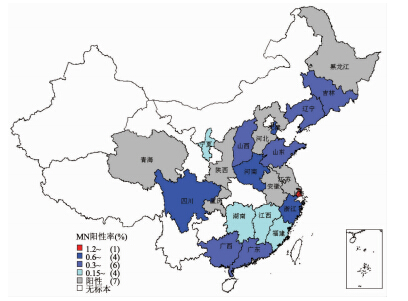
|
| 图 1 职业暴露人群感染H9N2禽流感病毒地区分布 Fig.1 Geographical distribution of H9N2 virus infections in population with occupational exposure in China |
| 地区 | 总数 | 阳性数 | 阳性率(%) |
| 北方 | 3925 | 15 | 0.38 |
| 河南 | 398 | 3 | 0.75 |
| 吉林 | 429 | 2 | 0.47 |
| 辽宁 | 619 | 3 | 0.48 |
| 宁夏 | 411 | 1 | 0.24 |
| 青海 | 140 | 0 | 0.00 |
| 山东 | 927 | 3 | 0.32 |
| 河北 | 121 | 0 | 0.00 |
| 黑龙江 | 213 | 0 | 0.00 |
| 陕西 | 124 | 0 | 0.00 |
| 山西 | 212 | 1 | 0.47 |
| 天津 | 331 | 2 | 0.60 |
| 南方 | 9790 | 41 | 0.42 |
| 安徽 | 612 | 0 | 0.00 |
| 福建 | 1524 | 3 | 0.20 |
| 广东 | 1527 | 8 | 0.52 |
| 广西 | 784 | 5 | 0.59 |
| 湖南 | 1928 | 4 | 0.20 |
| 江苏 | 407 | 0 | 0.00 |
| 江西 | 1046 | 2 | 0.19 |
| 上海 | 986 | 14 | 1.42 |
| 浙江 | 330 | 2 | 0.61 |
| 重庆 | 247 | 0 | 0.00 |
| 四川 | 399 | 3 | 0.75 |
H9N2禽流感病毒是我国流行的非常重要的一种禽流感病毒,相关动物部门已紧密监测其流行和变异情况[3, 6, 17, 18, 19, 20]。但该病毒对人群特别是职业暴露人群的系统监测工作尚未开展。之前在我国个别省/直辖市开展的血清学调查显示H9N2禽流感病毒在不同职业暴露人群的血清阳性率差异较大(1.3%~15.5%)[21, 22, 23, 24],总体来看,血清阳性率高于本研究的0.41%。主要原因有以下几点:(1)在江苏[24]、广州[21]和上海[23]开展的血清学研究采用的是HI方法,而本实验采用的是HI初筛,MN进行复核的方法。MN 被认为是流感血清学检测的金标准[25, 26]。(2)标本采集的人群不同和检测所使用的抗原不同亦会造成血清阳性率的差异。本研究中检测的是2009 2011年采集的各职业暴露人群的血清标本,抗原选择的是2011年我国分离的H9N2禽流感流行代表毒株[3]。
本次血清学调查的结果显示,H9N2禽流感病毒在我国人群的血清阳性率显著高于高致病性H5N1禽流感病毒,使用同批血清开展的H5N1禽流感血清学调查结果显示仅有2份阳性标本(本实验室监测结果,未公开发表)。目前我国共报告H9N2禽流感病例20例,远低于此次血清学调查的阳性标本数。主要是由于H9N2禽流感病毒感染成人后症状较轻,且被感染的职业暴露人群多处在流感监测较为薄弱的农村地区。此次血清学调查在我国15个省(直辖市、自治区)均有H9N2阳性标本检出,说明该病毒在我国已广泛存在。但受各地采样数量和人群的影响,各省/直辖市,特别是部分相邻省/直辖市的血清阳性率存在较大差异。比较不同职业人群,活禽市场暴露人群的血清阳性率显著高于其他各组,提示加强对活禽市场暴露人群的监测对于发现人感染新型流感病毒具有重要意义。活禽市场已被多次证实是人感染禽流感病毒的重要暴露源,如H5N1、H7N9等疫情,被誉为是禽流感病毒的孵化地[27]。加强对职业暴露人群的监测,特别是活禽市场暴露人群的监测对于发现和控制禽流感病毒具有重大意义。
| [1] | Pepin KM, Wang J, Webb CT, et al. Multiannual patterns of influenza A transmission in Chinese live bird market systems[J]. Influenza & Other Respir Viruses,2013,7(1):97-107. |
| [2] | Homme PJ, Easterday BC. Avian influenza virus infections. I. Characteristics of influenza A-turkey-Wisconsin-1966 virus[J]. Avian Dis,1970,14(1):66-74. |
| [3] | Jiang WM, Liu S, Hou GY, et al. Chinese and global distribution of H9 subtype avian influenza viruses[J]. PLoS One,2012,7(12):e52671. |
| [4] | Butt KM, Smith GJD, Chen HL, et al. Human infection with an avian H9N2 influenza A virus in Hong Kong in 2003[J]. J Clin Microbiol,2005,43(11):5760-5767. |
| [5] | Guo YJ, Li JG, Cheng XW,et al. Discovery of men infected by avian influenza A (H9N2) virus[J]. Chinese Journal of Experimental and Clinical Virology,1999, 13(2):105-108. (in Chinese) 郭元吉,李建国,程小雯,等. 禽H9N2亚型流感病毒能感染人的发现[J]. 中华实验和临床病毒学杂志,1999,13(12):105-108. |
| [6] | Choi YK, Ozaki H, Webby RJ, et al. Continuing evolution of H9N2 influenza viruses in Southeastern China[J]. J Virol,2004,78(16):8609-8614. |
| [7] | Peiris JSM, Guan Y, Markwell D, et al. Cocirculation of avian H9N2 and contemporary “human” H3N2 influenza A viruses in pigs in southeastern China: potential for genetic reassortment? [J]. J Virol,2001,75(20):9679-9686. |
| [8] | Zhang K, Zhang Z, Yu Z, et al. Domestic cats and dogs are susceptible to H9N2 avian influenza virus[J]. Virus Res, 2013, 175(1):52-57. |
| [9] | Wan HQ, Sorrell EM, Song HC, et al. Replication and transmission of H9N2 influenza viruses in ferrets: evaluation of pandemic potential[J]. PLoS One,2008,3(8):e2923. |
| [10] | Pu J, Wang S, Yin Y, et al. Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J]. Proc Natl Acad Sci USA,2015,112(2):548-553. |
| [11] | Guan Y, Shortridge KF, Krauss S. Molecular characterization of H9N2 influenza viruses: were they the donors of the “internal” genes of H5N1 viruses in Hong Kong? [J]. Proc Natl Acad Sci USA,1999,96(16):9363-9367. |
| [12] | Gao RB, Cao B, Hu YW, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med,2013,368(20):1888-1897. |
| [13] | Chen HY, Yuan H, Gao RB, et al. Clinical and epidemiological characteristics of a fatal case of avian influenza A H10N8 virus infection: a descriptive study[J]. Lancet,2014,383(9918):714-721. |
| [14] | Sun YP, Qin K, Wang JJ, et al. High genetic compatibility and increased pathogenicity of reassortants derived from avian H9N2 and pandemic H1N1/2009 influenza viruses[J]. Proc Natl Acad Sci USA,2011,108(10):4164-4169. |
| [15] | Gohrbandt S, Veits J, Breithaupt A, et al. H9 avian influenza reassortant with engineered polybasic cleavage site displays highly pathogenic phenotype in chicken[J]. J Gen Virol,2011,92(Pt 8):1843-1853. |
| [16] | WHO. Manual for the laboratory diagnosis and virological surveillance of influenza[R]. World Health Organization,2011. |
| [17] | Dong GY, Luo J, Zhang H, et al. Phylogenetic diversity and genotypical complexity of H9N2 influenza A viruses revealed by genomic sequence analysis[J]. PLoS One,2011,6(2):e17212. |
| [18] | Li CJ, Yu KZ, Tian GB, et al. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J]. Virology,2005,340(1):70-83. |
| [19] | Xu KM, Smith GJD, Bahl J, et al. The genesis and evolution of H9N2 influenza viruses in poultry from southern China,2000 to 2005[J]. J Virol,2007,81(19):10389-10401. |
| [20] | Yu H, Zhou YJ, Li GX, et al. Genetic diversity of H9N2 influenza viruses from pigs in China: a potential threat to human health? [J]. Vet Microbiol,2011,149(1/2):254-261. |
| [21] | Wang M, Fu CX, Zheng BJ. Antibodies against H5 and H9 avian influenza among poultry workers in China[J]. N Engl J Med,2009,360:2583-2584. |
| [22] | Huang R, Wang AR, Liu ZH, et al. Seroprevalence of avian influenza H9N2 among poultry workers in Shandong province, China[J]. Eur J Clin Microbiol Infect Dis,2013,32(10):1347-1351. |
| [23] | Wang Q, Ju L, Liu P, et al. Serological and Virological Surveillance of Avian Influenza A Virus H9N2 Subtype in Humans and Poultry in Shanghai, China, Between 2008 and 2010[J]. Zoonoses Public Health,2015,62(2):131-140. |
| [24] | Chen Y, Zheng Q, Yang K, et al. Serological survey of antibodies to influenza A viruses in a group of people without a history of influenza vaccination[J]. Clin Microbiol Infect,2011,17(9):1347-1349. |
| [25] | Kayali G, Setterquist SF, Capuano AW, et al. Testing human sera for antibodies against avian influenza viruses: horse RBC hemagglutination inhibition vs. microneutralization assays[J]. J Clin Virol,2008,43(1):73-78. |
| [26] | Veguilla V, Hancock K, Schiffer J, et al. Sensitivity and specificity of serologic assays for detection of human infection with 2009 pandemic H1N1 virus in U. S. populations[J]. J Clin Microbiol,2011,49(6):2210-2215. |
| [27] | Yu HJ, Wu JT, Cowling BJ, et al. Effect of closure of live poultry markets on poultry-to-person transmission of avian influenza A H7N9 virus: an ecological study[J]. Lancet,2014,383(9916):541-548. |
 2015, Vol. 30
2015, Vol. 30


