扩展功能
文章信息
- 张慧娟, 潘琢, 魏建春, 张恩民, 梁旭东, 杜小莉, 崔志刚, 李伟
- ZHANG Hui-juan, PAN Zuo, WEI Jian-chun, ZHANG En-min, LIANG Xu-dong, DU Xiao-li, CUI Zhi-gang, LI Wei
- 中国蜡样芽胞杆菌脉冲场凝胶电泳标准化技术的建立与应用
- Establishment and application of standard pulsed-field gel electrophoresis assay to detect Bacillus cereus
- 疾病监测, 2015, 30(5): 411-414
- Disease Surveillance, 2015, 30(5): 411-414
- 10.3784/j.issn.1003-9961.2015.05.018
-
文章历史
- 收稿日期:2015-01-05
2. 石家庄市疾病预防控制中心, 河北 石家庄 050011
2. Shijiazhuang Municipal Center for Disease Control and Prevention, Shijiazhuang 050011, Hebei, China
C蜡样芽胞杆菌(蜡样杆菌)是常见的细菌性食源性食物中毒的致病菌,也是医院感染病原体之 一[1]。在我国多个省份每年都有暴发的报告[2]。 脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE) 是近20多年发展起来的常用于细菌分子分型研究的一种方法,在食源性传染病的流行病学调查和溯源中得到广泛应用[3, 4]。目前,PFGE在蜡样杆菌的分子流行病学调查和溯源中应用相对较少,一方面是因为蜡样杆菌是一种革兰阳性菌,可形成芽胞,在PFGE方法的菌体裂解和内切酶酶切DNA上存在一定难度。另一方面,蜡样杆菌引起的食物中毒通常症状较轻且病程较短,所以我国对该致病菌的重视程度不足。近年来有报道发现少数蜡样杆菌引起的食物中毒可导致严重的后果,甚至致死病例[5]。因此有必要建立可行的蜡样杆菌PFGE标准操作方法,为蜡样杆菌引起的食源性疾病及医院感染的溯源控制提供技术手段。
1 材料与方法 1.1 菌株实验选用51株蜡样杆菌,其中包括3株标准菌株,分别是ATCC 13061、ATCC 10876和CMCC 63301,其余48株为分离自我国不同地区和来源的蜡样杆菌,由本实验室保存。内切酶的选择实验选用其中的3株菌。电泳实验所需DNA分子质量Marker用沙门菌大肠埃希菌Braenderup 血清型全球参考菌株 H9812,由中国疾病预防控制中心(CDC)传染病预防控制所PulseNet China室提供。菌株信息见表 1。
| 分离年份 | 分离省份 | 分离来源 | 菌株数 |
| 2008 | 贵州 | 土壤 | 1 |
| 2012 | 河北 | 食品 | 13 |
| 内蒙古 | 土壤 | 7 | |
| 四川 | 土壤 | 6 | |
| 新疆 | 食品 | 7 | |
| 云南 | 土壤 | 7 | |
| 2013 | 安徽 | 食品 | 5 |
| 浙江 | 患者 | 2 |
溶菌酶(Sigma);蛋白酶K(Merck);限制性内切酶(TaKaRa);Tris和 乙二胺四乙酸(EDTA)(Solarbio);脉冲场电泳用琼脂糖为Seakem® Gold Agarose(Lonza,Rockland,ME USA),核酸染料用GelRed(Biotium)。
1.3 主要仪器脉冲场电泳仪CHEF-Mapper(Bio-Rad); 读胶仪 Gel DocXR(Bio-Rad);低温冰箱、离心机、振荡器、水浴箱、水浴摇床、菌液浊度测定仪。
1.4 PFGE实验方法按照PulseNet China实验手册标准方法步骤,采用溶菌酶裂解及染色体包埋及胶块处理方法,方案简述如下。
1.4.1 胶块制备将蜡样杆菌接种于LB琼脂培养基上,37 ℃培养 12 ~18 h。用接种环刮取生长良好的新鲜菌落,均匀悬浊于盛有1~2 ml TE (10 mmol/L Tris-HCl ∶ 1 mmol/L EDTA,pH 8.0)的一次性试管中,调整其麦氏比浊值至5.0。取300 μl 细菌悬浊液于相应的1.5 ml离心管中,每管中加入6 μl 溶菌酶溶液(100 mg/ml),37 ℃孵育15 min后再加入20 μl 蛋白酶 K(20 mg/ml)。取制备好且置于56 ℃水浴箱中恒温30 min左右的1% Seakem Gold,1% SDS 300 μl与菌悬液等量混匀后加入模具,室温下凝固 15 min 后制成胶块。
1.4.2 裂解菌体细胞将凝固的胶块转移至50 ml试管中,加入5 ml细胞裂解液(10 mmol/L Tris-HCl ∶ 1 mmol/L EDTA,pH 8.0加25 μl溶菌酶至终浓度0.5 mg/ml),置37 ℃水浴170 r/min,轻摇4 h。
1.4.3 蛋白消化从水浴摇床中取出裂解充分的试管,倒掉裂解液,每管加入5 ml蛋白裂解液 (50 mmol/L Tris-HCl ∶ 50 mmol/L EDTA,pH 8.0加1%十二烷基肌氨酸钠),再加入25 μl蛋白酶K至终浓度0.1 mg/ml。置54 ℃水浴170 r/min,轻摇2 h。
1.4.4 洗胶块弃去裂解液,加入15 ml 50 ℃预热的纯水,50 ℃水浴170 r/min洗10 min,弃去纯水再加15 ml 50 ℃预热的TE(10 mmol/L Tris-HCl ∶ 1 mmol/L EDTA,pH 8.0),轻摇至胶块悬起,50 ℃水浴170 r/min洗4次,每次15 min。
1.5 染色体酶切用DNAStar 5.01软件对GenBank上公布的全基因组测序的4株蜡样杆菌(GenBank编号分别为NC003909、NC004722、NC006274和NC011773)进行分析,选出8种可能适合蜡样杆菌PFGE分子分型实验的内切酶,用3株菌进行酶切试验。选择的酶包括SmaⅠ、NotⅠ、MluⅠ、ApaⅠ、BlnⅠ、NheⅠ、SpeⅠ及XbaⅠ。NotⅠ酶切选用51株蜡样杆菌。先切取2 mm宽的胶块,用200 μl酶切缓冲液在推荐的温度下平衡10~15 min。吸出缓冲液,每管加入200 μl含20 U 的酶切液,沙门菌H9812用XbaⅠ 40 U,37 ℃酶切3 h。其他酶切液的配制与孵育温度按照说明书操作。
1.6 电泳及成像聚类电泳条件:0.5×TBE电泳液 2000~2200 ml,电压6.0 V/cm,120°脉冲夹角,起始脉冲时间5 s,终止脉冲时间80 s,电泳时间19 h。内切酶选择试验中电泳起始脉冲时间为1 s,终止时间为25 s,电泳时间18 h。电泳完成后将胶放入0.3 μl/ml GelRed溶液中染色30 min,纯水脱色20 min,读胶仪中成像。获得的图像用BioNumerics 5.10 数据库软件进行处理,识别图像条带。图像用统一的Marker校准,标定条带位置,必要时进行人工校正。聚类图根据非加权配对算术平均法(UPGMA)构建[6],条带位置差异容许度1.0%,不同菌株的电泳条带相似性系数用Dice系数表示。
2 结果根据选择的菌浓度、溶菌酶和蛋白酶K的浓度与裂解时间,最终获得了适合蜡样杆菌PFGE分析的均匀清晰的图谱。图 1和图 2显示了3株蜡样杆菌用8种酶切后的PFGE图谱, 其中NotⅠ产生的条带大约为11~13条且条带分布均匀,可满足实验的要求,SmaⅠ和ApaⅠ的条带在20条之上,但这2种酶的小片段偏多,给条带判断带来困难。而其他5种酶所产生的酶切片段不是太多就是太少,不适合作为该菌PFGE分型的酶。
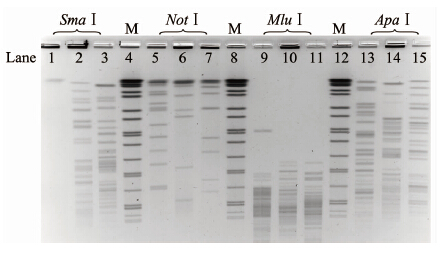
|
| 图 1 3株蜡样杆菌的不同酶切PFGE电泳图谱 Fig.1 PFGE images of 3 B. cereus Ⅰsolates restrⅠcted with SmaⅠ (lanes 1 to 3),NotⅠ (lanes 5 to 7),MluⅠ (lanes 9 to 11),and ApaⅠ (lanes 13 to 15) 注: SmaⅠ (lanes 1~3),NotⅠ (lanes 5~7),MluⅠ (lanes 9 ~11)和ApaⅠ (lanes 13~15),泳道4、8和12为分子质量标准。 |
|
| 图 2 3株蜡样杆菌的不同酶切PFGE电泳图谱 Fig.2 PFGE images of 3 B. cereus isolates restricted with BlnI (lanes 1 to 3),NheI (lanes 5 to 7),SpeI (lanes 9 to 11),and XbaⅠ (lanes 13 to 15) 注: BlnⅠ (lanes 1~3),NheⅠ (lanes 5~7),SpeⅠ (lanes 9 ~11)和XbaⅠ (lanes 13~15)。泳道4、8和12为分子质量标准。 |
图 3显示了对来自8个省份的不同分离来源的51株蜡样杆菌的聚类分析结果,51株蜡样杆菌用NotⅠ酶切呈现46个PFGE带型,其中分离自浙江患者的2株菌(2/2)带型一致;安徽有2株菌(2/5)带型一致,河北有2株菌(2/13)带型一致,四川有2株菌(2/6)带型一致,其余各菌株带型均有差异,带型间聚类相似性在12.5%~100%,说明作为食源性疾病病原菌和环境菌株的蜡样杆菌遗传呈现高分化多样性。NotⅠ内切酶在起始时间5 s和终止时间80 s的电泳条件下对蜡样杆菌的酶切电泳图谱显示各菌株均能获得数量适中、分布均匀且分辨率较好的条带,可作为蜡样杆菌PFGE较为理想的选择。

|
| 图 3 51株蜡样杆菌经NotⅠ酶切的PFGE结果的聚类树状图 Fig.3 Clustering results of PFGE patterns of 51 B. cereus isolates restricted with NotⅠ |
PFGE近年来被公认为细菌分型及追踪传染源的有效方法之一,该方法能整体揭示细菌基因组的遗传差别,已被普遍应用于细菌性食物中毒的分子流行病学调查中。但目前国内还没有使用该方法对蜡样杆菌进行分析的先例。这主要是因为蜡样芽胞杆菌是一种革兰阳性芽胞杆菌,相对于革兰阴性细菌而言,细胞壁裂解比较困难。国外的研究中均采用新鲜培养的对数生长期的细菌,并使用溶菌酶和溶葡萄球菌酶及蛋白酶K进行长时间的裂解,然后胶块在不同温度下反复长时间清洗,增加了实验操作时间和复杂性,影响了该方法的实际应用[7, 8]。
本研究针对革兰阳性细菌的特点,探索并尝试的蜡样杆菌PFGE实验方法,优化并确定了最优菌浓度、裂解酶。实验尝试中,我们发现在合适的菌浓度下,溶菌酶对细菌的裂解时间至关重要,是蜡样杆菌PFGE实验成功的关键所在。
根据蜡样杆菌全基因组测序选择需要的内切酶,选择了酶切条带理论数量在 0~100 之间的酶,这是为了尽可能将需要的酶选择在评价体系中。但是酶切片段过多会降低图谱质量,影响对图谱的分析。酶切片段过小,则不适合作为该菌PFGE实验的内切酶。依据实验产生条带分布合理、清晰可辨的图谱的条件,评价了8种内切酶并最终确定NotⅠ为最优内切酶,其次是SmaⅠ,与国外部分文献报道一致[3, 4]。
对51株蜡样杆菌的PFGE聚类分析结果显示各地菌株呈现多态性分布,在不同地区、不同来源间的菌株间没有明显的聚集性,进一步说明了蜡样杆菌在遗传特征上的多样性。另外本研究中选择的菌株均来自于常规食品卫生监测或土壤中,全部菌株中只有2株分离自患者,可能也是菌株间缺少聚集性的原因之一。
本研究建立了我国的蜡样杆菌PFGE操作方法,提供了可行的实验室监测平台,但因缺乏蜡样杆菌暴发食物中毒的病例相关菌株,未能从流行病学关联性进行评价和分析,这是本研究的缺项。但是,在国外已有报道成功将蜡样杆菌PFGE方法应用于食物中毒暴发疫情调查中[9]。蜡样杆菌是常见食源性疾病和医院感染相关疾病病原体,在现场流行病调查中,利用PFGE方法较好的 分辨力、重复性、分型力及网络化分子 分型溯源监测(PulseNet China)优势,可以对相关暴发追踪溯源起到重要的作用[10, 11]。本研究确定的蜡样芽胞杆菌PFGE方法在食源性传染病分子流行病调查中的应用应是一个值得尝试的方法。
| [1] | Stenfors Arnesen LP, Fagerlund A, Granum PE. From soil to gut: Bacillus cereus and its food poisoning toxins[J]. FEMS Microbiol Rev,2008,32(4):579-606. |
| [2] | Zhang S. The food poisoning case analysis in China from 1985 to 2000[J]. Chinese Journal of Food Hygiene,2002, 14(5):26-28. (in Chinese) 张肃. 1985-2000年我国食物中毒情况重点分析[J]. 中国食品卫生杂志,2002,14(5):26-28. |
| [3] | Schoonmaker D, Heimberger T, Birkhead G. Comparison of ribotyping and restriction enzyme analysis using pulsed-field gel electrophoresis for distinguishing Legionella pneumophila isolates obtained during a nosocomial outbreak[J]. J Clin Microbiol,1992,30(6):1491-1498. |
| [4] | Heinzen R, Stiegler GL, Whiting LL, et al. Use of pulsed field gel electrophoresis to differentiate Coxiella burnetii strains[J]. Ann N Y Acad Sci,1990,590:504-513. |
| [5] | Wang Y, Zhou GP. Analysis on fatal cases caused by Bacillus cereus induced foodborne poisoning[J]. Chinese Journal of Food Hygiene,2011,23(2):191-194.(in Chinese) 王洋,周帼萍. 蜡样芽胞杆菌食物中毒死亡案例分析[J]. 中国食品卫生杂志,2011,23(2):191-194. |
| [6] | Hunter SB, Vauterin P, Lambert-Fair MA, et al. Establishment of a universal size standard strain for use with the PulseNet standardized pulsed-field gel electrophoresis protocols: converting the national databases to the new size standard[J]. J Clin Microbiol,2005,43(3):1045-1050. |
| [7] | Harrell LJ, Andersen GL, Wilson KH. Genetic variability of Bacillus anthracis and related species[J]. J Clin Microbiol,1995,33(7):1847-1850. |
| [8] | Otlewska A, Oltuszak-Walczak E, Walczak P. Differentiation of strains from the Bacillus cereus group by RFLP-PFGE genomic fingerprinting[J]. Electrophoresis,2013,34(20/21):3023-3028. |
| [9] | Liu PY, Ke SC, Chen SL. Use of pulsed-field gel electrophoresis to investigate a pseudo-outbreak of Bacillus cereus in a pediatric unit[J]. J Clin Microbiol,1997,35(6):1533-1535. |
| [10] | Cheng C, Tian JP, Wang QK, et al. Pathogenic detection of a food poisoning due to contamination with Bacillus cereus[J]. Chinese Journal of Health Laboratory Technology,2012,22(12):2901-2902.(in Chinese) 程冲,田锦平,王庆奎,等. 一起由蜡样芽胞杆菌引起的食物中毒的病原学检测[J]. 中国卫生检验杂志,2012,22(12):2901-2902. |
| [11] | Song QF, Wang AH, Yang YB, et al. Application of molecular biological technology in a food poisoning incident[J]. Chinese Journal of Food Hygiene,2014,26(3):254-258.(in Chinese) 宋启发,王爱红,杨元斌,等. 分子生物学技术在一起食物中毒检测中的应用[J].中国食品卫生杂志,2014,26(3):254-258. |
 2015, Vol. 30
2015, Vol. 30


