扩展功能
文章信息
- 高红, 郑剑, 宋启发, 周伟艳
- GAO Hong, ZHENG Jian, SONG Qi-fa, ZHOU Wei-yan
- 宁波地区金黄色葡萄球菌临床株肠毒素基因与多位点序列分型研究
- Enterotoxin genes detection and multi-locus sequence typing of Staphylococcus aureus isolated from patients in Ningbo
- 疾病监测, 2015, 30(9): 717-722
- Disease Surveillance, 2015, 30(9): 717-722
- 10.3784/j.issn.1003-9961.2015.09.005
-
文章历史
- 收稿日期:2015-03-24
金黄色葡萄球菌(Staphylococcus aureus)可导致皮肤、黏膜、深部组织和重要脏器的化脓性炎症,它的致病力主要取决于产生的各种毒素和侵袭性酶。肠毒素是金黄色葡萄球菌引起食物中毒的主要原因,具有超抗原特性,能够激活大量的具有强大杀伤力的T淋巴细胞,使其释放细胞因子。因此一直以来是研究的重点和热点。近年来陆续发现了十几种新的肠毒素基因,但是临床株所分泌的肠毒素基因95%以上为肠毒素A基因(S.aureus enterotoxin gene A,sea)、肠毒素B基因(S.aureus enterotoxin gene B,seb)、肠毒素C基因(S.aureus enterotoxin gene C,sec)、肠毒素D基因(S.aureus enterotoxin gene D,sed)[1, 2, 3]。1998年Maiden等[4]在多位点酶电泳技术的基础上建立了多位点序列分型(multi-locus sequence typing,MLST)技术,并首次应用于脑膜炎奈瑟菌的分型研究。该技术以分析管家基因的序列多态性为基础,重复性好,试验数据全球共享,为分析金黄色葡萄球菌遗传相关性,探索菌株的起源和进化提供了巨大的信息资源。金黄色葡萄球菌广泛存在于自然界中,在医院室内空气、各种物体表面以及医务人员手上均可检测到,对于儿童、老年人以及免疫力低下的烧伤或者透析患者具有极大的风险。在院内感染中金黄色葡萄球菌占有较大的比例,其检出率呈逐年增高态势[5]。为了掌握宁波地区金黄色葡萄球菌临床株肠毒素基因分布和分子分型特点,为有效控制金黄色葡萄球菌感染提供实验室依据,特进行如下研究。
1 材料与方法2006、2008以及2011-2013年收集宁波市各医院从患者标本中分离的金黄色葡萄球菌菌株。标本来自重症监护病房(ICU)和烧伤病房患者静脉血、气管盥洗液、深静脉导管及创口脓性分泌物。2006年和2008年各收集7株,2011年收集41株,2012年和2013年各收集50株,共收集155株。质控标准菌株为金黄色葡萄球菌(ATCC 25923),均为本研究室保存。菌株的鉴定方法包括VITEK Ⅱ生化鉴定系统(BioMerieux,France)。
1.2 方法 1.2.1 4种肠毒素基因和MLST分型扩增引物sea、seb、sec和sed扩增引物见表1,MLST扩增和测序引物见参考文献[6]。引物均由上海英骏公司合成。
| 引物 | 序列(5'→3') | 片段大小(bp) |
| seaF | TGGTGCTTATTATGGTTATC | 217 |
| seaR | TCTTGCTTGAAGATCCAACT | |
| sebF | AAGGACACTAAGTTAGGGAA | 443 |
| sebR | ATCATGTCATACCAAAAGCT | |
| secF | CTCAAGAACTAGACATAAAAGCTAGG | 271 |
| secR | TCAAAATCGGATTAACATTATCC | |
| sedF | ATAGTAGTTTACCTGGGTCG | 429 |
| sedR | AGTGTTCTTGATTAGCGTTT |
采用TaKaRa公司的MiniBEST细菌基因组DNA提取试剂盒(3.0版),按照试剂说明书操作提取金黄色葡萄球菌基因组DNA。
1.2.3 肠毒素基因扩增采用TaKaRa公司Premix TaqTM (2.0版) 试剂盒,按照试剂说明书配置PCR反应体系。 聚合酶链反应(PCR)反应条件为 94 ℃预变性5 min,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。取扩增产物10 μl点样于1%琼脂糖凝胶(内含溴化乙锭最终浓度为0.5 μg/ml),电压10 V/cm,电泳30 min,暗室内紫外光下(波长254~365 nm)观察电泳结果,观察是否有预期分子质量大小的条带出现。
1.2.4 金黄色葡萄球菌MLST扩增、测序和数据分析采用TaKaRa公司 Premix TaqTM (Ex TaqTM Version 2.0) 试剂盒,按照试剂说明书配置PCR反应体系。选择7个管家基因arc、aro、glp、gmk、pta、tpi 和yqi进行PCR,PCR反应条件参考文献[6]。扩增产物利用ABI3730全自动基因分析仪(上海英骏公司)采用测序引物对扩增的片段进行正反方向核苷酸序列测定,测序结果利用Chromas 1.63软件编辑和拼接,利用Bioedit 7.0软件进行校正,校正后的序列与金黄色葡萄球菌MLST标准数据库(http://saureus.mlst.net/)进行比对,获得各管家基因位点的等位基因数值,并形成相应的等位基因谱,判断其序列型(sequence type,ST)。利用Mega 6.0软件对管家基因核苷酸序列构建系统进化树,利用eBURST V3软件对ST进行分析。参考菌株来自金黄色葡萄球菌MLST标准数据库。
2 结果 2.1 金黄色葡萄球菌肠毒素基因检测结果155株菌株中,4种肠毒素基因总检出率为29.03%(45/155),其中sea阳性株为26株(16.77%),seb阳性株为9株(5.81%),sec阳性株为18株(11.61%),sed阳性株为6株(3.87%)。45株菌株最多能同时检测出2种肠毒素,共出现8种肠毒素基因组合,sea(14株)、sec(9株)和sea+sec(8株)3种基因组合居于前3位。见表2。
| 年份 | sea | seb | sec | sed | sea+seb | sea+sec | seb+sed | sec+sed |
| 2006 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| 2008 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 0 |
| 2011 | 3 | 0 | 2 | 0 | 1 | 2 | 0 | 0 |
| 2012 | 5 | 2 | 4 | 1 | 0 | 3 | 0 | 0 |
| 2013 | 6 | 1 | 2 | 3 | 3 | 2 | 0 | 1 |
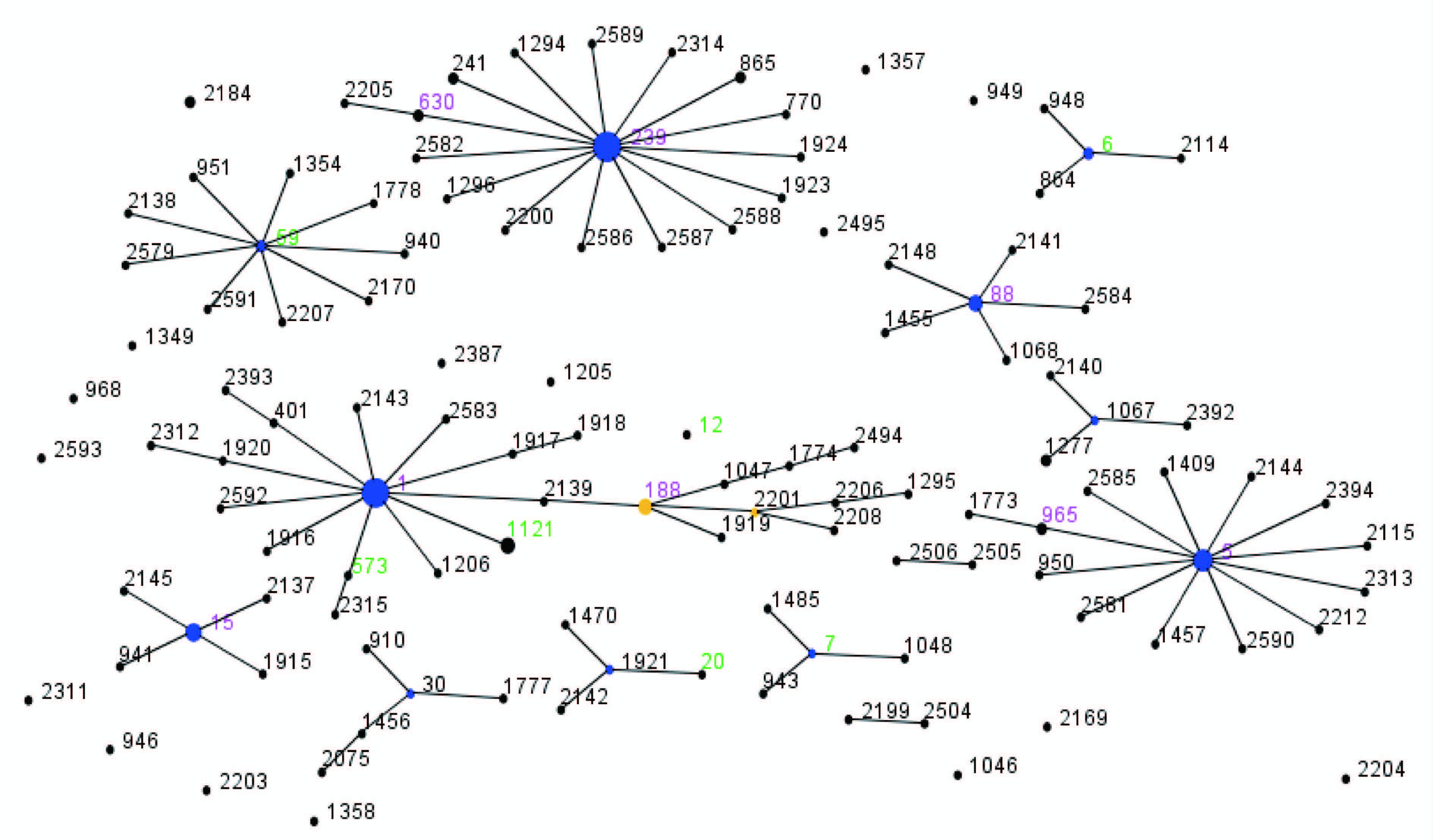
45株肠毒素基因阳性菌株可分为15个ST。ST1的菌株有14株,占31.11%;ST5的菌株有6株,占13.33%; ST1121和ST15的菌株均为4株,各占8.89%;ST188和ST239各3株,各占6.67%;ST6和ST59各2株,各占4.44%;其他ST均只有1株菌株。从金黄色葡萄球菌 MLST标准数据库中选择分离自中国患者和携带者的菌株作为参照,利用eBURST V3软件绘制菌株ST分布图。数据库中参考菌株共有156株,分为137个ST。ST239的菌株有13株,占8.33%;ST88菌株有3株,占1.92%; ST5、ST241、ST865、ST1277和ST2184各2株,其他均只有1株。参考菌株分离时间为1998、2001-2002和2004-2012年,主要来自北京市(27株)、香港(19株)、四川省(15株)、江西省(14株)、安徽省(14株)和浙江省(14株)。201株中国临床株可分为11个克隆群。最大克隆群为ST1克隆复合体,由45株菌株组成(22株宁波株和23株中国其他地区株),存在1个一级亚群(ST188)和1个二级亚群(ST2201)。第二大克隆群为ST239克隆复合体,由35株菌株组成(4株宁波株和31株中国其他地区株),并且是主要起源克隆群(SLV=15)。第三克隆群为ST5克隆群,由22株菌株组成(7株宁波株和15株中国其他地区株)。宁波肠毒素基因阳性临床株以ST1克隆群为最大克隆群(22株),其次为ST5克隆群(7株)和ST239克隆群(4株)。与中国其他地区临床株比较,宁波肠毒素基因阳性临床株中出现了7个新的ST,分别是ST59、ST12、ST1121、ST573、ST20、ST6和ST7。结果见图1。
|
| 图1 eBURST V3软件分析中国金黄色葡萄球菌临床株ST分布 Fig.1 Distribution of ST of clinical S. aureus strains isolated in China 注:数字表示ST,绿色为宁波肠毒素阳性菌株特有ST,黑色为中国其他地区临床株ST,红色为两种来源均有。 |
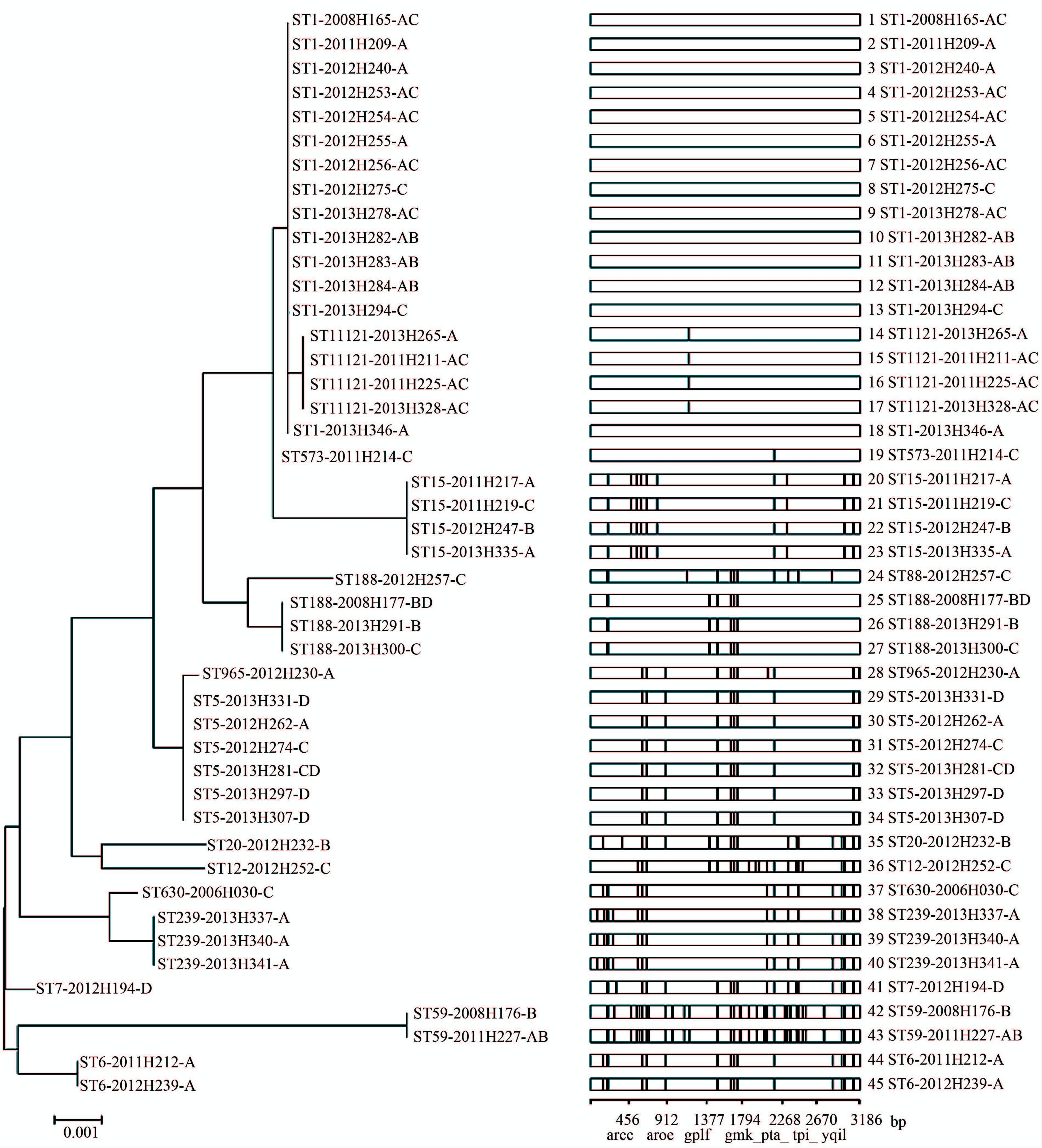
45株肠毒素基因阳性菌株按照形成ST的顺序将7个管家基因连接成长度为3186 bp的多基因序列,利用Mega 6.0软件采用Maximum Likelihood方法绘制系统进化树。从图2可知,45株菌株在进化树上主要形成7个分支。以ST1-2008H165-AC菌株作为标准序列,其他条序列共出现69个碱基变异位点,总碱基变异数为404,变异率为0.28%。ST573和ST1121在进化树上与ST1处于同一分支。ST188与ST1在进化树上处于不同分支,与ST88在进化树上的距离比较近。ST630与ST239处于同一分支上,ST965和ST5处于同一分支。在ST1菌株所在的分支中,有16株菌株携带sea,12株菌株携带sec。在14株ST1菌株中,12株携带sea,7株携带sec。2013年分离的6株ST1菌株中有3株同时携带肠毒素基因sea和seb。在2012年和2013年分离的菌株中检测到6株ST5菌株,其中有4株携带sed。3株ST239菌株均为2013年检出,并且携带的肠毒素均为sea。
|
| 图2 宁波肠毒素基因阳性金黄色葡萄球菌临床株的7个管家基因系统进化树分析 Fig.2 Phylogenetic tree of 7 house-keeping genes of enterotoxin genes positive S. aureus strains in Ningbo 注:菌株编号为ST-年份H菌株编号-肠毒素基因,右侧条图黑线表示与1号菌株相比该处核苷酸有差异。 |
湖南曹虹等[7]发现124株金黄色葡萄球菌临床株中,4种肠毒素基因(sea、seb、sec和sed)携带率依次为90.5%、6.9%、65.5%和5.2%。安徽汪永禄等[8]发现55株临床株中4种肠毒素基因携带率依次为14.55%、9.09%、12.73%和7.27%。宁波155株临床株中4种肠毒素基因携带率则为16.77%、5.81%、11.61%和3.87%,与安徽的结果接近。同一株金黄色葡萄球菌可以检测到2种或2种以上肠毒素基因型,且不同基因型的检出率与菌株有一定的关联度[9]。曹虹等[7]和陈智等[10]均发现sea与sec呈现出一定的连锁关系。在本次研究中也发现了同样的现象,在45株肠毒素阳性菌株中,sea与sec同时阳性的菌株有8株,阳性率高达17.78%。但是155株临床株最多能同时检测到2种肠毒素,形成8种肠毒素基因组合,与以上结果不相符。
目前在MLST数据库中金黄色葡萄球菌可以分成2840种ST,共收录了4929株菌株的相关信息,其中中国临床菌株有156株。按照ST单点变异型(single-locus variant,SLV)值≥3为一个克隆群,具有最大SLV值的ST为主要起源。经eBURST V3分析显示,201株中国临床株(包括MLST数据库中国临床株和宁波肠毒素基因阳性临床株)分为11个克隆群。宁波肠毒素基因阳性临床株以ST1克隆群为流行优势菌群,其次为ST5克隆群和ST239克隆群。Xiao等[11]对来自中国大陆27个省45个城市的69家医院分离的1141株耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)进行MLST分型,这些菌株可以分成36个ST,属于7个克隆群,ST239克隆群为流行优势菌群(整体流行率为75.37%),其次为ST5克隆群(整体流行率为12.62%)和ST59克隆群(整体流行率为7.27%),ST1克隆群居于第四位(整体流行率为0.96%)。Xie等[12]研究发现分离自中国14个省份的108株金黄色葡萄球菌可以分为25个ST,这25个ST属于16个克隆群,其中ST239克隆群有35株为流行优势菌群,其次为ST1克隆群(11株)和ST5克隆群(10株)。温州地区2002年12月至2008年6月分离自皮肤和软组织感染的111株金黄色葡萄球菌以ST239为流行优势菌群[13]。中国其他地区临床株以ST239克隆群为流行优势菌群,ST1克隆群和ST5克隆群紧跟其后。这种差异可能与宁波菌株均携带肠毒素基因或者菌株分离的时间地点、来源不同有关。与中国其他地区临床株比较,宁波肠毒素基因阳性临床株中出现了7个新的ST,分别是ST59、ST12、ST1121、ST573、ST20、ST6和ST7。ST59、ST20、ST7和ST6在近年中国其他地区的研究中陆续被发现[11, 13, 14, 15]。因此ST12、ST573和ST1121是在我国境内新发现的ST。
4 5株肠毒素基因阳性临床株在进化树上主要分为7个分支。ST573、ST1121均属于ST1克隆群,因此在进化树上与ST1菌株处于同一分支;ST630与同一克隆群的创建者ST239菌株处于同一分支上,同理ST965和ST5菌株处于同一分支,与eBURST V3 软件分析结果保持一致。但是两种软件在数据分析上又有区别,ST188为ST1克隆群的亚群,但在进化树上处于不同分支,ST88和ST188处于不同的克隆群,在进化树上的距离却比较近,因此要结合这两种软件对数据进行综合分析。
在系统进化树上可以看出,肠毒素基因的分布与菌株的ST呈一定的连锁关系,并随菌株分离的时间变化。ST1克隆群以携带sea(16株)和sec(12株)为主,尤其是ST1菌株,sea和sec的阳性率高达85.71%和50.00%。但是2013年分离的6株ST1菌株中却有3株同时携带sea和seb。在2012年和2013年分离的菌株中检测到ST5克隆群,该克隆群携带sed的阳性率高达57.14%。3株ST239菌株均为2013年检出,并且携带的肠毒素均为sea。以上这些发现还需要进行深入的研究。
志谢:本文使用的金黄色葡萄球菌MLST数据库由Wellcome信托基金资助,由伦敦帝国理工学院维护,在此表示感谢。)
| [1] | Orwin PM, Leung DYM, Donahue HL, et al. Biochemical and biological properties of staphylococcal enterotoxin K [J]. Infect Immun,2001,69(1):360-366. |
| [2] | Ren K, Bannan JD, Pancholi V, et al. Characterization and biological properties of a new staphylococcal exotoxin [J]. J Exp Med,1994,180(5):1675-1683. |
| [3] | Cai CY, Ma XL, Ji B, et al. Detection of Staphylococcus aureus toxigenes and its clinical application [J]. Journal of Bengbu Medical College,2008,33(1):9-12. (in Chinese) 蔡朝阳,马筱玲,纪冰,等. 金黄色葡萄球菌毒素基因的检测及临床应用 [J]. 蚌埠医学院学报,2008,33(1):9-12. |
| [4] | Maiden MCJ, Bygraves JA, Feil E, et al. Multilocus sequence typing: a portable approach to the identification of clones within populations of pathogenic microorganisms [J]. Proc Natl Acad Sci USA,1998,95(6):3140-3145. |
| [5] | Jin CC, Jiang HH, Jiang LX. Clinical bacterial distribution and analysis of drug resistance in lower respiratory tract nosocomial infection from 2004 to 2008 [J]. Chinese Journal of Nosocomiology,2010,20(7):1028-1030. (in Chinese) 金晨慈,蒋欢欢,蒋龙翔.2004-2008年下呼吸道医院感染病原菌分布及耐药性分析 [J]. 中华医院感染学杂志,2010,20(7):1028-1030. |
| [6] | Enright MC, Day NP, Davies CE, et al. Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones of Staphylococcus aureus[J]. J Clin Microbiol,2000,38(3):1008-1015. |
| [7] | Cao H, Wang M, Zheng R, et al. Investigation of enterotoxin gene in clinical isolates of Staphylococcus aureus [J]. Journal of Southern Medical University,2012,32(5):738-741,745. (in Chinese) 曹虹,王敏,郑荣,等. 金黄色葡萄球菌临床分离株肠毒素基因的调查分析 [J]. 南方医科大学学报,2012,32(5):738-741,745. |
| [8] | Wang YL, Wang DC, Zhang P, et al. Enterotoxin genes of Staphylococcus aureus of clinical specimens and drug resistance [J]. Journal of Public Health and Preventive Medicine,2013,24(2):18-22. (in Chinese) 汪永禄,王多春,张萍,等. 临床患者标本金黄色葡萄球菌肠毒素基因及耐药性的检测分析 [J]. 公共卫生与预防医学,2013,24(2):18-22. |
| [9] | Akineden Ö, Annemüller C, Hassan AA, et al. Toxin genes and other characteristics of Staphylococcus aureus isolates from milk of cows with mastitis [J]. Clin Diagn Lab Immunol,2001,8(5):959-964. |
| [10] | Chen Z, Jiang YS, Xiong Y, et al. Detection of toxin genes among Staphylococcus aureus isolates from food-poisoning episodes by PCR Assay [J]. Chinese Journal of Health Laboratory Technology,2009,19(1):21-23. (in Chinese) 陈智,江元山,熊燕,等. 金黄色葡萄球菌食物中毒分离株毒素基因的PCR分析 [J]. 中国卫生检验杂志,2009,19(1):21-23. |
| [11] | Xiao M, Wang H, Zhao Y, et al. National surveillance of methicillin-resistant Staphylococcus aureus in China highlights a still-evolving epidemiology with 15 novel emerging multilocus sequence types[J]. J Clin Microbiol,2013,51(11):3638-3644, doi: 10.1128/JCM.01375-13. |
| [12] | Xie YP, He YP, Gehring A, et al. Genotypes and toxin gene profiles of Staphylococcus aureus clinical isolates from China[J]. PLoS One,2011,6(12):e28276, doi: 10.1371/journal.pone.0028276. |
| [13] | Yao D, Yu FY, Qin ZQ, et al. Molecular characterization of Staphylococcus aureus isolates causing skin and soft tissue infections (SSTIs) [J]. BMC Infect Dis,2010,10: 133, doi: 10.1186/1471-2334-10-133. |
| [14] | Fan J, Shu M, Zhang G, et al. Biogeography and virulence of Staphylococcus aureus [J]. PLoS One,2009,4(7):e6216, doi: 10.1371/journal.pone.0006216. |
| [15] | Du XF, Xiao M, Liang HY, et al. An improved MLVF method and its comparison with traditional LVF, spa typing, MLST/SCC mec and PFGE for the typing of methicillin-resistant Staphylococcus aureus [J]. Int J Mol Sci,2014,15(1):725-742, doi:10.3390/ijms15010725. |
 2015, Vol. 30
2015, Vol. 30


