扩展功能
文章信息
- 关静, 任丽, 陈涛, 郭强, 王慧玲, 甫尔哈提, 关晓冬, 张燕
- GUAN Jing, REN Li, CHEN Tao, GUO Qiang, WANG Hui-ling, Fuerhati , GUAN Xiao-dong, ZHANG Yan
- 新疆部分地区麻疹野病毒分离与基因特征分析
- Analysis on isolation and genotyping of wild measles virus in some areas of Xinjiang
- 疾病监测, 2015, 30(9): 723-726
- Disease Surveillance, 2015, 30(9): 723-726
- 10.3784/j.issn.1003-9961.2015.09.006
-
文章历史
- 收稿日期:2014-11-21
2. 中国疾病预防控制中心病毒病预防控制所, 北京 102206
2. Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
麻疹是由麻疹病毒引起的严重危害儿童健康的急性呼吸道传染病,世界卫生组织(WHO)已将麻疹定为继全球消灭天花和即将消灭脊髓灰质炎之后的第三个将被消除或消灭的传染病[1]。麻疹消除需要病毒学依据来证实,即≥12个月无本土麻疹病毒的传播。麻疹病毒基因型别与地理分布和流行年代密切相关,不同地区以及不同时期有不同的本土流行株或优势流行株[2, 3],因此,研究不同地区的各个年代所流行的麻疹病毒的基因型分布和流行趋势,就显得至关重要。本研究针对2013-2014年新疆维吾尔自治区(新疆)部分地区医疗机构就诊的47例麻疹患者咽拭子标本进行病毒分离和基因特征分析,结果如下。
1 材料与方法 1.1 标本来源标本的采集和处理方法参照《全国麻疹监测方案2014版》。各县(市)疾病预防控制中心(CDC)对2013-2014年期间散发的麻疹疑似病例,采集出疹5 d内的咽拭子,标本保存在含5%牛血清、终浓度2000 U/ml青霉素、200 μg/ml链霉素和制霉菌素的DMEM病毒运输液中。48 h内冷藏运输至实验室,-70 ℃保存待检。
1.2 麻疹病毒分离选用WHO推荐的Vero/SLAM细胞分离麻疹病毒,细胞从中国CDC病毒病预防控制所引入。吸取处理后的咽拭子标本0.2 ml接种于单层覆盖Vero/SLAM细胞的斜面试管,吸附1.5 h后弃上清,换细胞维持液37 ℃培养。每天观察细胞病变(cytopathic effect,CPE),经3代,每代培养7 d,细胞病变达75%~90%时收获并冻存。
1.3 核酸提取采用QIAGEN RNEASY Mini Kit (250)(Cat. No.74106)试剂盒提取麻疹病毒的 RNA,按说明书步骤进行。提取后的总RNA于-80 ℃ 冷冻保存备用。
1.4 反转录-聚合酶链反应(RT-PCR)采用TaKaRa PrimeScript one step RT-PCR Kit (Cat # DRR057A)试剂进行RT-PCR反应[4],反应体系及条件:25 μl 2×PCR Buffer,2 μl PrimeScript 1 step Enzyme Mix,1 μl上游引物MV214 (20 μmol/L),1 μl下游引物MV216 (20 μmol/L),6 μl模板RNA,加RNase Free dH2O至终体积为50 μl。使用ABI 7500 PCR 仪进行麻疹病毒N基因羧基末端456 bp片段扩增,反应条件为50 ℃ 30 min,94 ℃ 2 min; 94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,30个循环; 72 ℃ 10 min。每次实验用去离子水作阴性对照。扩增产物用毛细管电泳仪电泳后,观察结果。
1.5 序列测定和分析取RT-PCR阳性扩增产物,用QIAGEN公司的QIAquick Gel Extraction Kit纯化试剂盒,按说明书进行纯化。纯化产物使用上下游引物进行双向标记,标记试剂为Big Dye Terminator Cycle Sequencing Kit(ABI),反应条件为 96 ℃ 1 min; 96 ℃ 10 s,50 ℃ 5 s,60 ℃ 4 min,共25个循环。标记产物用Big Dye X Terminator purification kit(ABI)再次纯化后,在测序仪上自动完成序列测定。用WHO推荐的26株A~G基因型毒株序列和Shanghai-191及4株中国H1基因型共31株作为参照株,对2013-2014年新疆分离到的7株麻疹毒株进行基因型鉴定。同时用上述4株H1基因型毒株序列和Shanghai-191和Changchun-47两株疫苗株及目前流行的H1a亚型毒株作为参照进行同源性分析。
2 结果 2.1 麻疹病毒分离采集的47份咽拭子标本接种Vero /SLAM细胞后,7例标本于第二或三代出现了典型的麻疹巨细胞融合病变。其中1份来自克拉玛依市,6份来自哈密地区的哈密市和巴里坤县。
7份毒株核酸提取物进行RT-PCR扩增,毛细管电泳结果显示,在768 bp处呈现目的条带。
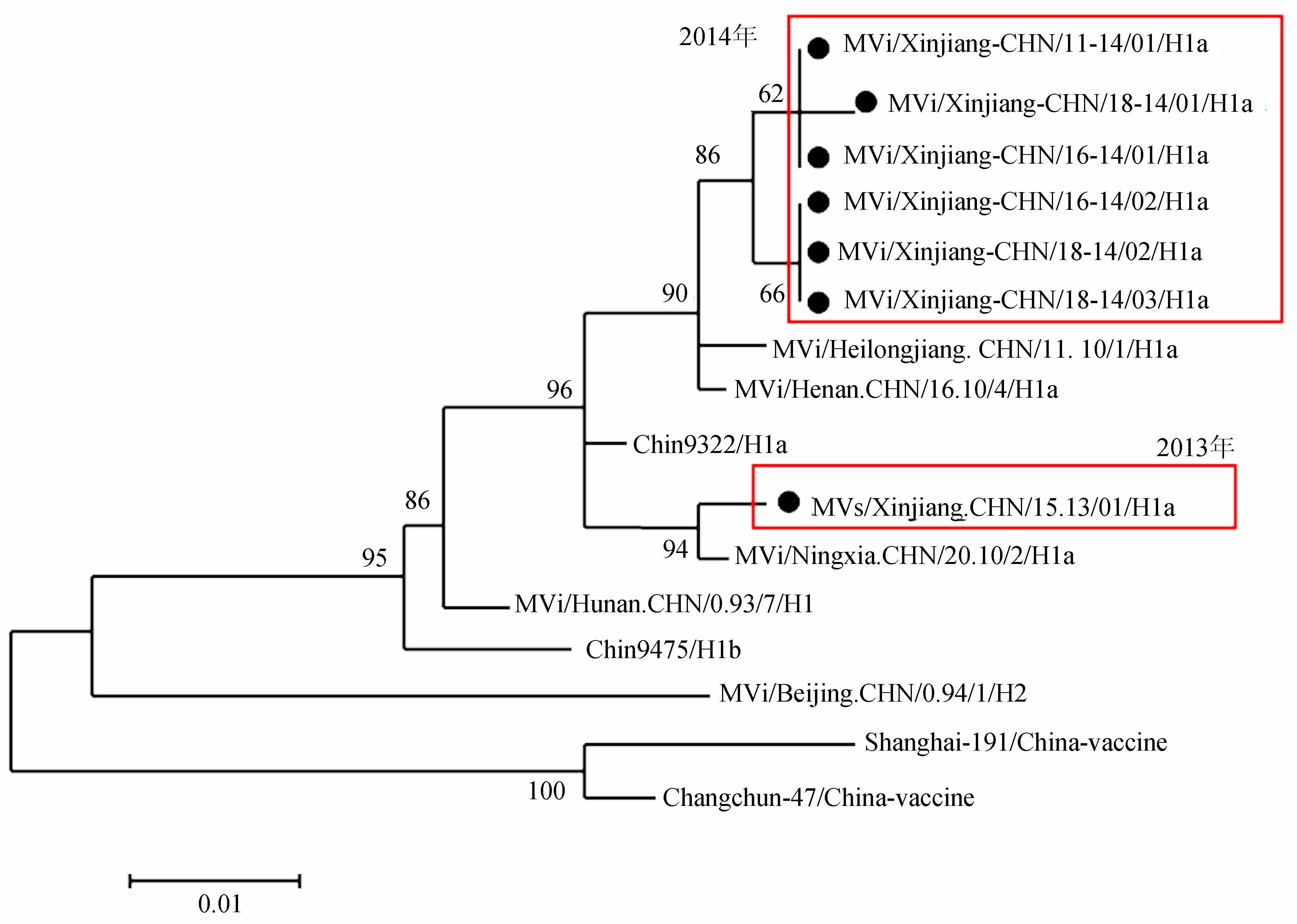
2.3 麻疹病毒的标准命名分离到的7株麻疹病毒经核苷酸序列测定和分析,基因型均为H1a亚型,7株麻疹病毒按照国家麻疹实验室统一编号和WHO推荐命名规则标准命名,见表1。
| 地区 | 国家实验室编号 | 野毒株标准命名 | 基因型 | 亚组 |
| 克拉玛依市 | XJ13-1 | MVs/Xinjiang.CHN/15.13/01[H1a] | H1 | H1a |
| 哈密市 | XJ14-1 | MVi/Xinjiang-CHN/16-14/01[H1a] | H1 | H1a |
| 哈密市 | XJ14-2 | MVi/Xinjiang-CHN/16-14/02[H1a] | H1 | H1a |
| 哈密市 | XJ14-3 | MVi/Xinjiang-CHN/11-14/01[H1a] | H1 | H1a |
| 哈密市 | XJ14-4 | MVi/Xinjiang-CHN/18-14/01[H1a] | H1 | H1a |
| 哈密市 | XJ14-5 | MVi/Xinjiang-CHN/18-14/02[H1a] | H1 | H1a |
| 巴里坤县 | XJ14-6 | MVi/Xinjiang-CHN/18-14/03[H1a] | H1 | H1a |
通过对N基因末端456个核苷酸序列测定和分析,用Mega 5.0软件分析7株分离株与WHO推荐26株A~G基因型毒株,Shanghai-191疫苗株和4株H1基因型共31株参比株,并做进化分析,构建进化关系树,与Chin9322/H1a在一个分支上,Bootstrap为96,因此2013-2014年7株毒株为H1a型,见图1。将4株毒株与Shanghai-191疫苗株,用于基因型别鉴定的6株H1型毒株及3株目前H1a亚型流行株作为参照进行同源性分析。分析结果见表2。从表2可以看出2013年分离的毒株与2014年有较明显的区别,同源性为98.0%,而2014年6株毒株同源性为100.0%。与疫苗株相比,2013年毒株与Shanghai-191同源性为89.5%,核苷酸有48个不同,氨基酸有16个不同;2014年3株毒株与Shanghai-191同源性为87.3%,核苷酸有58个不同,氨基酸有20个不同。4株与WHO推荐用于鉴定基因型别的6株H1基因型同源性为91.0%~99.3%,核苷酸差异为4~42个,氨基酸差异为1~13个。4株与目前3株流行H1a亚型同源性为97.3%~100.0%,核苷酸差异为0~13个,氨基酸差异为0~4个;其中2013年毒株与Mvi/Ningxia.CHN/20.10/2/H1a同源性为100.0%,2014年3株与MVi/Henan.CHN/16.10/4/H1a同源性为100.0%。
|
| 图1 麻疹病毒分离阳性株与其他代表株的进化关系树 Fig.1 Phylogenetic tree of measles isolates in Xinjiang and others representative references strains |
| XJ | XJ | XJ | XJ | S191 | HN | HLJ | NX | HN | BJ | Chin | Chin | |
| 42017 | 42049 | 42077 | 42169 | H1a | H1a | H1a | H1 | H2 | H1a | H1b | ||
| XJ13-1 | 0.98 | 0.98 | 0.98 | 0.895 | 0.98 | 0.973 | 1 | 0.98 | 0.924 | 0.993 | 0.98 | |
| XJ14-2 | 0.98 | 1 | 1 | 0.873 | 1 | 0.987 | 0.98 | 0.959 | 0.91 | 0.973 | 0.959 | |
| XJ14-3 | 0.98 | 1 | 1 | 0.873 | 1 | 0.987 | 0.98 | 0.959 | 0.91 | 0.973 | 0.959 | |
| XJ14-6 | 0.98 | 1 | 1 | 0.873 | 1 | 0.987 | 0.98 | 0.959 | 0.91 | 0.973 | 0.959 | |
| S191 | 0.895 | 0.873 | 0.873 | 0.873 | 0.873 | 0.866 | 0.895 | 0.888 | 0.881 | 0.895 | 0.895 | |
| HNH1a | 0.98 | 1 | 1 | 1 | 0.873 | 0.987 | 0.98 | 0.959 | 0.91 | 0.973 | 0.959 | |
| HLJH1a | 0.973 | 0.987 | 0.987 | 0.987 | 0.866 | 0.987 | 0.973 | 0.953 | 0.903 | 0.966 | 0.953 | |
| NXH1a | 1 | 0.98 | 0.98 | 0.98 | 0.895 | 0.98 | 0.973 | 0.98 | 0.924 | 0.993 | 0.98 | |
| HNH1 | 0.98 | 0.959 | 0.959 | 0.959 | 0.888 | 0.959 | 0.953 | 0.98 | 0.931 | 0.973 | 0.973 | |
| BJH2 | 0.924 | 0.91 | 0.91 | 0.91 | 0.881 | 0.91 | 0.903 | 0.924 | 0.931 | 0.917 | 0.924 | |
| ChinH1a | 0.993 | 0.973 | 0.973 | 0.973 | 0.895 | 0.973 | 0.966 | 0.993 | 0.973 | 0.917 | 0.973 | |
| ChinH1b | 0.98 | 0.959 | 0.959 | 0.959 | 0.895 | 0.959 | 0.953 | 0.98 | 0.973 | 0.924 | 0.973 | |
| 注:(1)氨基酸序列同源性在左下,核苷酸序列同源性在右上。XJ13-1:MVs/Xinjiang.CHN/15.13/01/H1a; XJ14-2:MVi/Xinjiang-CHN/16-14/02/H1a; XJ14-3:MVi/Xinjiang-CHN/11-14/01/H1a; XJ14-6:MVi/Xinjiang-CHN/18-14/03/H1a; S191:Shanghai-191/China-vaccine; HNH1a:MVi/Henan.CHN/16.10/4/H1a; HLJH1a:MVi/Heilongjiang.CHN/11.10/1/H1a; NXH1a:Mvi/Ningxia.CHN/20.10/2/H1a; HNH1:MVi/Hunan.CHN/0.93/7/H1; BJH2:MVi/Beijing.CHN/0.94/1/H2; ChinH1a:Chin9322/H1a; ChinH1b:Chin9475/H1b | ||||||||||||
对于麻疹病毒的病原学监测而言,尽管采用了Vero/Slam细胞株提高了病毒分离率,但分离麻疹病毒工作仍较为困难[5],与麻疹病毒对培养细胞的敏感性、麻疹病毒病原学变异及标本的采集、运输、贮存等条件有关。新疆地处边远少数民族地区,经济相对落后,交通欠发达,幅员辽阔,在长距离长时间的运输过程中,标本中活病毒滴度有可能下降,在一定程度上影响麻疹病毒分离工作,本研究中的病毒分离率为17%,与其他研究报道的33%相比偏低[6]。在新疆咽拭子标本的采集、运送等很难达到相应的要求,这也是2013-2014年未分离到距乌鲁木齐市较远的南、北疆其他地区麻疹毒株的原因之一。今后在病原学监测工作中,可以直接通过临床原始标本提取核酸,并进行基因序列测定,这种方法在很多省份已证实可行,可获得更多的病毒基因序列。
新疆麻疹病毒病原学相关的数据有限,有学者于2003-2004年、2008年对乌鲁木齐市麻疹野病毒基因型的研究发现,H1a基因亚型是乌鲁木齐市本土的优势基因型,亦存在H1b亚型[7, 8]。本次通过对克拉玛依市和哈密地区麻疹病毒分子流行病学的研究,证实7株麻疹毒株均是H1a基因型,说明流行于新疆的本土麻疹病毒株为H1基因型,且为优势基因亚型。新疆地处我国的最西方,与8个国家为邻,而这些接壤的国家都有其本土流行株,因此,防止非本土基因型流行株的输入已是新疆防控麻疹疫情的重要环节,且有必要在本研究的基础上,继续开展更为广泛且连续的病毒学监测,阐明新疆流行本土株病毒的变异变迁,同时也及时发现可能的输入基因型病毒,为消除麻疹和证实消除提供科学数据。
| [1] | Zhou JH, Wang S, Chen C, et al. The establishment of method for identifying china vaccine strains and wild strains of measles virus [J]. Chinese Journal of Vaccines and Immunization,2009, 15(4):310-315. (in Chinese) 周剑惠,王爽,陈超,等.中国麻疹病毒疫苗株与野毒株鉴别方法的建立[J]. 中国疫苗和免疫,2009,15(4):310-315. |
| [2] | Zhang Y, Xu WB, Zhu Z, et al. Molecular epidemiology analysis of wild-type measles viruses circulated in China in 2003 [J]. Chinese Journal of Vaccines and Immunization,2005,11(3):165-174. (in Chinese) 张燕,许文波,朱贞,等.中国2003年流行的麻疹野病毒分子流行病学分析[J]. 中国计划免疫,2005,11(3):165-174. |
| [3] | Tong WB, He JL, Sun L, et al. Genetic characterization of imported measles virus in Sichuan [J]. Journal of Preventive Medicine Information,2009,25(11):927-930. (in Chinese) 童文彬,何吉兰,孙莉,等. 四川省1株输入性麻疹病毒基因特征分析[J]. 预防医学情报杂志,2009,25(11):927-930. |
| [4] | Zhang Y, Xu ST, Wang HL, et al. Single endemic genotype of measles virus continuously circulating in China for at least 16 years[J]. PLoS One,7(4):e34401. |
| [5] | Liu L, Sun L, He JL, et al. Sequence analysis on N gene of mealses virus isolated in Sichuan province,2011 [J]. Journal of Preventive Medicine Information,2012,28(6):426-429. (in Chinese) 刘李,孙莉,何吉兰,等.2011年上半年四川省麻疹病毒分离株N基因序列分析[J]. 预防医学情报杂志,2012,28(6):426-429. |
| [6] | Wang Y, Ma Y, Zhang Y, et al. Study on gene characteristic of wild-type measles viruses circulated in Liaoning province[J]. Chinese Journal of Vaccines and Immunization,2008,14(3):214-219. (in Chinese) 王艳,马艳,张燕,等.辽宁省2001-2006年麻疹野病毒分离株基因特征分析[J]. 中国疫苗和免疫,2008,14(3):214-219. |
| [7] | Yang XL, Zhang Y, Sun H, et al. Genetic characterization of wild-type measles viruses isolated in Xinjiang Uighur autonomous region in 2003 and 2004 [J]. Chinese Journal of Vaccines and Immunization,2007,13(5):409-413. (in Chinese) 杨学磊,张燕,孙荷,等.新疆维吾尔自治区2003-2004年麻疹野病毒分离株基因特征分析[J]. 中国计划免疫,2007,13(5):409-413. |
| [8] | Mijiti MMT, Wang HL, Xu ST, et al. Genetic characterization of measles virus caused the measles outbreak in Xinjiang[J]. Chinese Journal of Experimental and Clinical Virology,2010,24(5):337-339. (in Chinese) 米吉提·买买提,王慧玲,许松涛,等.引起乌鲁木齐成人麻疹暴发的麻疹病毒基因特征分析[J]. 中华实验和临床病毒学杂志,2010,24(5):337-339. |
 2015, Vol. 30
2015, Vol. 30


