扩展功能
文章信息
- 吴健, 陶静, 王绪琴, 汪红卫, 周建军, 郑敏, 周艳秋, 郁晓磊, 盖晶, 薛以乐, 康来仪
- WU Jian, TAO Jing, WANG Xu-qin, WANG Hong-wei, ZHOU Jian-jun, ZHENG Min, ZHOU Yan-qiu, YU Xiao-lei, GAI Jing, XUE Yi-le, KANG Lai-yi
- 2007-2013年上海市HIV-1感染者毒株耐药监测
- Surveillance for HIV drug resistance in HIV infection cases in Shanghai,2007-2013
- 疾病监测, 2015, 30(11): 930-934
- Disease Surveillance, 2015, 30(11): 930-934
- 10.3784/j.issn.1003-9961.2015.11.010
-
文章历史
- 收稿日期: 2015-07-02
2. 上海市虹口区疾病预防控制中心, 上海 200082;
3. 上海市疾病预防控制中心, 上海 200336;
4. 上海市长宁区疾病预防控制中心, 上海 200051;
5. 上海市静安区疾病预防控制中心, 上海 200041
2. Hongkou District Center for Disease Control and Prevention, Shanghai, Shanghai 200082, China;
3. Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China;
4. Changning District Center for Disease Control and Prevention, Shanghai, Shanghai 200051, China;
5. Jing'an District Center for Disease Control and Prevention, Shanghai, Shanghai 200041, China
高效抗反转录病毒联合疗法(highly active antiretroviral therapy,HAART)是目前治疗人类免疫缺陷病毒(human immunodeficiency virus,HIV,艾滋病病毒)/获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS,艾滋病)患者最为有效的治疗方法。但是,由于HIV-1极易突变,尤其在药物作用下,会选择性地改变蛋白酶(protease,PR)和反转录酶(reverse transcriptase,RT)部分位点上的氨基酸,从而产生耐药性导致抗病毒治疗的失败[1]。随着HAART中多种药物的联合使用,开始出现多重耐药毒株,甚至未经抗病毒治疗的患者也可能携带耐药HIV毒株,加速了艾滋病的蔓延,严重影响了HARRT效果,也增加了艾滋病预防控制的难度[2]。2002年我国开展了免费抗病毒治疗,并取得了较好的疗效,但是耐药变异也明显增加[3, 4]。开展HIV耐药监测是预防抗病毒治疗失败及合理选择治疗方案的重要手段,在西方发达国家以个体化治疗为主,在患者开始HARRT治疗前,作为常规进行耐药检测。而我国在这方面工作是否必要又应该如何进行,急需加以研究。本研究对上海市2007-2013年尚未开始抗病毒治疗的部分HIV-1 感染者开展耐药监测,阐明未治疗人群中HIV-1耐药毒株的流行和传播状况,分析影响耐药毒株流行的主要因素,从而为科学指导上海市抗病毒治疗工作,提高治疗效果,制定长期治疗策略提供依据。
1 材料与方法 1.1 样本选取2007-2013年由上海市(区、县)疾病预防控制中心(CDC)确认后,当年首次随访未接受抗反转录病毒药物治疗的HIV-1感染者冻存血浆。每年标本大约按10%比例抽取,其方法为先将标本按传播途径分类,各个途径又均以每月发现日期排列,统一排序,然后按早到晚,每10份抽取1份,以此类推。结合个案流行病学调查(包括人口学特征、行为学特征等信息),对1296例标本进行亚型分型和耐药监测。
1.2 方法 1.2.1 HIV-1 RNA病毒载量(VL)检测采用COBAS AmpliPrep/COBAS TaqMan HIV-1 Test version 2.0 试剂盒(Taqman实时定量PCR-荧光法,美国Roche公司),使用仪器为Cobas AmpliPrep/Cobas TaqMan 全自动分析系统(美国Roche公司),有效线性检测范围为20~1.0 ×107 HIV RNA cps/ml,<20 HIV RNA cps /ml 为阴性。操作严格按照试剂盒和仪器说明书进行。
取血浆200 μl采用RNA提取试剂盒(QIAcube HT Kit及QIAcube HT Plasticware,德国QIAGEN公司产品),提取病毒RNA,严格按照说明书操作。获得RNA后通过反转录-聚合酶链反应(RT-PCR)和巢式PCR扩增HIV-1 pol区PR和部分RT基因区,所用试剂盒均由宝生物工程(大连)有限公司生产,扩增引物由上海英潍捷基贸易有限公司合成,其引物序列见表1。第一轮反应扩增条件为50 ℃ 30 min,94 ℃ 2 min,反转录酶失活后,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,30个循环,72 ℃再延伸10 min,4 ℃保温。第二轮反应扩增条件为94 ℃ 5 min预变性后,94 ℃ 30 s,63 ℃ 30 s,72 ℃ 150 s,共30个循环,72 ℃ 10 min,4 ℃保温。
| 引物名称 | 引物序列(5′~3′) | 位置(HXB2) | 方向 |
| MAW-26 | TGG AAA TGT GGA AAG GAA GGA C | 2027~2050 | 外侧上游 |
| RT-21 | CTG TAT TTC TGC TAT TAA GTC TTT TGA | 3509~3539 | 外侧下游 |
| PRO-1 | TGG AAA TGT GGA AAG GAA GGA CCA GAG CCA ACA GCC CCA CCA | 2147~2166 | 内侧上游 |
| RT-20 | CTG CCA GTT CTA GCT CTG CTT C | 3441~3462 | 内侧下游 |
用毛细管电泳仪QIAxcel DNA 及QIAxcel DNA Screening Kit扩增,PCR扩增产物片段约1.3 kb。
1.2.4 PCR扩增产物的纯化和DNA测序PCR扩增产物由上海欧易生物技术有限公司纯化并进行双向测序,测序引物为S1(5′-GCC AAC AGC CCC ACC A-3′)、S2(5′-GGA CCT ACA CCT GTC AAC-3′)、S3(5′-CCT AGT ATA AAC AAT GAG ACA C-3′)、S4(5′-GCT GGG TGT GGT ATT CC-3′)和 RT4R(3′-CTT CTG TAT ATC ATT GAC AGT CCA GCT-5′)。
1.2.5 序列分析为鉴定病毒株的亚型,从LosAlamos database HIV数据库中下载各亚型的参考序列(http://www.hiv.lanl.gov/content/index);使用Squencer 4.9 等软件进行序列的排列、比对和编辑,并用Mega 5 软件进行系统树进化分析(BOOTSTRAP大于70%),以确定HIV-1基因亚型。
1.2.6 耐药性分析应用美国斯坦福大学HIV耐药数据库Version 7.0(http://sierra2.stanford.edu/sierra/servlet/JSierra)进行耐药性分析。
1.2.7 统计学分析所有数据均采用SPSS 12.0统计软件建立数据库并进行统计分析。Fisher确切概率法检验,P<0.05表示差异有统计学意义。
2 结果 2.1 人口学和流行病学特征1296份对象血浆样本中HIV-1 RNA VL<1000拷贝/ml 18份,1278份≥1000拷贝/ml。经RT-PCR筛选最终获得1085份样本pol区基因片段,其中男性979例(89.4%),女性106例(10.6%)。年龄分布于17~81岁,以25~39岁的青壮年为主,占总调查人数55.3%,其中本市户籍390例,占35.9%;外省市户籍695例,占64.1%,涉及27个省(市、自治区)。
2.2 HIV-1基因亚型分析 2.2.1 基因亚型分布根据pol区亚型分型结果显示,本研究共发现13种HIV-1基因亚型和重组体;其中CRF01_AE所占比例最大,为651例(60.0%),其次为CRF07_BC 253例(23.3%)、CRF08_BC 52例(4.8%)、B亚型97例(8.9%)、C亚型12例(1.1%)、CRF_01B 10例(0.9%)、F2亚型2例(0.2%)、G亚型2例(0.2%)、CRF02_AG 5例(0.5%)和CRF03_AB 1例(0.2%)。CRF_01B中未定型CRF_01B 4例(40.0%);CRF55_01B 4例(40.0%);CRF58_01B 1例(10.0%)和CRF59_01B 1例(10.0%)。
2.2.2 基因亚型与传播途径1085例HIV感染者中感染途径为男男同性传播596例(54.9%),异性性传播421例(38.8%),注射毒品60例(5.5%),输血/血制品7例(0.6%),采血浆1例(0.1%)。其中异性传播和同性传播以CRF01_AE和CRF07_BC为主,分别为241例(57.2%)、395例(66.3%)和86例(20.4%)、131例(22.0%);注射吸毒者以CRF07_BC为主,共35例(58.3%)。CRF08_BC 36例(69.2%),以异性传播为主;CRF01_B 9例(90.0%),以同性性传播途径为主;C亚型9例(75.0%),以异性传播为主;F2亚型2例和CRF02_AG 5例,均以异性性传播为主,G亚型为异性传播1例和男男同性传播1例;CRF03_AB 1例,为男男同性传播。CRF01_AE、CRF07_BC、CRF08_BC和B亚型分别在异性传播和同性传播之间有统计学差异(Fisher确切概率法,P=0.000),除CRF08_BC以异性传播为高(36/52)外,其余均以同性传播为高,即CRF01_AE、CRF07_BC和B亚型分别为(395/651)、(131/253)和(52/97),见表2。
| 感染途径 | 份数 | CRF01_AE | CRF07_BC | CRF08_BC | B | CRF01_B | C | F2 | G | CRF02_AG | CRF03_AB |
| 异性传播 | 421 | 241 | 86 | 36 | 40 | 1 | 9 | 2 | 1 | 5 | 0 |
| 同性传播 | 596 | 395 | 131 | 7 | 52 | 9 | 0 | 0 | 1 | 0 | 1 |
| 注射吸毒 | 60 | 13 | 35 | 9 | 2 | 0 | 2 | 0 | 0 | 0 | 0 |
| 输血/血制品 | 7 | 2 | 1 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 |
| 采血(浆) | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 合计 | 1085 | 651 | 253 | 52 | 97 | 10 | 12 | 2 | 2 | 5 | 1 |
共12例,耐药率1.2%。对核苷类反转录酶抑制剂(NRTIs)的主要耐药突变有3例,其中1例突变位点为L74LV,可导致去羟肌苷(DDI)高度耐药;1例突变位点为L74IL,可导致阿巴卡韦(ABC)中度耐药和DDI高度耐药;1例突变位点为M184I,可导致拉米夫定(3TC)、恩曲他滨(FTC)高度耐药。对非核苷类反转录酶抑制剂(NNRTIs)的主要耐药突变有9例,其中3例突变位点为P225H,可导致依非韦伦(EFV)、奈韦拉平(NVP)中度耐药;1例突变位点为Y188L,可导致EFV、NVP、利匹韦林(RPV)高度耐药;1例突变位点为K101EK,可导致NVP、RPV中度耐药;1例突变位点为Y181CY,可导致EFV、依曲韦林(ETR)、RPV中度耐药和NVP高度耐药;1例突变位点为K101E,可导致NVP、RPV中度耐药;1例突变位点为G190A,可导致EFV中度耐药和NVP高度耐药;1例突变位点为V106M,可导致EFV、NVP高度耐药。
2.3.2 RT区和PI区同时耐药突变1例,突变位点为L90M、L10I、A71T和Y188L,可导致茚地那韦/利托那韦(IDV/r)、沙奎那韦/利托那韦(SQV/r)中度耐药和奈非那韦(NFV)、EFV、NVP、RPV高度耐药。
2.3.3 IN区耐药突变共2例,耐药率0.2%,其中1例突变位点为Y143H,可导致雷替格韦(RAL)高度耐药;另1例突变位点为R263KR,可导致埃替格韦(EVG)中度耐药。
2.3.4 耐药与亚型关系本研究发现耐药突变共15例,其中CRF01_AE 11例发生耐药突变(1.7%),CRF07_BC 3例发生耐药突变(1.7%);B亚型1例发生耐药突变(1.0%)。见表3。
| 年份 | 耐药基因型检测数 | 耐药人数 | 耐药率(%) |
| 2007 | 70 | 3 | 4.3 |
| 2008 | 99 | 2 | 2.0 |
| 2009 | 99 | 1 | 1.0 |
| 2010 | 140 | 3 | 2.1 |
| 2011 | 158 | 2 | 1.3 |
| 2012 | 240 | 1 | 0.4 |
| 2013 | 278 | 3 | 1.1 |
上海市2007-2013年每年HIV-1感染者耐药情况见表3,上海市HIV-1感染者原发性耐药率从2007年的4.5%下降至2013年的1.1%;呈明显下降趋势,见图1。
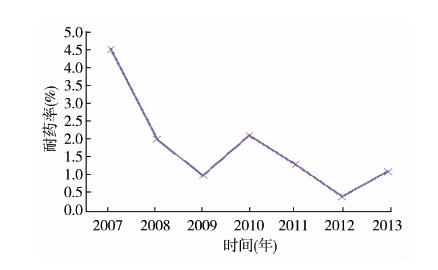
|
| 图 1 2007-2013年上海市HIV-1感染者原发性耐药变化趋势 Fig. 1 Trend of primary drug resistance in HIV-1 infection cases in Shanghai,2007-2013 |
上海作为特大型城市人口流动比较大,增加了HIV传播隐患。这种隐患不仅表现在本地区HIV感染者数量逐年上升,随着传播范围的扩大,耐药 毒株传播率也不断升高。HIV耐药毒株可在人群中传播,使得从未治疗过的患者也产生耐药性,称为原发性耐药。上海市开展免费抗病毒治疗的持续进行也可能增加耐药毒株的流行率。直接感染耐药毒株会影响患者接受HARRT治疗后对药物的敏感程度,并使出现相关耐药概率的增加。新发感染者中出现原发耐药变异是耐药株得以在人群中传播的直接证据。在欧美等发达国家,大约10%以上的新发HIV感染者对至少1种抗病毒药物耐药[5, 6]。
上海市自2004年开始实行免费抗病毒治疗,以TDF(或AZT)+3TC+EFV(或NVP)为一线治疗方案[7]。本研究显示,上海市2007-2013年HIV-1感染者虽未治疗但体内已存在原发耐药病毒株,耐药率为1.2%,耐药率较低,低于文献报道的全球和全国平均水平,也低于国内其他省市的报道,而与上海市以往的报道接近或持平,且呈逐年下降趋势[8, 9, 10, 11, 12, 13, 14, 15]。提示目前所用的一线药物对绝大部分HIV感染者有效。不同亚型的耐药率显示,CRF01_AE最高(1.7%),其次为CRF07_BC(1.2%)和B亚型耐药率(1.0%);上海市户籍HIV感染者耐药率为1.0%(4/390),外来人口耐药率为1.5%(11/695)。按药物类别来看,PI耐药率为0.1%,NNRTI耐药率为0.9%,NRTI耐药率为0.3%。上海市虽未使用FTC、ETR和RPV等药物,但其耐药发生率较高,说明同类药物间存在高度的交叉耐药。同时,一旦病毒产生了耐药性,更换的二线药物对病毒的抑制效果将会减弱,再加上病毒对不同药物的遗传屏障不同,耐药毒株对更换的二线药物的耐药速度将会加快。上海市PI耐药株早在2004年已发现存在,但迄今仍然维持在低水平,说明PI发生耐药的机会相对低下[16]。因此,在一线药物耐药的情况下,PI可作为二线药物使用。本研究发现1例耐药位点变异R263KR可导致埃替格韦(EVG)中度耐药,1例耐药位点变异Y143H可导致雷替格韦(RAL) 高度耐药,均为男男性接触者,两药之间有高水平的交叉耐药[17]。这2种药物在国内尚未上市,应加强对EVG和RAL的耐药监测。
由于不同亚型间的基因差异可能引起不同亚型毒株的耐药突变谱产生差异,特别是会导致耐药进化模式的不同,进而引起针对反转录酶抑制剂和蛋白酶抑制剂的耐药进化模式和耐药突变特征不同,从而使不同亚型HIV-1毒株具备了各自不同的耐药突变特征。目前上海地区HIV-1流行毒株以CRF01_AE为主,占60.0%,而且近年来上升较快。同时耐药基因型分析显示也以CRF01_AE原发耐药毒株为主,占73.3%;其中以男男同性传播为主,占63.6%,耐药情况不容乐观。如果耐药性毒株取代药物敏感株成为优势毒株,携带耐药性毒株的HIV感染者将医治困难,使发病潜伏期缩短造成耐药性毒株的进一步传播,艾滋病疫情将更加难以控制形成恶性循环[18, 19]。因此,加强对CRF01_AE耐药毒株的监测和研究,为抗病毒药物的合理使用,以及制定有效的抗病毒治疗方案、选择挽救性治疗药物提供指导,最大限度减少或延缓耐药性的发生,为HIV-1耐药株的发生与流行提供防制与干预措施。
近年来,在不同亚型HIV-1毒株中将发现更多新的耐药突变位点而被报道,因此评估耐药突变的亚型特异性,特别是掌握不同亚型HIV-1在耐药方面的突变特征,对HAART治疗方案防治策略的制定具有重要的公共卫生意义。
| [1] | Blaise P, Clevenbergh P, Vaira D, et al. HIV resistance to antiretroviral drugs:mechanisms, genotypic and phenotypic resistance testing in clinical practice[J]. Acta Clin Belg,2002,57(4):191-201. |
| [2] | Callant JE, Cerondelis PZ, Wainberg MA, et al. Nucleoside and nucleotide analogue reverse transcriptase inhibitors:a clinical review of antiretroviral resistance[J]. Antivir Ther,2003,8(6):489-506. |
| [3] | Zhang FJ, Au M, Haberer J, et al. Overview of HIV drug resistance and its implications for China[J]. Chin Med J,2006,119(23):1999-2004. |
| [4] | Shang H. The situation of HIV prevalence, testing and treatment in China[J]. Chinese Journal of Laboratory Medicine,2008,31(10):1088-1090. (in Chinese) 尚红.中国艾滋病流行和检测及治疗现状与发展趋势[J]. 中华检验医学杂志,2008,31(10):1088-1090. |
| [5] | Wensing AMJ, Vercauteren J, Vijver DA, et al. Transmission of drug-resistance in Europe is characterized by single mutations and revertants[J]. Antivir Ther,2006,11(5):S1111. |
| [6] | Turner D, Wainberg MA. HIV transmission and primary drug resistance[J]. AIDS Rev,2006,8(1):17-23. |
| [7] | Su YY, Zhang FJ, Liu HX, et al. The prevalence of HIV-1 drug resistance among antiretroviral treatment naive individuals in mainland China:a meta-analysis[J]. PLoS One,2014,9(10):e110652. |
| [8] | National Free AIDS Antiviral Drug Treatment Handbook Compiling Group. National Free Antiretroviral Medicine Treatment Manual[M]. 3rd ed. Beijing:People's Medical Publishing House,2012. (in Chinese) 中国疾病预防控制中心性病艾滋病预防控制中心. 国家免费艾滋病抗病毒药物治疗手册[M]. 3版. 北京:人民卫生出版社,2012. |
| [9] | WHO. WHO HIV drug resistance report 2012[R]. Geneva:WHO,2012. |
| [10] | Zhao K, Kang WZ, Liu QQ, et al. Genotypes and transmitted drug resistance among treatment-naive HIV-1-infected patients in a northwestern province, China:trends from 2003 to 2013[J]. PLoS One,2014,9(10):e109821. |
| [11] | Xue XJ, Xing H, Liu CH, et al. Epidemic strains and drug resistance survey with human immunodeficiency virus type 1(HIV-1) in Henan,2007-2011[J]. Chinese Journal of Preventive Medicine,2012,46(7):659-660. (in Chinese) 薛秀娟,邢辉,刘春华,等. 河南省2007-2011年HIV-l流行株及耐药性调查[J]. 中华预防医学杂志,2012,46(7):659-660. |
| [12] | Ye JR, Guo L, Lu HY, et al. Genotypic resistance mutations to antiretroviral drugs in newly confirmed human immunodeficiency virus inferiors in Beijing[J]. National Medical Journal of China,2011,91(21):1453-1456. (in Chinese) 叶景荣,郭蕾,卢红艳,等.北京市未经抗病毒治疗的HIV感染者耐药突变流行性调查[J]. 中华医学杂志,2011:91(21):1453-1456. |
| [13] | Zhong P, Pan QC, Ning Z, et al. Genetic diversity and drug resistance of human immunodeficiency virus type 1 (HIV-1) strains circulating in Shanghai[J]. AIDS Res Hum Retroviruses,2007,23(7):847-856. |
| [14] | Xue YL, Gong JL, Zheng XH, et al. A cross-sectional study of HIV-1 subtype diversity and drug-resistance in Shanghai residents[J]. Journal of Diagnostics Concepts & Practice,2007,6(3):203-209. (in Chinese) 薛以乐,宫菊丽,郑晓虹,等.上海市常住人口HIV-1感染者基因亚型和耐药性突变横断面研究[J]. 诊断学理论与实践,2007,6(3):203-209. |
| [15] | Liu L, Ma JX, Zheng YF, et al. Surveillance of subtype diversity and drug resistance among naive patients with human immunodeficiency virus type 1 in Shanghai[J]. Journal of Microbes and Infections,2011,6(1):4-10. (in Chinese) 刘莉,马建新,郑毓芳,等. 上海地区人类免疫缺陷病毒1型感染者原发耐药基因及亚型分析[J]. 微生物与感染,2011,6(1):4-10. |
| [16] | Pan QC, Xue YL, Kang LY, et al. Study on the gene type of protease inhibitors in patients with AIDS in Shanghai[J]. Shanghai Journal of Preventive Medicine,2004,16(7):311-313,317. (in Chinese) 潘启超,薛以乐,康来仪,等.上海市艾滋病感染者和病人中蛋白酶抑制剂耐药基因型的研究[J]. 上海预防医学,2004,16(7):311-313,317. |
| [17] | Li JY. HIV-1 drug resistance mutations[J]. Chinese Journal of AIDS & STD,2010,16(2):195-197,200. (in Chinese) 李敬云.HIV-1的耐药基因突变[J]. 中国艾滋病性病,2010,16(2):195-197,200. |
| [18] | Li YJ, Han Y, Xie J, et al. CRF01_AE subtype is associated with X4 tropism and fast HIV progression in Chinese patients infected through sexual transmission[J]. AIDS,2013,28(4):521-530. |
| [19] | Li XS, Xue YL, Zhou LM, et al. Evidence that HIV-1 CRF01_AE is associated with low CD4+T cell count and CXCR4 Co-receptor usage in recently infected young men who have sex with men (MSM) in Shanghai, China[J]. PLoS One,2014,9(2):e89462. |
 2015, Vol. 30
2015, Vol. 30


