扩展功能
文章信息
- 郭丽茹, 李晓燕, 孔梅, 刘英华, 邹明, 苏旭
- GUO Li-ru, LI Xiao-yan, KONG Mei, LIU Ying-hua, ZOU Ming, SU Xu
- 人偏肺病毒F1、F2亚单位原核表达系统的构建及多克隆抗体制备
- Establishemnt of prokaryotic expression system and polyclonal antibodies preparation of F1,F2 subunit gene of human metapneumovirus
- 疾病监测, 2015, 30(11): 964-968
- Disease Surveillance, 2015, 30(11): 964-968
- 10.3784/j.issn.1003-9961.2015.11.017
-
文章历史
- 收稿日期: 2015-06-19
随着人类对疾病认识程度加深和检测手段的更新,越来越多新的病毒被认知。人偏肺病毒(Human metapneumovirus,hMPV)是21世纪新发现病毒之一,由荷兰学者van den Hoogen 等[1]于2001年从患呼吸道感染的婴幼儿标本中分离,并根据基因序列及结构将其划分为副粘病毒科、肺病毒亚科、偏肺病毒属。hMPV流行范围遍布全球,受不同采集时间、判断标准的影响,各地检出率差异较大,尚未发现明确的地理分布相关性。hMPV可感染各年龄组人群,儿童尤其易感,哥伦比亚一项近10年的研究显示,75%的感染者为≤5岁的患儿,5~10岁儿童几乎100%具有既往感染史[2, 3]。hMPV可引发各种呼吸道症状,从轻微的发热、咳嗽、气促到毛细支气管炎和肺炎[4],严重程度与呼吸道合胞病毒类似而重于腺病毒、鼻病毒等其他呼吸道病毒[5]。hMPV感染近几年在国内多有报道,但由于此病毒分离困难,获得的毒株非常有限,疫苗研究进展缓慢。
融合蛋白(Fusion Protein,F)是hMPV表面的一种糖蛋白,介导病毒与细胞的融合,在病毒的感染和免疫中起着重要的作用,是目前研究所知可刺激机体产生保护性抗体的重要抗原之一[6],且在不同型别间同源性较高,所以成为表位疫苗研究的热点。本研究采用原核表达的方式,针对F蛋白具有生物学活性亚单位F1、F2分别制备重组蛋白,并以此免疫小鼠初步获得了抗F1、抗F2多克隆抗体,为F蛋白免疫机制的研究奠定基础。
1 材料与方法 1.1 质粒、菌株及主要试剂含有hMPV标准株NL/1/99(GenBank: AY525843.1)全基因的克隆质粒由荷兰鹿特丹大学医学中心的Eric Claassen教授馈赠。pET32a(+)原核表达载体、表达菌株BL21(DE3)、Vero-E6细胞及hMPV毒株为笔者实验室保存。各种限制性内切酶、Taq DNA 聚合酶、T-4 DNA 连接酶以及pMD19-T 载体试剂盒均为TaKaRa 公司产品。质粒抽提与切胶纯化试剂盒购自 QIAGEN公司。异丙基-β-D-硫代半乳糖苷(IPTG) 购自Sigma 公司,His标签蛋白包涵体纯化试剂盒为康为世纪公司产品,抗His标签鼠单克隆抗体、辣根过氧化物酶(HRP)标记的羊抗鼠IgG抗体、预染蛋白Marker Ⅲ(MP204)均为天根公司产品,QuickAntibody-Mouse2W佐剂购自北京博奥龙免疫技术有限公司。抗hMPV单克隆抗体购自美国Chemicon,FITC标记的羊抗鼠IgG购自北京中杉金桥生物公司。
1.2 引物设计及PCR扩增以GenBank 中NL/1/99 F蛋白基因序列为模板分2个片段设计引物,所用设计软件为primer 5.0,两端分别加入BamH Ⅰ 和 HindⅢ 酶切位点(引物中下划线部分),酶切位点前各加入3个保护性碱基。引物由上海英俊公司合成,序列分别为:NL/1/99-F1-F 5′-CCG GGA TCC TTT GTG AGC AAA AAC CTG-3′,NL/1/99-F1-R 5′-CCG AAG CTT CTG ATC CTC AGG AAA CTT-3′;NL/1/99-F2-F 5′-CCG GGA TCC AAG GAG AGT TAT TTG GAA G-3′,NL/1/99-F2-R 5′-CCG AAG CTT TCT TGA TTG TCT GGG-3′。用以上引物以NL/1/99全基因组质粒为模板,分别扩增F1及F2基因片段,预期产物大小F1为864 bp,F2为249 bp。
1.3 pET32a-F1及pET32a-F2重组质粒的构建扩增产物经1.5%琼脂糖凝胶电泳后切胶回收,用QIAquick Gel Extration Kit Protocal纯化后与pMD19-T载体连接,方法参照pMD19-T Vector试剂盒进行,克隆序列送上海英俊公司测序,结果与GenBank 中F1、F2序列进行比对。
将测序正确的T-A克隆质粒进行BamHⅠ 和HindⅢ双酶切,与同样双酶切后的原核表达载体pET32a(+)按3∶1摩尔比的量用T-4 DNA 连接酶于16 ℃过夜连接。连接产物转化新鲜制备的BL21(DE3)感受态细胞,同时转化未连接F1或F2的pET32a(+)质粒作为对照,经10%氨苄西林(Amp)筛选,挑取阳性克隆提取质粒再行双酶切及测序鉴定。
1.4 重组质粒表达体系的优化及表达形式的分析挑取鉴定正确的单克隆接种于LB 液体培养基(含10% Amp),37 ℃过夜培养,按1∶100转入20 ml LB 液体培养基,37 ℃ 200 r/min 培养至A600在 0.6~ 0.8 时,取部分菌液为未加诱导剂的阴性对照,余下的菌液中加入终浓度为0.5 mmol/L的IPTG,分2组采用不同温度进行诱导表达,一组诱导条件为37 ℃,另一组则置于30 ℃,200 r/min振荡培养5 h,每隔1 h收获部分菌液。将各时段菌液以 5 000×g 4 ℃离心15 min,收集菌体沉淀,冰浴超声破菌,输出能量为20%,5 s/次,每次间隔5 s,重复至菌液达到半透明状态。14 000×g离心15 min,分别收集上清和沉淀,SDS-PAGE电泳鉴定。
1.5 重组蛋白的纯化取阳性克隆菌液以1∶100的体积比扩大培养,采用优化后的条件进行大量表达,用康为世纪包涵体试剂盒处理菌体沉淀,收获重组蛋白。采用GE公司1 ml镍亲和层析柱,参考康为世纪His标签蛋白包涵体纯化试剂盒的方法对目标蛋白进行纯化。
将目的蛋白洗脱峰部分的蛋白洗脱液合管,放入透析袋(截留分子质量15 kD),加入0.01 mmol/L的PBS(pH 7.5),放入磁力搅拌器,4 ℃层析柜中透析17 h,换液2次。收集蛋白溶液行SDS-PAGE并用Bradford法测定蛋白浓度。
1.6 Western Blot法鉴定纯化蛋白特异性取纯化后蛋白的SDS-PAGE凝胶,在15 V恒压下经17 min转移至硝酸纤维素膜,5%脱脂奶封闭,4 ℃过夜。转天加入1∶500稀释的鼠抗His标签单克隆抗体,室温孵育2 h,清洗后加入1∶300稀释的辣根过氧化物酶(HRP)标记的羊抗鼠IgG抗体,室温下孵育2 h后用康为世纪公司的增强型HRP底物显色剂进行DAB显色。
1.7 重组蛋白多克隆抗体制备及效价测定取纯化后的重组蛋白经Bradford法测定各蛋白浓度,按20 μg/ml 分装保存。取雌性5周龄BALB/c小鼠6只,F1与F2组各3支,采用新型佐剂Quick Antibody-Mouse2W按1∶1体积比分别与F1、F2重组蛋白混匀,以20 μg/支对小鼠进行后小腿肌肉注射免疫,14 d后采微量尾血进行酶联免疫吸附试验(ELISA)测定。
使用包被缓冲液将纯化的F1、F2重组蛋白分别稀释至2 μg/ml,每孔加100 μl于96孔反应板,4 ℃过夜,次日洗涤液洗5次,加入含10%胎牛血清的PBST 室温封闭2 h,分别将F1、F2重组蛋白免疫小鼠获得的血清按1∶40,1∶160,1∶640,1∶2560,1∶10 240,1∶40 960稀释,各取100 μl/每孔加入到重组蛋白包被的孔中,每个稀释度平行做3孔,取1∶40稀释的免疫前小鼠血清作为阴性对照,0.01 mol/l PBS作空白对照,37 ℃孵育1 h,洗板后加入1∶1000稀释的HRP标记的羊抗鼠IgG,37 ℃孵育30 min,HRP底物显色液进行显色,5 min后加终止液,酶标仪检测,以空白对照孔调零后测各孔A450/630值,当结果大于阴性对照A值的2.1倍,即P/N>2.1判为阳性。
1.8 间接免疫荧光法检测重组蛋白多克隆抗体特异性按1%比例接种hMPV毒株到Vero-E6细胞,37℃ 5% CO2条件下培养至出现细胞病变。收获hMPV感染的Vero-E6细胞制备抗原片,分别取最高效价的F1、F2重组蛋白免疫血清,1∶40稀释后滴加到抗原片孔中,分别以免疫前小鼠血清及抗hMPV抗体为阴性和阳性对照。37 ℃湿盒内反应30 min,PBS洗3次,干燥后滴加1∶50稀释的FITC-羊抗鼠IgG,37 ℃湿盒内再反应30 min,PBS清洗后加10%甘油封片镜检。
2 结果 2.1 重组质粒的鉴定重组质粒经BamHⅠ和HindⅢ酶切,除pET载体片段,pET32a-F1可见约864 bp清晰条带,pET32a-F2获得一条约249 bp的目的片段(图1),片段大小与预期插入片段大小相符,表明F1、F2基因片段已成功插入pET32a(+)载体。测序结果表明,F1、F2蛋白基因插入位置和读码框都正确无误。
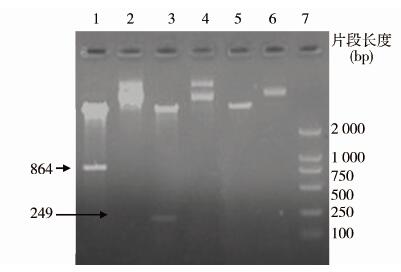
|
| 注:1. pET32a-F1酶切产物; 2. pET32a-F1重组质粒; 3. pET32a-F2酶切产物; 4. pET32a-F2重组质粒; 5. pET32a(+)酶切产物; 6. pET32a(+)空质粒; 7. DNA Marker DL2000。 图 1 pET32a-F1、pET32a-F2酶切电泳结果 Fig. 1 Enzyme digestion electrophoretogram of pET32a-F1 and pET32a-F2 |
SDS-PAGE电泳结果表明,F1、F2与pET32a(+)的重组质粒能够较好的表达,pET32a-F1在50 kD附近、pET32a-F2在30 kD附近出现一条新的蛋白条带,与F1(50.81 kD)、F2(28.59 kD)重组蛋白预测大小基本吻合。
同时经IPTG诱导表达5 h,pET32a-F1、pET32a-F2均在37 ℃表达产量更高(图2)。在同为37 ℃诱导条件下,一定时间范围内,pET32a-F1、pET32a-F2表达产量随时间延长而增多,但诱导5 h后表达产量不再明显增多(图3),故本实验大量表达时取诱导5 h的蛋白进行后续试验。
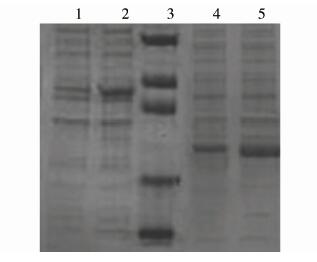
|
| 注:1. pET32a-F1经30 ℃诱导表达产物; 2. pET32a-F1经37 ℃诱导表达产物; 3. 蛋白分子质量标准,从上向下依次为94 kD,60 kD,45 kD,27 kD,18 kD; 4. pET32a-F2经30 ℃诱导表达产物; 5. pET32a-F2经37 ℃诱导表达产物。 图 2 重组质粒经不同温度诱导表达产物电泳结果 Fig. 2 Electrophoretogram of expressed recombinants induced for different times |
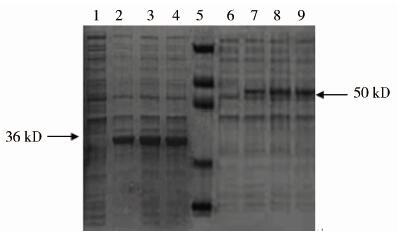
|
| 注:1. pET32a-F2未诱导; 2-4. pET32a-F2分别诱导3、4、5 h表达产物; 5. 蛋白分子质量标准,从上向下依次为94 kD,60 kD,45 kD,27 kD,18 kD ; 6. pET32a-F1未诱导; 7-9. pET32a-F1分别诱导3、4、5 h表达产物。 图 3 重组质粒经不同时间诱导表达产物电泳结果 Fig. 3 Electrophoretogram of expressed recombinants induced for different times |
重组质粒经超声破菌及SDS-PAGE鉴定后发现,F1、F2重组蛋白大部分以包涵体的形式存在,经包涵体试剂盒处理后,大部分杂蛋白以可溶的形式存在于裂解液上清中,菌体沉淀中的主要成分为目的重组蛋白,见图4。
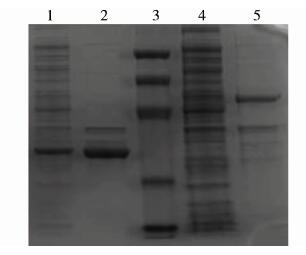
|
| 注:1. pET32a-F2经IPTG诱导表达的上清; 2. pET32a-F2经IPTG诱导表达的沉淀; 3. 蛋白分子质量标准,从上向下依次为94 kD,60 kD,45 kD,27 kD,18 kD; 4. pET32a-F1经IPTG诱导表达的上清; 5. pET32a-F1经IPTG诱导表达的沉淀。 图 4 重组蛋白表达产物可溶性鉴定 Fig. 4 Detections of dissolubility of expressed recombinants |
由于目前尚没有商品化的F蛋白单克隆抗体,故用鼠抗His标签的单克隆抗体对本研究中连接了His标签的重组蛋白进行Western Blot检测,结果显示带His标签的重组F1、F2蛋白分别在50 kD和30 kD左右出现染色条带,与SDS-PAGE条带大小吻合,说明重组蛋白可被抗His标签的单克隆抗体特异性识别,见图5。
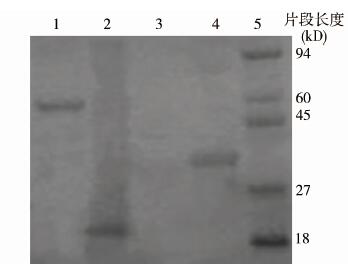
|
| 注:1. pET32a-F1 IPTG诱导表达产物; 2. pET32a空质粒IPTG诱导表达产物; 3. pET32a空质粒未诱导; 4. pET32a未诱导; 5. 预染蛋白Marker。 图 5 重组蛋白Western Blot结果 Fig. 5 Detections of expressed recombinants with Western Blot |
经Bradford法测定,pET32a-F1重组蛋白的纯化产物浓度为200 μg/ml,pET32a-F2重组蛋白纯化后蛋白浓度为300 μg/ml。用纯化的重组蛋白免疫BALB/c小鼠初步制备了鼠抗F1重组蛋白和鼠抗F2重组蛋白血清,经间接ELISA方法检测,3只小鼠抗pET32a-F1血清效价分别为1∶640、1∶320、1∶640,抗pET32a-F2血清效价分别为1∶40 960、1∶10 240、1∶10 240。分别取效价最高的免疫小鼠血清与hMPV病毒感染的Vero-E6细胞进行间接免疫荧光检测,结果显示,以F1重组蛋白和F2重组蛋白免疫血清作为一抗的抗原片上均可见特异性荧光颗粒,而未经重组蛋白免疫的小鼠血清(免前血清)则IFA呈现阴性反应,见图6。
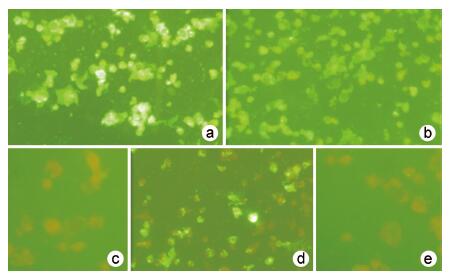
|
| 注:a. pET32a-F1免疫小鼠血清; b. pET32a-F2免疫小鼠血清; c. 抗hMPV抗体; d. pET32a-F1免前小鼠血清; e. pET32a-F2免前小鼠血清。 图 6 多克隆抗体的间接免疫荧光反应(400×) Fig. 6 IFA for specific identification of polyclonal antibodies of mice (400×) |
大量研究提示,hMPV已成为除流感和呼吸道合胞病毒外导致儿童急性呼吸道感染的重要病原,其致病和免疫机制的研究不可懈怠[7, 8]。hMPV是单负链非节段性RNA病毒,基因组共编码9个蛋白,依次为3′-N-P-M-F-M2-SH-G-L-5′,其中F蛋白是公认的可以保护机体免受病毒攻击的有效抗原之一,且相比别的蛋白遗传性更稳定,在不同基因型hMPV中变异极小,同源性高达95%,很有可能成为不同型别间交叉免疫的关键因素[9]。
F蛋白结构特殊,其前体蛋白并无生物学活性,需经宿主细胞蛋白酶作用裂解成亚单位F1和F2后才发挥其融合作用[10]。为了更好地模拟F蛋白在体内作用方式,笔者将其从裂解位点(RQSR)处分成两个片段[11],去除氨基酸信号肽序列和位于羧基端的锚定区,分F2(58-306)和F1(502-1365)两个亚单位来构建重组质粒。另外,hMPV F蛋白B细胞表位预测显示,15-28、88-102、163-188、195-202、206-213、245-257、290-299、302-309、318-334、410-419、515-526区段显示多种预测方法基本一致,有较好的亲水性、可及性和较高的抗原性指数,并且在二级结构上含有易形成抗原表位的转角和不规则卷曲结构,因此这些区域最有可能成为B细胞表位[12]。去除两端疏水区域后,笔者选取的F2和F1片段基本囊括了以上绝大多数的预判B细胞表位,重组蛋白免疫动物所制备的多克隆抗体可以满足以上大多表位的研究需求,并尽可能多地保留了F蛋白上具备潜在抗原表位条件的区域,为后续F蛋白抗原位点的研究提供有力支持。
本研究结果表明,F2和F1亚单位均可在pET-32a(+)原核表达系统中得到高效表达。由于目前很少有商品化的针对F蛋白的高效价免疫血清,构建、表达F1与F2的重组质粒,正是为了试图用纯化后的重组蛋白免疫小鼠获得可与F蛋白特异反应的抗血清。原核表达系统虽然缺乏蛋白翻译后的加工修饰功能,难以体现空间构象,但操作简单、周期短、产量高,并且可满足引发免疫反应的需求。本研究显示,经pET-32a(+)原核系统表达的重组蛋白免疫小鼠后,可获得效价较高的多克隆抗体,并可与感染了hMPV的Vero-E6细胞可发生特异的免疫荧光反应,说明它可特异识别hMPV,具有良好的抗原性和特异性。
本研究同时将hMPV融合蛋白的F1和F2亚单位进行了重组表达,避开F蛋白全长不好表达的困扰,同时尽可能多地覆盖了潜在的抗原位点,得到了纯度较高的pET32a-F1、pET32a-F2融合表达蛋白,并免疫小鼠收获了高效价的鼠抗F1和鼠抗F2多克隆抗体,为F蛋白免疫保护机制的研究及表位疫苗的研发奠定基础。
| [1] | van den Hoogen BG, Bestebroer TM, Osterhaus ADME, et al. Analysis of the genomic sequence of a human metapneumovirus[J]. Virology,2002,295(1):119-132. |
| [2] | AL Turab M, Chehadeh W, AL Nakib W. Phylogenetic analysis of human metapneumovirus detected in hospitalized patients in Kuwait during the years 2009-2011[J]. J Infect Public Health,2015,8(5):448-457. |
| [3] | Barbosa RJ, Pulido DP, Rey BG, et al. Human respiratory syncytial virus and metapneumovirus in patients with acute respiratory infection in Colombia,2000-2011[J]. Rev Panam Salud Publica,2014,36(2):101-109. |
| [4] | Fairchok MP, Martin ET, Chambers S, et al. Epidemiology of viral respiratory tract infections in a prospective cohort of infants and toddlers attending daycare[J]. J Clin Virol,2010,49(1):16-20. |
| [5] | Wang Y, Ji W, Chen Z, et al. Comparison of severe pneumonia caused by Human metapneumovirus and respiratory syncytial virus in hospitalized children[J]. Indian J Pathol Microbiol,2014,57(3):413-417. |
| [6] | Chang A, Masante C, Buchholz UJ, et al. Human metapneumovirus (HMPV) binding and infection are mediated by interactions between the HMPV fusion protein and heparan sulfate[J]. J Virol,2012,86(6):3230-3243. |
| [7] | Wang Y, Ji W, Hao CH, et al. Comparison of bronchiolitis of human metapneumovirus and human respiratory syncytial virus[J]. Acta Virol,2015,59(1):98-100. |
| [8] | Sun QF, Yan YD, Chen ZR, et al. Etiology of different lower respiratory tract infections in hospitalized children[J]. Chinese Journal of Practical Pediatrics,2014,29(3):214-217. (in Chinese),孙秋凤,严永东,陈正荣,等.下呼吸道感染性疾病7794例病原分布研究[J]. 中国实用儿科杂志,2014,29(3):214-217. |
| [9] | Yang CF, Wang CK, Tollefson SJ, et al. Genetic diversity and evolution of human metapneumovirus fusion protein over twenty years[J]. Virol J,2009,6:138. |
| [10] | Wei YW, Zhang Y, Cai H, et al. Roles of the putative integrin-binding motif of the human metapneumovirus fusion (F) protein in cell-cell fusion, viral infectivity, and pathogenesis[J]. J Virol,2014,88(8):4338-4352. |
| [11] | Zhu RN, Qian Y, Deng J, et al. Sequence analysis of the F genes from human metapneumovirus recently isolated from children in Beijing[J]. Chinese Journal of Microbiology and Immunology,2005,25(10):837-841. (in Chinese),朱汝南,钱渊,邓洁,等. 北京地区人偏肺病毒融合蛋白F编码基因的序列分析[J]. 中华微生物学和免疫学杂志,2005,25(10):837-841. |
| [12] | Mao HW, Zhao XD. Prediction of the B cell epitopes of human metapneumovirus fusion protein[J]. Immunological Journal,2006,22(3):289-293. (in Chinese),毛华伟,赵晓东.人类偏肺病毒F蛋白的B细胞表位预测[J].免疫学杂志,2006,22(3):289-293. |
 2015, Vol. 30
2015, Vol. 30


