扩展功能
文章信息
- 王维刚, 赵宏群, 阚飙, 高鹤
- WANG Wei-gang, Li Jie, ZHAO Hong-qun, KAN Biao
- 副溶血弧菌在乳鼠肠道内竞争性定殖实验方法的建立及应用
- Establishment and application of assays for evaluating competitive colonization of Vibrio parahaemolyticus in infant mouse intestinal track
- 疾病监测, 2015, 30(12): 1050-1055
- Disease Surveillance, 2015, 30(12): 1050-1055
- 10.3784/j.issn.1003-9961.2015.12.015
-
文章历史
- 收稿日期: 2015-10-15
2. 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室, 北京 102206
2. State Key Laboratory of Communicable Disease Prevention and Control, Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
副溶血弧菌(vibrio parahaemolyticus,VP)是一种重要的食源性致病菌,广泛存在于浅海海水以及海产品中。当人们食用被副溶血弧菌污染的海产品时,就可能引起急性胃肠炎[1]。根据O抗原和K抗原血清型分类,副溶血弧菌可产生76种血清型。其中O3∶K6及其变异血清型是1950年之后世界各地分离到最多见的血清型,可称之为“大流行菌群”[2, 3]。副溶血弧菌含有多种毒力因子,如溶血素、Ⅲ型分泌系统、荚膜多糖、尿素酶、蛋白酶、黏附因子和侵袭因子等,它们均与其致病性密切相关[4, 5]。体内定殖是病原菌感染宿主的首要条件,这一过程受到多种因素的影响。但是至今为止,副溶血弧菌在人体肠道内的定殖机制还不明确[6]。
乳鼠肠道竞争性定殖实验是评价病原菌肠道定殖能力的一种重要方法,在霍乱弧菌的相关研究中得到了广泛应用[7]。在本研究中,我们首先构建能够表达β-半乳糖苷酶的副溶血弧菌临床分离株RIMD2210633(WT)的lcaZ菌株(WT-lacZ),比较WT菌株与WT-lacZ菌株以及WT-lacZ菌株与环境分离株VP1907菌株在CD-1乳鼠(5日龄)肠道定殖能力的差别,旨在建立评价副溶血弧菌肠道定殖能力的乳鼠模型,为研究副溶血弧菌的致病机制奠定基础。
1 材料与方法 1.1 菌株、质粒和培养条件本研究所需的菌株和质粒见表 1。霍乱弧菌和大肠埃希菌用LB肉汤(1%胰蛋白胨、0.5%酵母提取物、0.5%NaCl,调节pH至7.4)及LBA平板(LB肉汤中加入1.5%琼脂),37 ℃培养;副溶血弧菌的培养基中NaCl含量为3%;10%蔗糖LBA平板(1%胰蛋白胨、0.5%酵母提取物、3%NaCl、10%蔗糖)用于VP菌的WT-lacZ菌株筛选。本研究中如无特殊表明,所使用抗生素浓度为:氨苄西林(AMP)100 μg/ml,氯霉素(CM)20 μg/ml(大肠埃希菌)和5 μg/ml(VP菌)。X-gal终浓度为40 μg/ml。
| 菌株及质粒 | 特征 | 来源 |
| 菌株 | ||
| 副溶血弧菌 | ||
| WT | RIMD2210633,O3∶K6 临床分离株、KP+、TDH+、T3SS1+、T3SS2α+、T3SS2 β-、 trh-,Amp r | 本室保存 |
| WT- lacZ | RIMD2210633∶∶ lacZ; Ampr | 本次构建 |
| VP1907 | O3∶K6 环境分离株、KP-、TDH-、T3SS1+、T3SS2α-、T3SS2β-、 trh- | 本室保存 |
| 大肠埃希菌 | ||
| JM109 | recA1 supE44 endA1 hsdR17 gyrA96 relA1 thi △( lac-proAB) F′[ traD36 proAB+lacIq lacZ△M15] | 本室保存 |
| SM10 λpir | thi thr leu tonA lacY supE recA∶∶ RP4-2-Tc∶∶Mu Kmr∶∶λpir | 本室保存 |
| 霍乱弧菌 | ||
| N16961 | El Tor biotype, ctxA +B +,tcpA + | 本室保存 |
| 质粒 | ||
| pJET1.2 | 克隆载体 | 购买 |
| pJET-vpAD | VP2403AD 产物 | 本次构建 |
| pJET-vp lacZ | V.cholerae lacZ 插入至pJET-vpAD 质粒的VP2403 AB和VP2403 CD片段间 | 本次构建 |
| pDS132 | 自杀质粒, sacB, Cmr | 本室保存 |
| pDS132-vp lacZ | vp lacZ插入pDS132质粒中 | 本次构建 |
实验所用dNTPs、ExTaq、Pfu酶、DNA分子质量标准为TaKaRa公司产品;细菌基因组DNA提取试剂盒、PCR产物纯化试剂盒、PCR产物琼脂糖凝胶回收试剂盒、质粒提取试剂盒为QIAGEN公司产品;CloneJET PCR Cloning Kit为Thermo scientific-fermentas品牌;限制性内切酶、T4 DNA连接酶购自NEB公司;一次性注射器(配针规格0.35×16)及灌胃管(No:8217372)均为BD公司产品;组织匀浆机为IKA公司产品;电泳仪、凝胶成像仪等为Bio-Rad公司产品。
1.3 WT-lacZ菌株构建 1.3.1 pJET-vpAD质粒构建以副溶血弧菌RIMD2210633基因组DNA作为模板,引物对分别为VP2403-A/VP2403-B和VP2403-C/VP2403-D进行PCR反应,引物序列见表 2。PCR反应体系如下:模板15 ng,Pfu酶1 U,ExTaq酶2 U,上下游引物各0.2 μmol/L,加无菌去离子水至50 μl。扩增程序为:94 ℃ 5 min,94 ℃ 40 s,56 ℃ 50 s,72 ℃ 50 s,30个循环,72 ℃ 5 min。用试剂盒从琼脂糖凝胶中纯化回收PCR产物。
| 引物名称 | 序列(5′~3′) | 限制酶 |
| VP2403-A | GCG TCT AGA CTC TGT ACG CGT GAT GCA GT | XbaI |
| VP2403-B | ATC ACA CCA TTC CCA AAC GT G GAT CCG GTA CCG AAT TCC GAA CCG AGT TGA TGT TGT G | BamHI-KpnI-EcoRI |
| VP2403-C | CAC AAC ATC AAC TCG GTT CGG AAT TCG GTA CCG GAT CCA CGT TTG GGA ATG GTG TGA T | EcoRI-KpnI-BamHI |
| VP2403-D | GCG GAG CTC GGC TTT CTT CAA GCA CCA AG | SacI |
| VClacZ-F | GCG GAA TTC TGA TCT GAA GTC ATC CGT AAT CA | EcoRI |
| VClacZ-R | GCG GGA TCC TTA TTG TGG GGA TGA CGC TT | BamHI |
| pDS132-F | GTT TCT GTT GCA TGG GCA TAA AG | - |
| pDS132-R | AAC AAG CCA GGG ATG TAA CG | - |
| 注:加粗标记的碱基为保护性碱基,横线标记的碱基为限制酶识别序列。 | ||
纯化后的片段VP2403-AB和VP2403-CD等比例混合,将混合DNA片段作为模板进行融合PCR,引物对为VP2403-A/VP2403-D。PCR体系和扩增程序及纯化方法同上,并测定浓度。最终得到的VPAD片段中插入了限制酶EcoRI-KpnI-BamHI的识别序列。
将得到的VPAD片段与克隆载体pJET1.2质粒连接,构建pJET-vpAD质粒转入JM109宿主菌中,具体操作见试剂盒说明书。
1.3.2 pJET-vplacZ质粒构建以霍乱弧菌N16961基因组DNA为模板,引物对为VClacZ-F/VClacZ-R进行PCR反应并用试剂盒纯化回收。以EcoRI和BamHI对VClacZ片段和pJET-vpAD质粒进行双酶切,将酶切后的质粒和片段按适当的比例混合,加入T4连接酶在4 ℃连接过夜,再将连接产物热激法转化到JM109感受态细胞中,转化产物在37 ℃,200 r/min活化1 h后,取100 μl涂布于含有X-gal的LBA平板(Ampr)上,37 ℃培养至出现单菌落。筛选出的蓝色克隆即为带有pJET-vplacZ质粒的目的菌株。
1.3.3 pDS132-vplacZ质粒构建以限制酶XbaI和SacI对pJET-vplacZ质粒进行双酶切,将切胶回收的DNA片段vplacZ与质粒pDS132混合,加入T4连接酶在4 ℃连接过夜,再将连接产物热激法转化到SM10 λpir感受态细胞中,转化产物在37 ℃,200 r/min活化1 h后,取100 μl 涂布于含有X-gal的LBA平板(Cmr)上,37 ℃培养至出现单菌落。筛选出的蓝色克隆即为带有pDS132-vplacZ质粒的目的菌株。
1.3.4 WT-lacZ菌株的筛选将带有pDS132-vplacZ质粒的SM10 λpir作为供体菌、副溶血弧菌RIMD2210633作为受体菌分别接种在LB肉汤中,37 ℃,200 r/min培养至A600 nm约0.8。随后6000 r/min离心2 min收集菌体,用100 μl LB肉汤将两菌混合悬浮。取0.45 μm微孔滤膜将其紧贴在LB平板上,在滤膜上点加100 μl混合菌液。待菌液被滤膜充分吸收后,37 ℃倒置培养6 h。之后用1 ml生理盐水洗涤滤膜,洗下的菌稀释至适当的比例,悬液涂布在含有X-gal的LBA平板(Ampr,Cmr)上,37 ℃培养至长出单克隆菌落[8]。
挑取在平板上显蓝色的VP菌接种于LB肉汤中,37 ℃,200 r/min培养至对数中期,将菌液稀释1000倍后取100 μl涂布于含X-gal的10%蔗糖LBA平板上,22 ℃培养至出现单菌落。挑取显蓝色的单克隆菌即为WT-lacZ菌株。
1.4 生长曲线测定将副溶血弧菌WT、WT-lacZ以及环境分离株VP1907接种于含3%NaCl的LB培养基中,37 ℃、200 r/min培养至A600 nm约1.0。将菌液进行1/100稀释,转接入25 ml新鲜含3%NaCl的LB培养基中继续培养,每隔1h测定各菌株的A600 nm值。实验重复3次。
1.5 体内竞争性定殖实验将过夜培养的对照菌株(WT-lacZ)和实验菌株(WT、VP1907)1/50倍稀释,转接入5 ml新鲜含3%NaCl的LB培养基中,37 ℃、200 r/min继续培养至A600 nm 1.0;用灭菌生理盐水将菌液稀释1000倍后,将对照菌及相应实验菌株按1∶1比例混合均匀制备接种液;将接种液梯度稀释至10-5,将10-2、10-3、10-4、10-5梯度稀释的菌液各取100 μl分别涂布于含有X-gal的3%NaCl LB平板(Ampr)上,37 ℃过夜培养后对菌落蓝白斑计数,计算白蓝斑比例即为input比值(实验菌株/对照菌株)。尽量确保接种液中对照菌株和实验菌株比例为1∶1,菌量为106CFU。
每组实验选取5日龄的清洁级CD-1乳鼠各5只,接种前乳鼠与母鼠提前分离2 h以上,用1 ml注射器吸取100 μl预先混合好的接种液,将注射器针头插入灌胃管中,抓取乳鼠,使其头与身体尽量竖直成一条直线,沿嘴边深入导管,尽量使导管贴上颚壁,将导管深入胃内并灌入菌液;将灌胃后的乳鼠放置盒中,30 ℃感染20 h后,用乙醚处死乳鼠,解剖取出小肠置于2 ml的生理盐水中,用组织分散机破碎小肠,使其在肠道内定殖的细菌充分释放;将匀浆液依次稀释至10-5,将10-2、10-3、10-4、10-5梯度稀释的菌液各取100 μl分别涂布于含有X-gal的3%NaCl LB平板(Amp r)上,37 ℃过夜培养后对蓝白斑菌落计数,所得白蓝斑比值即为output比值(实验菌株/对照菌株)。根据下列公式计算竞争系数(competitive index,CI):CI=output比值/input比值[9]。实验重复3次。
1.6 统计学分析所得数据结果用平均数±标准差表示;采用t检验比较实验组间的差异性,P < 0.05表示差异具有统计学意义。
2 结果 2.1 WT-lacZ菌株构建为了建立副溶血弧菌体内竞争性定殖的乳鼠模型,构建能够表达β-半乳糖苷酶从而在X-gal平板上显蓝色的WT-lacZ菌株是本研究的关键。引物对VP2403-A/VP2403-B和VP2403-C/VP2403-D分别扩增出带有相应限制酶识别序列的上游同源臂AB (大小为630 bp)和下游同源臂CD(大小为573 bp);再通过融合PCR方法,以上下游同源臂为模板,引物对VP2403-A/VP2403-D扩增得到融合片段vpAD。vpAD片段中插入了限制酶EcoRI-KpnI-BamHI的识别序列。1%琼脂糖电泳结果如图 1B所示,PCR产物大小与理论值相符。将得到的vpAD片段与克隆载体pJET1.2质粒连接并转入JM109宿主菌中。以霍乱弧菌N16961基因组DNA为模板,引物对为VClacZ-F/VClacZ-R扩增带有启动子区的lacZ基因片段(大小为3472 bp),得到的VClacZ片段两端带有限制酶EcoRI和BamHI的识别序列。1%琼脂糖电泳结果如图 1C所示,PCR产物大小与理论值相符。
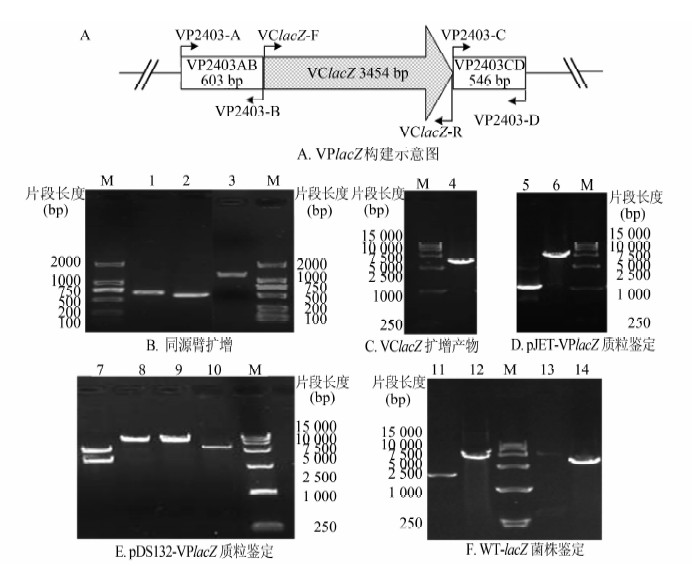
|
| 图 1 WT-lacZ菌株PCR鉴定的琼脂糖凝胶电泳结果 Figure 1 PCR identification for WT-lacZ strain 注:M:分子质量片段标准;泳道1:上游同源臂AB;泳道2:下游同源臂 CD;泳道3:融合片段 AD;泳道4:VClacZ片段;泳道5~6:引物对VP2403-A/VP2403-D,模板分别为pJET-VPAD质粒和pJET-VPlacZ质粒;泳道7:双酶切的pDS132-VPlacZ质粒有pDS132和VPlacZ 2个片段;泳道8~9 :未酶切的pDS132-VPlacZ质粒作为对照;泳道10:双酶切的空载体pDS132作为对照;泳道11~12:引物对VP2403-A/VP2403-D,模板分别为WT和WT-lacZ;泳道13~14:引物对VClacZ-F/VClacZ-R,模板分别为WT和WT-lacZ。 |
将pJET-vpAD质粒和VClacZ片段用限制酶EcoRI和BamHI进行双酶切和T4连接酶连接后转化至JM109菌株中,用含有X-gal且带氨苄西林抗性的LBA平板筛选蓝色克隆,用引物对VP2403-A/VP2403-D对得到的克隆进行PCR验证,1%琼脂糖电泳结果见图 1D。结果表明阳性克隆和空载体所得的产物片段大小相差约3500 bp。这表明已将VClacZ片段插入到副溶血弧菌RIMD2210633的β-D-半乳糖苷酶α亚基基因(VP2403)的DNA片段间,成功构建了带有pJET-vplacZ质粒的菌株。
将pDS132-vplacZ质粒和pDS132质粒用限制酶XbaI和SacI进行双酶切后克隆转化至SM10 λpir菌株中,用氯霉素抗性并含X-gal的平板筛选显蓝色的克隆,用位于限制酶XbaI和SacI进行双酶切鉴定阳性克隆,鉴定结果见图 1E。结果表明酶切后,阳性克隆有两条带,其中一条和空载体(pDS132)大小之间相同,另外一条带在将近4700 bp左右处,即成功构建了带有pDS132-vplacZ质粒的SM10 λpir菌株。
通过接合转移将供体菌SM10 λpir的pDS132-vplacZ质粒转移至受体菌副溶血弧菌RIMD2210633菌株中,并利用蔗糖筛选的方法得到在含X-gal的平板上显蓝色的VP菌株,即为WT-lacZ菌株。分别用引物对VP2403-A/VP2403-D和VClacZ-F/VClacZ-R对菌株进行PCR鉴定。鉴定结果如图 1F所示,与副溶血弧菌RIMD2210633基因组DNA为模板相比,引物对以WT-lacZ菌株为模板,其扩增产物增加了3500 bp左右,即得到了霍乱弧菌带有启动子区、能表达β-半乳糖苷酶的lacZ基因。
2.2 生长曲线测定 比较WT、WT-lacZ以及环境分离株VP1907在3%NaCl的LB培养基中于37 ℃生长的情况。结果表明,WT、WT-lacZ以及VP1907菌株在体外生长速度基本一致,插入lacZ基因后对副溶血弧菌体外生长无影响,见图 2。

|
| 图 2 WT、WT-lacZ和VP1907菌株在3%NaCl LB 培养基中的生长曲线 Figure 2 Growth curves of WT, WT-lacZ and VP1907 strains in LB with 3% NaCl at 37 ℃ |
由于VP菌不能表达β-半乳糖苷酶,因而在X-gal平板上显白色。为此笔者构建了能够表达β-半乳糖苷酶的WT-lacZ菌株。选择WT-lacZ与WT菌株进行竞争性定殖实验,评价插入lacZ基因后对副溶血弧菌在乳鼠肠道内定殖能力是否存在影响。 WT/WT-lacZ的CI值为1.08±0.11,表明WT与WT-lacZ 菌株在乳鼠肠道内的定殖能力几乎无影响,可以在X-gal平板上用显蓝色的WT-lacZ菌株代替WT菌株进行后续实验。WT-lacZ与环境分离的非产毒株VP1907菌株进行竞争性定殖实验,比较二者在乳鼠肠道内定殖能力的差异。VP1907/WT-lacZ 的CI值为0.11±0.05(P < 0.05),这表明临床分离株RIMD2210633的肠道定殖能力明显高于环境分离株VP1907,见图 3。

|
| 图 3 副溶血弧菌在乳鼠肠道内定殖的竞争性分析 Figure 3 Competitive colonization of V. parahaemolyticus in infant mouse intestinal track |
评价副溶血弧菌致病性的表型方法常见的有小鼠致死率实验、兔回肠袢实验、细胞毒性实验、兔血红细胞溶血实验等。有文献报道对6~10周龄的C57BL/6小鼠进行灌胃,从而比较VP菌野生株和ΔtoxR等基因缺失株对小鼠肠道定殖的差异[10],但是以乳鼠为模型评价副溶血弧菌肠道定殖能力的实验方法还未见报道。由于乳鼠个体小等特点,常会因灌胃管误插入肺内引起出血而导致实验失败。本实验中采用了动脉导管替代灌胃管,并在乳鼠灌胃前将导管前端用少量甘油润滑,这些细节处理有效的提高了乳鼠灌胃的成功率,使实验能够顺利完成。6~10周龄的小鼠肠道内常常含有“土著菌”,在以小鼠为模型进行肠道定殖实验前,往往需要对小鼠饲喂抗生素抑制这些菌的生长;而4~5日龄乳鼠肠道更为洁净,不需要提前饲喂抗生素就可以进行实验。并且小鼠个体差异性大,与乳鼠肠道定殖模型相比,常需要更多小鼠重复多次实验才能确定实验结果的可靠性。
与实验菌株和对照菌株单独接种至乳鼠体内相比,竞争性定殖实验方法的优势在于两种菌株等比例混合接种于同一个乳鼠内,排除了因乳鼠个体差异而导致的实验误差。构建能够表达β-半乳糖苷酶的lacZ菌株是VP菌竞争性定殖实验方法建立的前提。本研究数据表明,与WT相比,插入lacZ基因后对VP菌在乳鼠肠道内定殖能力无影响,因此可以用WT-lacZ代替WT菌株用于后续与环境分离株VP1907肠道定殖能力的比较研究。
致病性副溶血弧菌经口感染宿主后,通常先附着在肠道上皮细胞上进行繁殖并产生毒力因子从而引起急性胃肠炎。副溶血弧菌RIMD2210633 (KP+、tdh+、T3SSI+、T3SS2α+、T3SS2β-、trh-)是1996年在日本分离的O3∶K6血清型临床分离株,研究表明,RIMD2210633菌株具有肠毒性、细胞毒性、溶血活性和明显的小鼠致死性[11, 12]。RIMD2210633与VP1907菌株虽然均为O3∶K6血清型,但是前者为临床分离株、KP阳性,而VP1907菌株为环境分离株、KP阴性。早期的研究表明大多数KP阴性的菌株没有黏附能力,而KP阳性菌株能够黏附到兔小肠上皮细胞。所有KP阳性菌株都包含tdh1和tdh2基因,能够表达耐热直接溶血素(TDH)。TDH具有溶血活性、细胞毒性和肠毒性,它能够导致细胞凋亡和实验动物水样腹泻[13, 14]。RIMD2210633的乳鼠肠道定殖能力明显高于VP1907菌株,可能与前者TDH阳性直接相关。此外,研究表明外膜蛋白、荚膜多糖、Ⅳ型菌毛、极性鞭毛和侧鞭毛均是副溶血弧菌的黏附因子[15, 16]。哪些黏附因子及其相关基因是影响RIMD2210633与VP1907菌株肠道定殖能力的关键因素,还需要进一步研究。
综上所述,乳鼠肠道竞争性定殖模型对研究副溶血弧菌在宿主肠道内的生存繁殖具有重要意义,为不同菌株间肠道定殖能力的比较以及VP菌肠道定殖相关基因的筛选提供了研究平台。
| [1] | Daniels NA, MacKinnon L, Bishop R, et al. Vibrio parahaemolyticus Infections in the United States, 1973-1998[J]. J Infect Dis,2000,181(5):1661-1666. |
| [2] | Shimohata T, Takahashi A. Diarrhea induced by infection of Vibrio parahaemolyticus[J].J Med Invest,2010,57(3/4):179-182. |
| [3] | Okuda J, Ishibashi M, Hayakawa E, et al. Emergence of a unique O3:K6 clone of Vibrio parahaemolyticus in Calcutta, India, and isolation of strains from the same clonal group from Southeast Asian travelers arriving in Japan[J]. J Clin Microbiol,1997,5(12):3150-3155. |
| [4] | Yeung PS, Boor KJ. Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections[J]. Foodborne Pathog Dis,2004,1(2):74-88. |
| [5] | Broberg CA, Calder TJ, Orth K. Vibrio parahaemolyticus cell biology and pathogenicity determinants[J]. Microbes Infect,2011,13(12/13):992-1001. |
| [6] | Haines-Menges B, Whitaker WB, Boyd EF. Alternative sigma factor RpoE is important for Vibrio parahaemolyticus cell envelope stress response and intestinal colonization[J]. Infect Immun,2014,82(9):3667-3677. |
| [7] | Liu ZY, Wang YN, Liu SY, et al.Vibrio cholerae represses polysaccharide synthesis to promote motility in mucosa[J]. Infect Immun,2015,83(3):1114-1121. |
| [8] | Liu X, Gao H, Yang L, et al. Establishment of a suicide vector-based gene knockout method in studies of Vibrio parahaemolyticus[J]. Acta Laboratorium Animalis Scientia Sinica,2011,19(3):188-192.(in Chinese) 刘霞, 高鹤, 杨琳, 等. 副溶血性弧菌基因敲除方法的建立及应用[J]. 中国实验动物学报,2011,19(3):188-192. |
| [9] | Tamayo R, Patimalla B, Camilli A. Growth in a biofilm induces a hyperinfectious phenotype inVibrio cholerae[J]. Infect Immun,2010,78(8):3560-3569. |
| [10] | Whitaker WB, Parent MA, Boyd A, et al. The Vibrio parahaemolyticus ToxRS regulator is required for stress tolerance and colonization in a novel orogastric streptomycin-induced adult murine model[J]. Infect Immun,2012,80(5):1834-1845. |
| [11] | Ma LZ, Guo LP, Wang LX, et al. Comparison of enterotoxicity, cytotoxicity and hemolytic activity between two pilot Vibrio parahaemolyticus strains[J]. Chinese Journal of Clinicians:Electronic Edition,2013,7(6):154-156.(in Chinese) 马立芝,郭李平,王立祥,等. 两株副溶血弧菌标准株的肠毒性及细胞毒性和溶血活性比较[J]. 中华临床医师杂志:电子版,2013,7(6):154-156. |
| [12] | Guo LP, Xu BR, Du DY, et al. Establishment and application of a mouse infection model for evaluating the virulence of Vibrio parahaemolyticus[J]. Acta Laboratorium Animalis Scientia Sinica,2012,20(4):31-34.(in Chinese) 郭李平,徐镔蕊,杜德燕,等.副溶血弧菌毒力评价小鼠模型的建立与应用[J]. 中国实验动物学报,2012,20(4):31-34. |
| [13] | Nishibuchi M, Fasano A, Russell RG, et al. Enterotoxigenicity of Vibrio parahaemolyticus with and without genes encoding thermostable direct hemolysin[J]. Infect Immun,1992,60(9):3539-3545. |
| [14] | Raimondi F, Kao JPY, Fiorentini C, et al. Enterotoxicity and cytotoxicity of Vibrio parahaemolyticus thermostable direct hemolysin in in vitro systems[J]. Infect Immun,2000,68(6):3180-3185. |
| [15] | Chakrabarti MK, Sinha AK, Biswas T. Adherence of Vibrio parahaemolyticus to rabbit intestinal epithelial cells in vitro[J]. FEMS Microbiol Lett,1991,84(1):113-117. |
| [16] | Hsieh YC, Liang SM, Tsai WL, et al. Study of capsular polysaccharide from Vibrio parahaemolyticus[J]. Infect Immun,2003,71(6):3329-3336. |
 2015, Vol. 30
2015, Vol. 30


