扩展功能
文章信息
- 严平, 陆元胜, 李珺, 赵锋, 阮陟, 张钧
- YAN Ping, LU Yuan-sheng, LI Jun, ZHAO Feng, RUAN Zhi, ZHANG Jun
- 浙江省富阳区临床分离甲氧西林耐药金黄色葡萄球菌的流行现状及耐药性分析
- Drug susceptibility and molecular characteristics of methicillin-resistant Staphylococcus aureus isolated from clinical specimens in Fuyang, Zhejiang
- 疾病监测, 2015, 30(12): 1056-1061
- Disease Surveillance, 2015, 30(12): 1056-1061
- 10.3784/j.issn.1003-9961.2015.12.016
-
文章历史
- 收稿日期: 2015-09-11
2. 浙江大学医学院附属邵逸夫医院, 浙江杭州 310016;
3. 富阳区第一人民医院, 杭州富阳 311400
2. Sir Run Run Shaw Hospital, Medical College of Zhejiang University, Hangzhou 310016, Zhejiang, China;
3. No. 1 People's Hospital of Fuyang, Hangzhou 311400, Zhejiang, China
甲氧西林耐药金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)是指对苯唑西林、甲氧西林等异唑青霉素耐药的金黄色葡萄球菌菌株,目前也被称为“超级细菌”。其传播速度快,适应性强,自1961年由英国Jevons首次发现至今,感染几乎遍及全球[1]。我国自20世纪70年代发现第1株MRSA后,其分离率迅速上升。MRSA的致病能力强,耐药谱广,且对多种抗菌药物的敏感性呈现逐年降低趋势,已成为严重危害公众健康的感染性因子之一。研究本地区MRSA的流行及耐药现状,应用多位点序列分型(multilocus sequence typing,MLST)、葡萄球菌蛋白A基因(staphylococcal protein A gene,spa)分型、葡萄球菌盒式染色体(staphylococcal cassette chromosome mec,SCCmec)分型、脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分型等基因分型技术,同时利用PFGE的分型图谱对菌株间的同源性进行分析,有助于了解本地区MRSA的进化与传播特征、监测其暴发流行、合理治疗感染患者,积极控制MRSA的传播[2]。
1 材料与方法 1.1 材料 1.1.1 菌株来源收集2013年11月至2014年10月杭州市富阳中医骨伤医院和富阳区人民医院从各种类型临床标本中分离出的MRSA,摒弃一周内同一患者、相同部位同种类型的标本,共44株。其中创口不良组织1例,痰液21例,余22例均为分泌物或渗出物标本。患者以中老年为主,男女比例2∶1。所有菌株在实验前均置于-80 ℃超低温冰箱保存。
1.1.2 仪器与设备法国梅里埃全自动细菌鉴定药敏分析仪vitek2 Compact;美国ABI Thermal S1000 扩增仪;Universal HoodⅡ凝胶成像仪、CHEF Mapper XA型脉冲场凝胶电泳仪均为美国Bio-rad公司产品。PCR扩增产物送上海铂尚生物技术有限公司测序,测序仪为美国ABI Prism 3730。
1.1.3 试剂与药品5%羊血哥伦比亚琼脂培养基购自杭州怡丹生物科技有限公司;苯唑西林(1.0 μg/片)、头孢西丁(30 μg/片)纸片购自英国Oxoid公司;细菌DNA提取试剂盒QIAamp DNA Mini Kit (Qiagen,CA,USA);溶葡菌素(lysostaphine)、溶菌酶(lysozyne)、DNA Marker由上海生物工程公司提供;PCR试剂盒,PFGE所需内切酶SmaⅠ酶、XmaⅠ酶均购自TaKaRa公司;实验所需引物均委托北京擎科生物有限公司合成。金黄色葡萄球菌ATCC29213、ATCC25923分别为药敏实验仪器自动检测法和纸片扩散法的质控菌株。
1.2 方法 1.2.1 MRSA初筛送检标本经哥伦比亚血平板培养,培养阳性菌株行革兰染色为阳性,经vitek2 Compact鉴定结果为金黄色葡萄球菌,凝固酶实验为阳性,且药敏结果苯唑西林MIC值>4.0 μg/ml。同时采用头孢西丁纸片扩散法进行表型筛选MRSA,操作及结果判定参照CLSI2013标准进行解读[3]。
1.2.2 药敏实验应用仪器配套的AST-GP67阳性细菌药敏卡对MRSA进行16种抗菌药物的药敏实验。同一株细菌对三类或三类以上的抗菌药物耐药即判定为多重耐药(multidrug-resistant,MDR)[4]。
1.2.3 DNA模板提取采用细菌基因组提取试剂盒QIAamp DNA Mini Kit,严格遵照实验标准操作程序进行。提取的DNA置-20 ℃冰箱备用。
1.2.4 MRSA确证对仪器鉴定及表型筛选均为MRSA的菌株进行PCR扩增检测mecA基因,引物序列及循环参数参照文献[5]设计:上游序列 5′-GTA GAA ATG ACT GAA CGT CCG ATA A -3′,下游序列 5′-CCA ATT CCA CAT TGT TTC GGT CTA A-3′ ,产物片段长度310 bp。反应体系20 μl,循环参数:95 ℃预变性5 min,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸40 s,35个循环,72 ℃补延伸 10 min。扩增产物行1.2%琼脂糖凝胶电泳。
1.2.5 MLST分型金黄色葡萄球菌的MLST分析测定的管家基因分别是arcC、 aroE、 glpF、 gmk、 pta、 tpi及 yqiL。这7个基因相对保守,是公认的可用于长期追踪菌株间遗传关系和宏观进化过程的指标。PCR反应引物参照文献[6]合成。反应体系:10×PCR Buffer 5 μl,dNTP 0.1 mmol/L,引物各 0.2 μmol/L,r-Taq酶1.5 U,DNA模板2 μl,双蒸水补足至50 μl。循环参数:94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃补延伸8 min。扩增产物行1.2%的琼脂糖凝胶电泳,同时送测序,测序结果提交MLST分型数据库,得到每株细菌针对7个基因的等位基因谱,再提交至MLST官方网站 (http://www.mlst.net)确定其分型。
1.2.6 spa分型spa分型是以编码金黄色葡萄球菌A蛋白基因的X区重复序列具有多态性为基础的分型方法。自行设计扩增引物后委托合成:spa F:5′-AGA CGA TCC TTC GGT GAG C-3′,spa R:5′-GCT TTT GCA ATG TCA TTT ACT G -3′。反应体系和循环参数同MLST分型,扩增产物电泳后送测序。测序结果提交网站http://spatyper.fortinbras.us/分析确定型别。
1.2.7 SCCmec分型SCCmec是一种新型的可移动元件,该元件主要包括mec基因复合体和染色体重组酶基因ccr复合体。根据mec和ccr基因复合体结构的不同进行分型。参照文献将4对引物放入同一反应体系建立多重PCR,反应体系如下:引物ccrA2-B、ccrC、IS1272、mecA-IS431的浓度分别为0.2 μmol/L、0.25 μmol/L、0.08 μmol/L、0.1 μmol/L,10×PCR缓冲液5 μl,10 mmol/L dNTP 0.5 μl,r-Taq(5 U/μl)0.3 μl,双蒸水补足反应总体积至 50 μl。循环参数:95 ℃预变性5 min,95 ℃变性30 s,52 ℃退火40 s,72 ℃延伸60 s,30个循环,72 ℃补延伸 5 min。对出现的电泳条带进行比对分析,确定其SCCmec型别[7]。
1.2.8 杀白细胞毒素(pvl)基因检测PCR扩增所有MRSA菌株的pvl基因的阳性携带率,引物参照文献[8]合成:pvl F:5′- ATC ATT AGG TAA AAT GTC TGG ACA TGA TCC A-3′,pvl R:5′-GCA TCA AST GTA TTG GAT AGC AAA AGC-3′。反应体系及循环参数同MLST分型,产物片段大小433 bp。扩增阳性产物送测序确认。
1.2.9 PFGE新鲜菌落包埋于2.0%的低熔点胶中,溶葡菌素及溶菌酶进行破壁,37 ℃水浴过夜;蛋白激酶K原位消化,50 ℃水浴过夜;1×TE缓冲液每间隔30 min清洗胶块5~7次;经限制性内切酶30 ℃酶切5~6 h后制备胶条。相对分子质量标记物选用沙门菌HB9812。电泳结束后,电泳胶以Gelred染色30 min,蒸馏水清洗15 min,转移至凝胶成像仪观察、拍照。电泳图谱利用BioNumerics数据库软件分析菌株间的同源性,应用Marker HB9812 进行校准后聚类分析结果。
2 结果 2.1 金黄色葡萄球菌及MRSA的分离率共收集金黄色葡萄球菌268株,经头孢西丁筛选MRSA共计44株,分离率16.4%。筛选出的MRSA菌株经PCR扩增mecA基因均出现阳性条带。与头孢西丁初筛结果一致。其中富阳骨伤医院共收集金黄色葡萄球菌147株,MRSA 22株,占金黄色葡萄球菌的15.0%(22/147);富阳区人民医院共收集金黄色葡萄球菌121例,MRSA 22例,占金黄色葡萄球菌的18.2%(22/121)。经SPSS 16.0软件分析,两家医院金黄色葡萄球菌中MRSA的分离率差异无统计学意义(χ2=0.500,P=0.479)。
2.2 MRSA的抗生素敏感实验本次实验分离出的MRSA对利奈唑胺、万古霉素、喹奴普汀/达福普汀、替加环素、呋喃妥因均敏感;对红霉素、克林霉素耐药率>85.0%;对其余抗生素的耐药率保持在中等或较低的水平(15.9%~52.3%),尤其是对利福平、庆大霉素、复方新诺明的耐药率均低于10.0%。但MRSA的多重耐药现象明显,高达90.9%。药敏结果详见表 1。
| 抗生素 | 耐药株 | 耐药率 (%) |
| 青霉素 | 44 | 100.0 |
| 苯唑西林 | 44 | 100.0 |
| 红霉素 | 41 | 93.2 |
| 克林霉素 | 38 | 86.4 |
| 左氧氟沙星 | 23 | 52.3 |
| 环丙沙星 | 23 | 52.3 |
| 四环素 | 18 | 40.9 |
| 莫西沙星 | 7 | 15.9 |
| 庆大霉素 | 4 | 9.1 |
| 利福平 | 3 | 6.8 |
| 复方新诺明 | 3 | 6.8 |
| 喹奴普汀/达福普汀 | 0 | 0.0 |
| 呋喃妥因 | 0 | 0.0 |
| 替加环素 | 0 | 0.0 |
| 利奈唑胺 | 0 | 0.0 |
| 万古霉素 | 0 | 0.0 |
| 多重耐药 | 40 | 90.9 |
44株MRSA的ST分型共检出12种型别,结果以ST5为主,共17例(占38.6%),其次为ST59,共7例(占15.9%)。本次研究发现新的ST型别3种,经提交官方网站反馈为3193、3194、3195型。
2.3.2 spa分型共得到11种型别,另检出1株新的未知型别。分型结果以t311为主,共19例(占43.2%),其次为t437,共8例(占18.2%)。
2.3.3 SCCmec分型扩增产物电泳图谱见图 1。结果以Ⅱ型、Ⅳ型为主。分别检出Ⅱ型16株(36.4%),Ⅳ型15株(34.1%),Ⅴ型8株(18.2%),Ⅲ型4株(9.1%),Ⅰ型1株(2.3%)。两家医院分离出MRSA的SCCmec型别分布有明显的差异,区人民医院分型结果较为集中,以Ⅱ型为主,共检出13株(59.1%);骨伤医院分型以Ⅳ型居多占45.4%,其次为Ⅴ型(36.4%),且Ⅴ型菌株全部集中在骨伤医院。

|
| 图 1 部分菌株SCCmec分型多重PCR扩增产物电泳结果 Figure 1 Electrophoretogram of multiplex PCR products in SCCmec subtyping of selected MRSA strains 注:mk2为2000 bp的DNA Marker。101、105、106、108-112、114-117,119为SCCmecⅡ型,102、107、121为SCCmecⅢ型,103、104、113、118、302为SCCmecⅣ型,120为SccmecⅠ型。 |
44株MRSA中,PCR扩增有3株出现阳性条带。经外送测序、比对确认,均为pvl阳性,占比6.8%。
2.5 PFGE结果染色体条带结果显示44株MRSA为多克隆株散发流行。以80%的相似度为界限,两家医院分离到的MRSA至少存在10种以上的克隆,其中C型克隆占较大比例,共14株(31.8%)。PFGE的聚类分析与基因分型的结果对照见图 2、3。
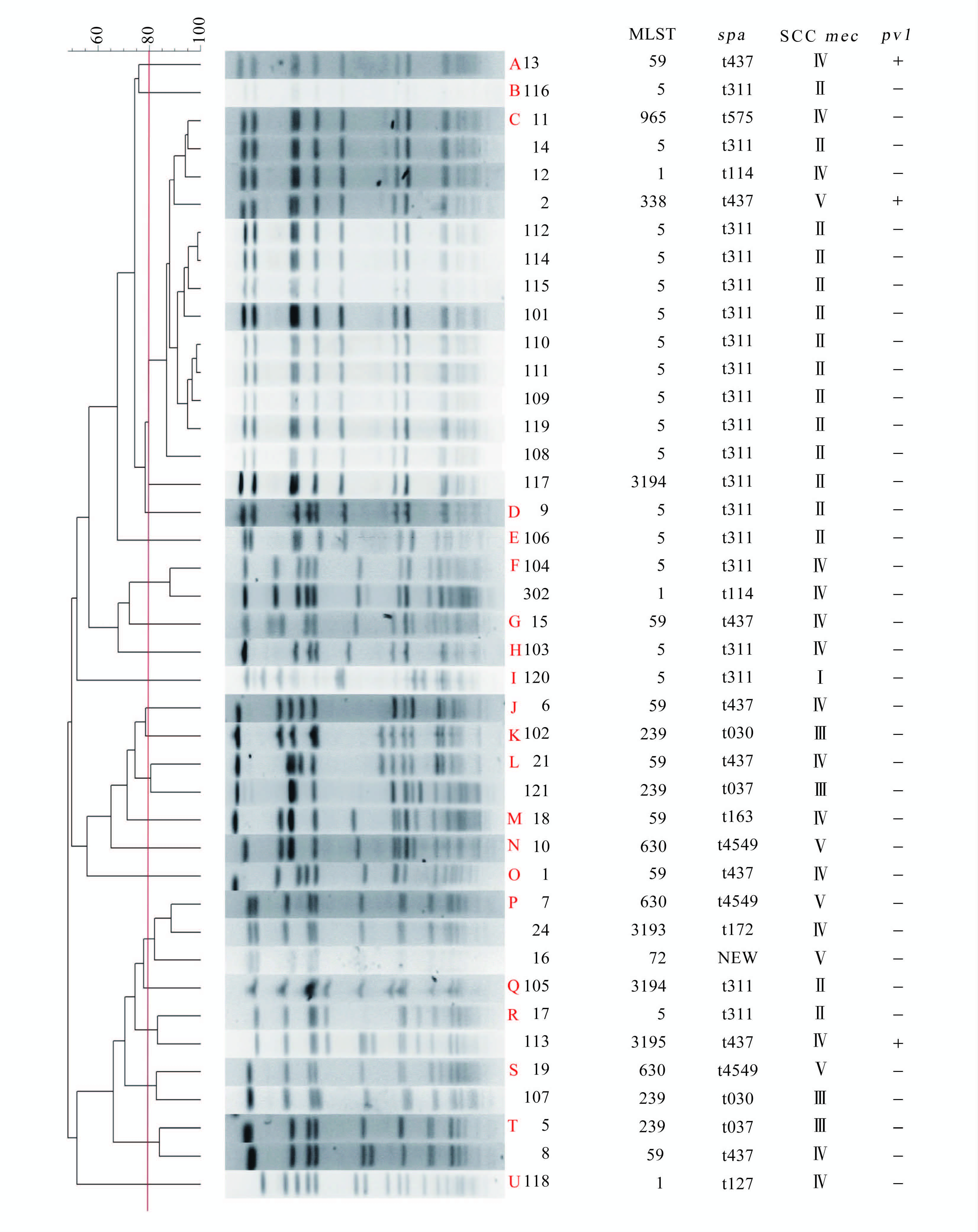
|
| 图 2 41株非ST398型别MRSA的PFGE聚类分析(SmaⅠ酶切)与基因分型的结果对照 Figure 2 Alignment of PFGE patterns (SmaⅠdigestion) genotypes of 41 MRSA strains (non- ST398) 注:菌株编号 1~22为骨伤医院标本,101~121、302为人民医院标本。 |
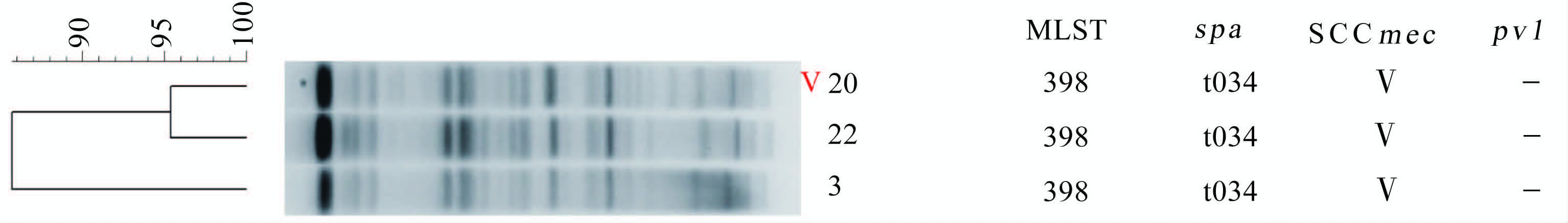
|
| 图 3 株ST398型别MRSA的PFGE聚类分析(XmaⅠ酶切)与基因分型的结果对照 Figure 3 Alignment of PFGE patterns (SmaⅠdigestion) genotypes of 3 MRSA strains (ST398) |
MRSA为临床常见的多重耐药菌,能够引起如中毒性休克、感染性心内膜炎、重症肺炎等一系列威胁生命的重症感染。不同地区MRSA占金黄色葡萄球菌的比例差异较大,欧洲的某些国家诸如荷兰、丹麦、瑞典,其分离率很低,甚至低于1.0%,然而在美国、日本,其分离率已高达60.0%。在亚洲,MRSA的检出率也已经很高,如中国大陆MRSA占金黄色葡萄球菌的比例已高达50%~70%,2014年CHINET耐药监测结果显示:在金黄色葡萄球菌中,其平均检出率为44.6%(29.1%~74.2%)[9]。杭州地区报道的分离率差异较大,30%~80%之间均有报道[10, 11],本次研究发现富阳区MRSA的总检出率为16.4%,两家医院的检出率无明显差异,但明显低于以上报道。分析可能与地区人口密度、医院抗生素的使用习惯、院感控制的优劣以及MRSA在不同性质的医院及院内不同科室的分布存在差异有关[12, 13]。
基因分型的分子流行病学研究方法在揭示病原菌的进化及遗传特性,确定某一感染暴发流行的菌株克隆或相关基因来源,追踪基因水平的转移与播散等方面发挥重要作用[14]。MLST、spa分型在国际范围内已有统一标准的操作方法及命名体系,可以直接将结果提交到国际网站,与已知的流行株进行比较和分析,了解不同国家和地区间菌株的遗传相关性,能够实现在不同实验室、地区甚至国家之间的对比,适于研究群体生物性和长期大范围、全球性的流行病学调查研究[15]。 SCCmec分型基于决定对甲氧西林及其他相关药物耐药的耐药基因盒,目前SCCmec主要有五个大的分型,各个分型中又有具体亚型。PFGE是对细菌的全基因组酶切分型,判断菌株间的亲缘化程度,被认为是分辨率最高的分型方法之一,可以准确监测判断是否为同一克隆的MRSA在医院的暴发流行。值得注意的是不同细菌其PFGE标准方法所用的内切酶不同,另外酶作用位点结构的变化也会影响酶切效果,甚至导致酶切失败,无法进行PFGE聚类分析。本次研究检出3株ST398型别的MRSA,由于该型别菌株在SmaⅠ酶切作用位点处存在甲基化,用常规的葡萄球菌PFGE所用的SmaⅠ酶切不成功,后参照文献[16]改用XmaⅠ酶切成功。
研究发现,富阳区MRSA的流行以散发为主,44株MRSA的PFGE型别超过20余种。两家医院流行的主要克隆不同,骨伤医院的流行株以ST59-t437-SCCmecⅣ为主,人民医院则以ST5-t311-SCCmecⅡ为主。分析可能与标本类型、就诊人群的分布有关。骨伤医院标本主要是开放性的创口渗出物或分泌物,人民医院收集到的菌株其来源均为痰液。另外骨伤医院是一家具有骨科特色的专科医院,除富阳本地患者外,周边地市的患者占较大比重,或已在外院接受治疗后转入,检出的MRSA分型结果多样,PFGE结果显示多为散发,菌株间同源性不高。人民医院是富阳区最大的一家综合性医院,患者基本局限在富阳本土区域内,菌株分型结果更能代表富阳地区MRSA的流行特点。ST5-t311-SCCmecⅡ型别的菌株占比大于60%,PFGE结果显示该院C型菌株所占比例较高共10株。结合病历资料发现其中有7株的检出时间均集中在2014年4月,不排除该型菌株在该段时间内集中流行的可能。值得注意的是:Ⅳ型与Ⅴ型菌株在骨伤医院的检出率较高,尤其是Ⅴ型,全部集中在骨伤医院。以往报道中Ⅳ型和Ⅴ型主要出现在CA-MRSA中,且有向医院内播散流行的趋势[17, 18, 19]。本次实验由于菌株数太少,结果尚不足以证实其正在向医院内播散,但需引起高度重视。
pvl是金黄色葡萄球菌产生的一种毒素,它在抵抗宿主吞噬细胞、增强病菌侵袭力方面有重要意义。携带有pvl基因的金黄色葡萄球菌可引起白细胞死亡和组织坏死,甚至引起组织坏死和坏死性肺炎,使感染更加严重,临床医生必须引起足够重视[20, 21]。由于携带pvl基因的MRSA菌株既保持了它的高度耐药性,又编码毒力基因增加了其致病力,有利于该菌株在临床环境中的生存,适于在进化中被选择出来,必须严格控制、防止此类菌株播散。44株MRSA中只检出3株pvl阳性菌株,阳性率明显低于相关报道[12, 21],但其spa分型均为t437型别,与pvl阳性菌株和spa t437型别之间可能存在关联的报道一致[22]。查阅此3株pvl阳性细菌病历资料,分别是门诊外伤、左中指残端修整术后伴感染、慢性阻塞性肺病伴急性加重的患者,分析无法找到任何背景关联,但药敏信息显示:此3株细菌药敏结果完全一致,除对青霉素、苯唑西林、红霉素、克林霉素耐药外,其他抗生素均显示敏感。
MRSA由于获得了外源性编码青霉素结合蛋白2a的mecA基因,造成对所有β内酰胺类药物耐药。这给临床抗感染治疗及医院感染的防控均带来了很大的困难。44株MRSA对万古霉素、喹奴普定/达呋普丁、利奈唑胺、替加环素显示100%的敏感性,超过90%的菌株对复方新诺明、庆大霉素、利福平敏感,仅有13.6%和6.8%的菌株分别对克林霉素和红霉素敏感,与近年来文献报道一致[2, 23]。进一步的研究发现,菌株SCCmec型别与其药敏结果之间存在一定的关联,分析这与不同的SCCmec型别其携带的耐药基因片段的不同有关。本次实验药敏结果显示Ⅳ、Ⅴ型菌株除对β内酰胺类药物全部耐药外,对红霉素、克林霉素绝大多数耐药,对其他抗生素敏感;Ⅱ、Ⅲ型菌株的耐药谱在Ⅳ、Ⅴ型菌株耐药谱的基础上增加了对环丙沙星,左氧氟沙星的绝大多数耐药,差异有统计学意义(P < 0.01)。MRSA菌株的基因型别与其药敏结果间的具体关联有待进一步的研究证实。
| [1] | Medina G, Egea AL, Otth C, et al. Molecular epidemiology of hospital-onset methicillin-resistant Staphylococcus aureus infections in Southern Chile[J]. Eur J Clin Microbiol Infect Dis,2013,32(12):1533-1540. |
| [2] | Xiao M, Wang H, Zhao Y, et al. National surveillance of methicillin-resistant Staphylococcus aureus in China highlights a still-evolving epidemiology with 15 novel emerging multilocus sequence types[J]. J Clin Microbiol,2013,51(11):3638-3644. |
| [3] | Clinical and Laboratory Standards Institute. M100-S19 Performance standards for antimicrobial susceptibility testing:Nineteenth informational supplement[S]. Clinical and Laboratory Standards Institute,2013. |
| [4] | Li CH,Wu AH. MDR、XDR、PDR the temporary Standard definition of multi drug resistant bacteria- the advice of international expert[J]. Chin J Infect Control,2014,13(1):62-64.(in Chinese) 李春辉,吴安华.MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J].中国感染控制杂志,2014,13(1):62-64. |
| [5] | Jonas D, Grundmann H, Hartung D, et al. Evaluation of the mecA femB duplex polymerase chain reaction for detection of methicillin-resistant Staphylococcus aureus[J]. Eur J Clin Microbiol Infect Dis,1999,18(9):643-647. |
| [6] | Enright MC, Day NP, Davies CE, et al. Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones of staphylococcus aureus[J]. J Clin Microbiol,2000,38(3):1008-1015. |
| [7] | Boye K, Bartels MD, Andersen IS, et al. A new multiplex PCR for easy screening of methicillin-resistant Staphylococcus aureus SCCmec types Ⅰ-Ⅴ[J]. Clin Microbiol Infect,2007,13(7):725-727. |
| [8] | Lina G, Piémont Y, Godail-Gamot F, et al. Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia[J]. Clin Infect Dis, 1999,29(5):1128-1132. |
| [9] | Hu FP, Zhu DM, Wang F, et al. CHINET 2014 surveillance of bacterial resistance in China[J]. Chinese Journal of Infection and Chemotherapy,2015,15(5):401-410.(in Chinese) 胡付品,朱德妹,汪复,等.2014年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志,2015,15(5):401-410. |
| [10] | Guo YY, Shen LM, Chu X, et al. Clinical isolation of Staphylococcus aureus and its drug resistance in Xiaoshan district of Zhejiang province,2006-2010[J]. Disease Surveillance,2012,27(2):117-120.(in Chinese) 郭远瑜,沈利蒙,楚旭,等.2006-2010年浙江省萧山地区金黄色葡萄球菌临床分离与耐药变迁[J].疾病监测,2012,27(2):117-120. |
| [11] | Song XQ, Sun L, Chen YM, et al. Clinical comparison of infection type and drug resistance of Staphylococcus aureus[J]. Chinese Journal of Health Laboratory Technology,2013,23(5):1311-1313.(in Chinese) 宋相泉,孙龙,陈益明,等.金黄色葡萄球菌临床感染类型及耐药性比较[J].中国卫生检验杂志,2013,23(5):1311-1313. |
| [12] | Harastani HH, Araj GF, Tokajian ST. Molecular characteristics of Staphylococcus aureus isolated from a major hospital in Lebanon[J]. Int J Infect Dis,2014,19:33-38. |
| [13] | Liao YQ. Progress in research of nosocomial infection of methicillin-resistant Staphylococcus aureus[J]. Disease Surveillance,2012,27(7):580-585.(in Chinese) 廖远泉.耐甲氧西林金黄色葡萄球菌医院感染研究进展[J].疾病监测,2012,27(7):580-585. |
| [14] | Oliveira DC, de Lencastre H. Multiplex PCR strategy for rapid identification of structural types and variants of the mec element in methicillin-resistant Staphylococcus aureus[J]. Antimicrob Agent Chemother,2002,46(7):2155-2161. |
| [15] | Li KC, Li Q, Xia F, et al. Study on spa typing of methicillin resistant Staphylococcus aureus[J]. Disease Surveillance,2012,27(11):877-880.(in Chinese) 李克诚,李琼,夏菲,等.耐甲氧西林金黄色葡萄球菌spa基因分型[J].疾病监测,2012,27(11):877-880. |
| [16] | Bosch T, de Neeling AJ, Schouls LM, et al. PFGE diversity within the methicillin-resistant Staphylococcus aureus clonal lineage ST398[J]. BMC Microbiol,2010,10:40. |
| [17] | Budimir A, Pal MP, Bošnjak Z, et al. Prevalence and molecular characteristics of methicillin-resistant Staphylococcus aureus strains isolated in a multicenter study of nursing home residents in Croatia[J]. Amer J Infect Contr,2014,42(11):1197-1202. |
| [18] | Monecke S, Coombs G, Shore AC, et al. A field guide to pandemic, epidemic and sporadic clones of methicillin-resistant Staphylococcus aureus[J]. PLoS One,2011,6(4):e17936. |
| [19] | Budimir A, Deurenberg RH, Plecko V, et al. Molecular characterization of methicillin-resistant Staphylococcus aureus bloodstream isolates from Croatia[J]. J Antimicrob Chemother,2006,57(2):331-334. |
| [20] | Geng W, Yang Y, Wang C, et al. Skin and soft tissue infections caused by community-associated methicillin-resistant Staphylococcus aureus among children in China[J]. Acta Pædiatr,2010,99(4):575-580. |
| [21] | Govindan S, Maroli AS, Ciraj AM, et al. Molecular epidemiology of methicillin resistant Staphylococcus aureus colonizing the anterior Nares of school children of Udupi Taluk[J]. Indian J Med Microbiol,2015,33 Suppl 1:S129-133. |
| [22] | Glasner C, Pluister G, Westh H, et al. Staphylococcus aureus spa type t437:identification of the most dominant community-associated clone from Asia across Europe[J]. Clin Microbiol Infect,2015,21(2):163.e1-163.e8. |
| [23] | Xiao YH, Giske CG, Wei ZQ, et al. Epidemiology and characteristics of antimicrobial resistance in China[J]. Drug Resist Updates,2011,14(4/5):236-250. |
 2015, Vol. 30
2015, Vol. 30


