扩展功能
文章信息
- 肖康, 周伟, 张宝云, 陈操, 董小平, 石琦
- XIAO Kang, ZHOU Wei, ZHANG Bao-yun, CHEN Cao, DONG Xiao-ping, SHI Qi
- 2014年中国克雅氏病监测网络病例特征分析
- Characteristics of Creutzfeldt-Jakob disease cases in China, 2014
- 疾病监测, 2016, 31(1): 18-23
- Disease Surveillance, 2016, 31(1): 18-23
- 10.3784/j.issn.1003-9961.2016.01.006
-
文章历史
- 收稿日期: 2015-06-10
朊病毒病(prion diseases)又称可传播性海绵状脑病(Transimissible spongiform encephalopathies,TSEs),是一类感染人类和动物的致死性的神经退行性疾病[1]。目前认为其致病机制是由自身编码的PrPC蛋白异常折叠,形成一种具有PK酶抗性的PrPSc蛋白,在脑内异常积累,并最终破坏神经细胞[2]。目前已经在人类以及20余种动物中发现有自然发生或感染的TSEs。人类的TSEs包括克雅氏病(creutzfeldt-jakob,CJD)、致死性家族型失眠症(fatal familial insomnia,FFI)、吉斯特曼-施特劳斯综合征(gerstmann-strussler-scheinker syndrome,GSS)和库鲁病(kuru) [3]。CJD根据病因的不同可以分为4类:散发型CJD(sporadic CJD,sCJD)、家族遗传型CJD(genetic CJD or familial CJD,gCJD or fCJD)、医源型CJD(iatrogenic CJD,iCJD)及变异型CJD(variant CJD,vCJD) [4]。虽然CJD的发病率不高,但是由于20世纪在英国发生的vCJD,以及在医疗过程中可能发生的潜在iCJD感染,因此对该病的监测引起了广泛的关注[5, 6, 7]。目前英国、法国、日本、澳大利亚等国已经建立了对CJD比较完善的监测网络[8, 9, 10, 11]。中国在2002年纳入到新的监测项目欧洲中东部和中国CJD监测项目(SEEC-CJD),从2006年开始建成覆盖12个省(直辖市、自治区)的CJD监测网络,运转良好。本研究主要对我国监测网络中12个省(直辖市、自治区)在2014年的CJD监测数据进行总结和分析。
1 材料与方法 1.1 监测体系与病例来源 1.1.1 监测体系根据《我国CJD监测实施方案》,目前我国CJD监测体系共包括12个省(自治区、直辖市),以及15所哨点医院,见表 1。未来将逐步扩大监测网络覆盖范围。
| 省(直辖市、自治区) | 省级管理机构 | 哨点医院 | 监测点所在地 |
| 北京市 | 北京市CDC | 北京友谊医院 | 北京 |
| 上海市 | 上海市CDC | 复旦大学华山医院 | 上海 |
| 天津市 | 天津市CDC | 天津医科大学第二附属医院 | 天津 |
| 重庆市 | 重庆市CDC | 重庆医科大学第一附属医院 | 重庆 |
| 广东省 | 广东省CDC | 中山大学附属第一医院 | 广州 |
| 湖北省 | 湖北省CDC | 华中科技大学附属同济医院 | 武汉 |
| 湖北省中山医院 | 武汉 | ||
| 陕西省 | 陕西省CDC | 西安交通大学第一临床医学院 | 西安 |
| 西安交通大学医学院 | 西安 | ||
| 贵州省 | 贵州省CDC | 贵州医学院附属医院 | 贵阳 |
| 吉林省 | 吉林省CDC | 吉林大学医学院附属医院 | 长春 |
| 安徽省 | 安徽省CDC | 安徽医科大学第一附属医院 | 合肥 |
| 河南省 | 河南省CDC | 河南省人民医院 | 郑州 |
| 河南医科大学附属医院 | 郑州 | ||
| 新疆维吾尔自治区 | 新疆CDC | 新疆医科大学附属医院 | 乌鲁木齐 |
监测网络的病例主要来源于12个监测省(直辖市、自治区),同时少部分来源于非监测省份。对于纳入监测网络的省(直辖市、自治区),其所属的哨点医院配合各省级疾病预防控制中心(CDC)完成监测工作。哨点医院神经科医生主要负责收集待检测样品及临床病例资料并送至省级CDC;省级CDC主要负责收集病例的流行病学资料,并将其与临床资料、待检测样品送至中国CDC病毒病预防控制所克雅氏病监测中心进行实验室检测。对于未纳入监测网络来源的病例可以由神经科医生或患者家属直接与克雅氏病监测中心联系,并将患者临床资料、流行病学资料以及待检测样品送至本监测中心。待检测样品在运送过程中要保持低温运输,以保证样品的质量。中国CDC克雅氏病专家组会对患者进行随访,并根据随访结果、病例的临床资料、流行病学资料、脑脊液和血液等实验室检测结果进行会诊,依据《克雅氏病诊断标准》做出诊断。诊断类型包括sCJD临床诊断病例,sCJD疑似诊断病例,不支持诊断CJD例,gCJD/fCJD确诊病例[12]。诊断结果反馈给相应的省级CDC,再由省级CDC反馈给哨点医院神经科医生;非监测点的病例的处理意见则直接反馈给送检医生或患者家属。
1.2 病例资料采集所有克雅氏病监测点报送病例均按照《中国CJD监测实施方案》中的相应报告填写临床及流行病学资料。其中临床病例资料主要包括病例的一般情况、首发症状、主要临床表现、临床检查[包括脑电图(EEG)、睡眠运动扫描、磁共振成像(MRI)]结果、收集样品的信息及病例的死亡信息。流行病学资料主要包括居住信息、家族信息(是否在家族成员中出现过痴呆相关症状患者)、既往病史(外科手术病史及器官移植史、脑垂体提取物使用史、献血及输血史)、特殊职业(包括医护人员、兽医及屠户)。
1.3 样本采集及检测病例诊断收集的临床样本包括脑脊液(CSF)及抗凝血。
1.3.1 样本采集脑脊液样本采集1~2 ml,外观透亮,无血液污染,-20 ℃保存;血液样本采集1~2 ml外周静脉的抗凝血,-20 ℃保存。所有样本均按《中国CJD监测实施方案》中相关要求进行低温运输。
1.3.2 样本检测(1) 脑脊液中14-3-3蛋白检测——脑脊液中14-3-3蛋白阳性是克雅氏病诊断的重要参考条件之一。取脑脊液标本20 μl,加入等量的5×SDS上样缓冲液,经加热变性后进行15%SDS 聚丙烯酰胺凝胶电泳(PAGE)电泳,常规电转进行western blot 实验。其中一抗用1∶1000稀释的14-3-3蛋白特异性多克隆抗体(Santa Cruz公司),二抗用1∶5000稀释的辣根过氧化物酶标记抗兔IgG(Thermo公司),最后用ECL检测试剂盒进行显色,阳性对照采用10%羊脑组织匀浆。
(2) PRNP基因的扩增和序列分析——取200 μl患者全血,利用DNA提取试剂盒(QIAGEN公司)提取基因组DNA。然后用PRNP基因特异性引物进行PCR扩增、测序[13],并与PRNP基因标准序列(NCBI:NM-183079.1)进行比对,检测129位和219位氨基酸的多态性和PRNP基因是否有突变。
1.4 随访与失访对于接收到的病例,笔者会对患者家属或临床医生进行电话随访。在电话随访中对患者的临床表现及病情进展进行详细的询问。对于PRNP基因突变的患者,还会对患者家系进行了解。对于每位患者,与其家属或主管医生3次均无法联系或者不配合随访的,定义为失访。
1.5 数据分析对阳性检测结果个数与典型临床症状个数关系Spearman相关分析。P < 0.05为有统计学意义。使用SPSS 17.0软件进行相关统计学分析。
2 结果 2.1 病例诊断分析2014年全国通过克雅氏病监测网络共上报监测病例324例,较2013年新增加监测病例数25例,见图 1。根据《克雅氏病诊断标准》,324例病例中sCJD临床诊断病例143例(44.14%),sCJD疑似诊断病例15例(4.63%);不支持CJD诊断148例(45.68%);gCJD/fCJD诊断病例10例(3.09%),包括E200K 3例、T188K 5例、P102L 2例;另有FFI病例8例(2.47%)。
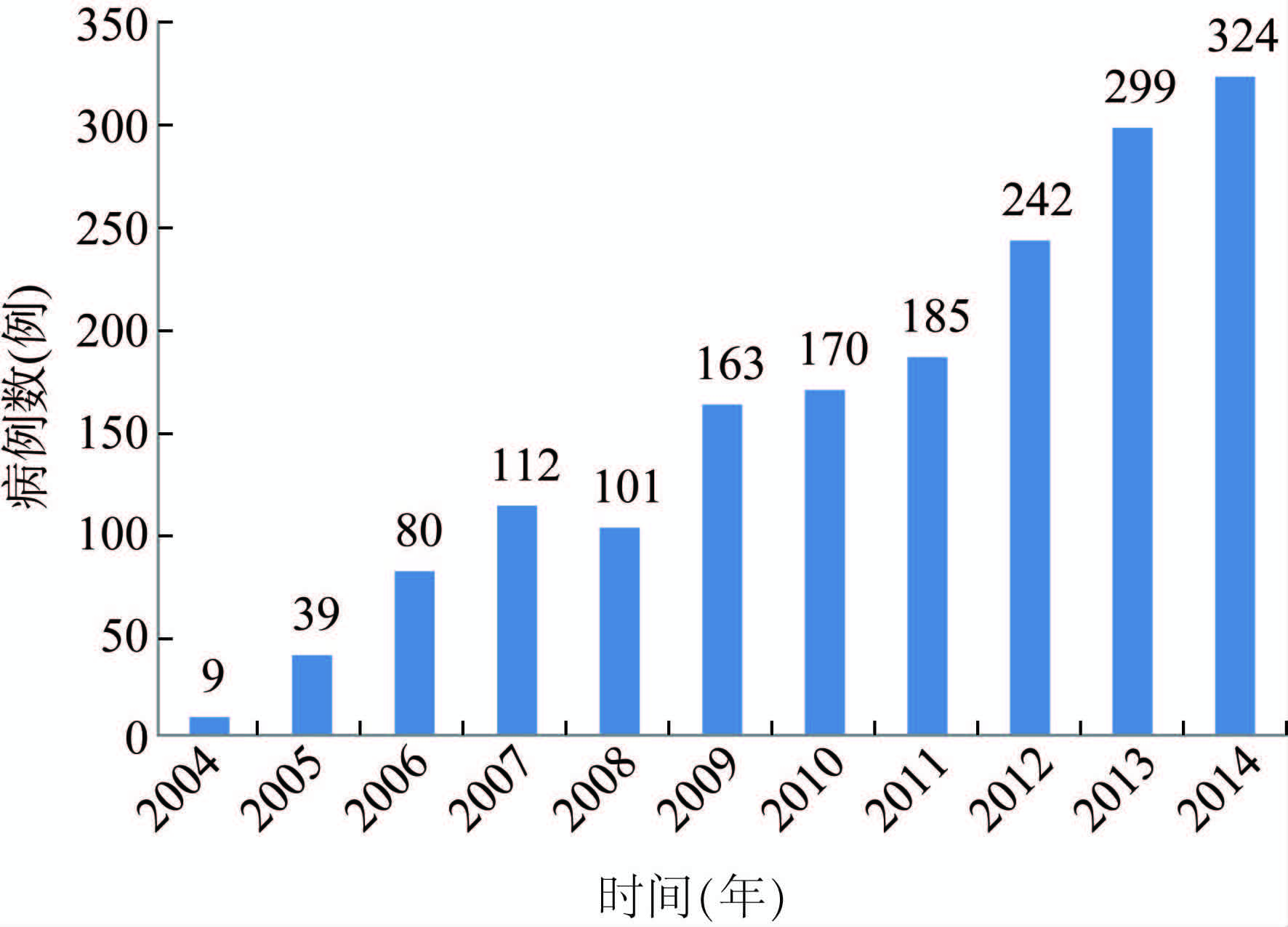
|
| 图 1 2004-2014年全国CJD监测病例数 Figure 1 Number of CJD cases in China, 2004-2014 |
2014年首例病例报告日期为1月2日,最后一例病例报告日期为12月29日,时间分布无明显的季节聚集性,符合sCJD发病特点,见图 2。
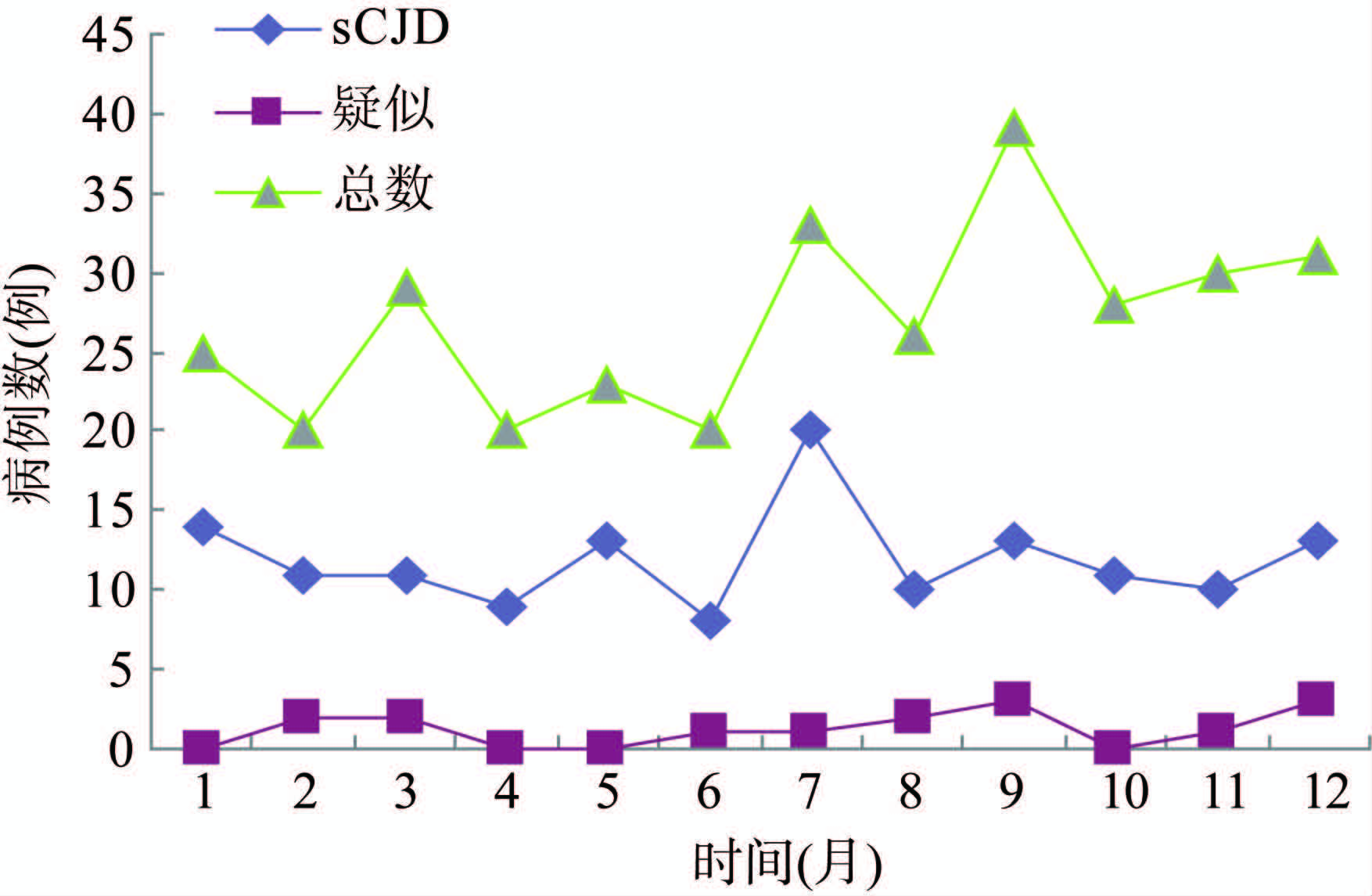
|
| 图 2 2014年全国sCJD月监测病例总数及临床和疑似诊断病例数 Figure 2 Monthly distribution of CJD cases in China, 2014 |
2014年共有23个省(直辖市、自治区)上报病例。其中北京市上报病例数最多,达到138例,位居其后的是广东(28例)、河南(27例)。另外,有11个非监测点省(自治区)(山东、浙江、甘肃、福建、河北、辽宁、江苏、宁夏、云南、山西、四川)共报送监测病例48例,占全国的14.81%,见图 3。
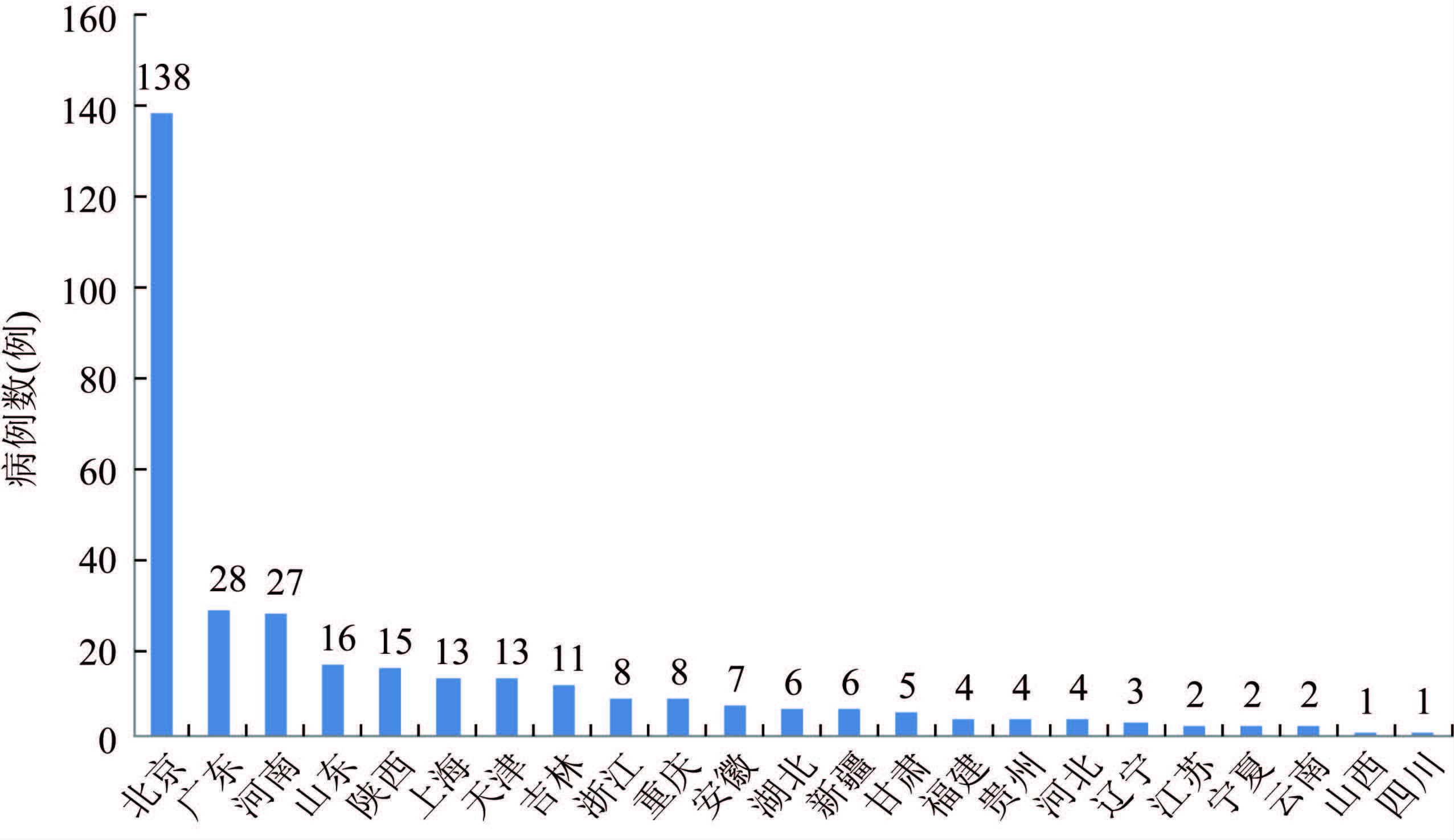
|
| 图 3 2014年全国各省(直辖市、自治区)CJD监测病例数 Figure 3 Number of CJD cases detected in different provinces,2014 |
143例sCJD临床诊断病例年龄中位数为61岁(24,81),男女性别比为1.07∶1;sCJD疑似诊断病例年龄中位数为57岁(33,76),男女性别比为1.5∶1。sCJD临床及疑似诊断病例的长久居住地呈散在分布,符合sCJD的发病特点。从临床及疑似病例职业分布来看,职业分布广泛,包括工人、农民、干部、教师等,见表 2。
| 职业 | 临床诊断 | 疑似诊断 | 总计 |
| 干部 | 10 | 0 | 10 |
| 个体 | 6 | 0 | 6 |
| 工人 | 22 | 3 | 25 |
| 教师 | 4 | 0 | 4 |
| 律师 | 1 | 0 | 1 |
| 农民 | 41 | 7 | 48 |
| 职员 | 11 | 1 | 12 |
| 退休 | 24 | 2 | 26 |
| 无业 | 14 | 2 | 16 |
| 其他 | 10 | 0 | 10 |
| 合计 | 143 | 15 | 158 |
在首发症状上,sCJD临床和疑似诊断病例以快速进行性痴呆为最多,共有93例(58.86%),其他症状包括缓慢进行性痴呆23例(14.56%)、精神症状8例(5.06%)、小脑和视觉障碍15例(9.49%)、锥体及锥体外系功能异常11例(6.96%)等,见图 4。

|
| 图 4 sCJD临床和疑似诊断病例的首发症状 Figure 4 Initial symptoms of probable and possible CJD cases |
比较143例临床诊断病例和15例疑似诊断病例的临床表现,所有患者在病程的不同时期均出现进行性痴呆症状,在临床和疑似诊断病例中,同时出现4种、3种、2种临床表现在两组不同诊断中差异无统计学意义(P=0.940),见表 3。
| 病例来源 | 总病例数 | 临床表现4项 | 临床表现3项 | 临床表现2项 | |||
| 病例数 | 构成比(%) | 病例数 | 构成比(%) | 病例数 | 构成比(%) | ||
| 临床诊断病例 | 143 | 39 | 27.27 | 51 | 35.66 | 53 | 37.06 |
| 疑似诊断病例 | 15 | 4 | 26.67 | 6 | 40.00 | 5 | 33.33 |
脑脊液14-3-3蛋白阳性、EEG阳性以及头颅MRI典型改变均是克雅氏病诊断的重要依据。实验室检测与典型临床表现的病例分布见表 4,根据拥有的典型临床表现个数和实验室检测阳性结果个数分组。虽然拥有一项实验室检测阳性患者的典型临床表现数少于其他两组,但差异无统计学意义(P=0.575)。
| 实验室检测阳性数(1) | 总病例数 | 临床表现4项 | 临床表现3项 | 临床表现2项 | |||
| 病例数 | 构成比(%) | 病例数 | 构成比(%) | 病例数 | 构成比(%) | ||
| 1 | 75 | 19 | 25.33 | 23 | 30.67 | 33 | 44.00 |
| 2 | 50 | 14 | 28.00 | 20 | 40.00 | 16 | 32.00 |
| 3 | 18 | 6 | 33.33 | 7 | 38.89 | 5 | 27.78 |
| 注:(1)脑脊液14-3-3蛋白检测,头颅MRI检测,EEG检测三项实验室检测中,具有阳性结果的个数。 | |||||||
2014年共收到脑脊液313份,其中14-3-3蛋白阳性143例(45.69%)。在143例阳性病例中,临床诊断94例(71.21%),不支持29例(21.97%),遗传型7例(5.30%),FFI 2例(1.52%)。收到血液310份,其中PRNP基因297例129位多态性为M/M纯合子,占总病例数的95.81%,294例219位多态性为E/E纯合子,占总病例数的94.84%。2014年共发现18例PRNP突变病例,占总病例数的5.56%,分别为E200K 3例、T188K 5例、P102L 2例、D178N 8例。进行MRI检查的病例数为306例(94.44%),阳性结果147例(48.04%),阴性结果159例(51.96%)。在MRI阳性患者中,sCJD临床诊断病例数为92例(62.59%),不支持病例数为46例(31.29%),gCJD病例数为9例(6.12%)。绝大部分MRI阳性结果为“缎带征”(114例,77.55%),其次为尾状核与壳核高信号(57例,38.78%)、丘脑后结节高信号(23例,15.65%)。
2.5 随访2014年对全部324例进行随访,失访32例,失访率为9.88%。在失访者中,19例(59.38%)是临床诊断,10例(31.25%)不支持诊断,1例(3.13%)为gCJD,2例(6.25)为FFI,没有发现明显的聚集性。
3 讨论我国自2006年全面开展克雅氏病监测系统以来,经过几年的运行和完善,此监测系统已显示了很好的监测能力。通过此监测系统,收集到的病例数量呈逐年增长趋势,有益于更加全面地了解我国克雅氏病整体情况。克雅氏病监测中心对每个收集到的待检测样本(包括脑组织、脑脊液和血液)依据实验室标准操作流程进行检测,并依据此检测结果经克雅氏病专家会诊后做出最终诊断,保证了诊断结果的准确性和可靠性。
2014年通过此监测系统共上报324例,较2013年新增加监测病例数25例,其中sCJD疑似诊断病例仅15例(4.63%),与2013年相比(8.36%),2014年有明显的下降。在收到病例后,监测网络会对每个病例进行电话随访。结合临床资料、流行病学资料、辅助检查、实验室检查,以及电话随访的结果,能够更准确的判断患者的疾病情况,排除sCJD疑似诊断病例。
在sCJD临床诊断和疑似诊断的病例当中,没有发现病例具有时间、地区以及人群聚集性。因为我国的CJD疾病绝大部分是散发型,而监测网络获得的数据,是符合克雅氏病的三间分布的,也与往年的数据相吻合。
2014年共有23个省(直辖市、自治区)送检样品,其中北京市的送检病例数最多,占总数的42.59%(138/324)。原因有两个:首先北京医疗资源集中,三级医院的数量也较多,全国各地在北京就医的人员多。因此,在克雅氏病监测系统中,北京送检样本数也较多。其次,因其地理的优势,北京医院的送样便利性也是导致北京病例总数多的原因。
通过对324份样品进行PRNP基因检测,其中297例为129位M/M纯合子,占91.67%,此分布符合我国汉族人群129位等位基因分布特征,并且129位纯合子比杂合子更易患sCJD[14, 15]。219位等位基因大部分(90.74%)是E/E纯合子,有报道称219位等位基因纯合子对CJD可能是一种保护因素[16, 17]。通过对样品PRNP检测,共发现18例突变病例,其中最多的是D178N突变,共有8例,其次分别是T188K突变5例,E200K突变3例,P102L突变2例,全部突变位点都有相关报道。同样是亚洲国家日本最常见的突变是V180I[18],这与我国最常见突变有所区别,可能与人种有关。
2014年上报的158例sCJD临床诊断和疑似诊断病例中,有超过一半的患者(58.86%)首发症状是快速进行性痴呆。CJD患者随着PrPSc在脑组织中不断积累,越来越多的脑细胞死亡,因此出现进行性痴呆症状。但在临床诊断和疑似诊断两组患者间,并没有在典型临床表现上发现差异。由于对每一位患者都进行了多次的电话随访,导致疑似患者只有15例,这可能是造成两者之间差异无统计学意义的原因。
脑脊液14-3-3蛋白作为克雅氏病重要的诊断标准,一直被认为有较高的灵敏性[19, 20]。但取脑脊液会给患者带来创伤和一定的痛苦,在监测过程中也发现,有小部分患者有抵触心理。需要探索创伤小,更易于让患者接受的方法。
经临床实践,疾病早期头颅MRI呈现壳核/尾状核异常高信号,特别是弥散加权像(DWI)显示对称性或不对称性皮质(或皮层)“缎带 (ribbon) 征”,对于该病的早期诊断有着重要意义,目前已纳入WHO对于克雅氏病的诊断标准中[21]。在我国的克雅氏病监测过程中,MRI检测也已经广泛用于临床诊断中。但是MRI结果的判读需要神经科医生丰富的经验,同时监测网络也开展了相关的培训,希望能让更多的医生更准确的判读MRI结果。
虽然辅助检查、实验室检查与患者的临床表现没有统计学上的关系,但是从表 4中可以观察到患者拥有多个辅助检查、实验室检查阳性结果的时候,其临床表现也更严重。这可能是因为检测结果阳性说明受损的脑区分布越广,患者表现出来的临床症状越多。
因为克雅氏病是一种进行性疾病,患者的病情在不断的变化中,定期的随访有助于多个脑部疾病间的鉴别诊断。2014年监测网络对全部324例病例进行随访,其中失访32例,失访率仅9.88%。笔者也未发现失访人群具有明显的特征。有效的随访对监测工作起到了积极的作用。在今后的监测工作中,要加强对患者的随访工作。
对于克雅氏病的确诊主要依靠脑组织病理检测,例如脑组织免疫组织化学或者蛋白免疫印迹检测PrPSc阳性结果。这需要获取患者脑组织样本,但由于我国的传统习俗,获取的脑组织样本很有限,过去3年,仅有2012年1例脑组织样本送检。在今后的监测工作中,将进一步做好脑组织检测重要性的宣讲工作,鼓励患者及家属送检脑组织样本,以便获得更多的确诊病例的信息。
由于现阶段对于CJD缺乏有效的治疗方法,因此严密的监测对于控制疾病的传播、暴发、形成灾难性后果就显得尤为重要。目前,CJD的监测已经从发达国家逐渐扩展到发展中国家,而且国际间的交流和监测信息的共享更为密切。通过近几年的监测工作和经验总结,我国制定出了更符合我国实际情况的监测方案,并取得了一定的成效。在今后的监测过程中将进一步完善并扩大监测网络,全面掌握我国CJD的发病流行状况,最大限度地减少CJD对我国公共卫生的威胁。
| [1] | Prusiner SB. Prions[J]. Proc Natl Acad Sci USA,1998,95(23):13363-13383. |
| [2] | Collinge J. Prion diseases of humans and animals: their causes and molecular basis[J]. Annu Rev Neurosci,2001,24(1):519-550. |
| [3] | Liberski PP. Historical overview of prion diseases: a view from afar[J]. Folia Neuropathol,2012,50(1):1-12. |
| [4] | Kulczycki J. Creutzfeldt-Jakob disease-the past or the future[J]. Przegl Epidemiol,2006,60 Suppl 1: S63-67. |
| [5] | Will RG, Ironside JW, Zeidler M, et al. A new variant of Creutzfeldt-Jakob disease in the UK[J]. Lancet,1996,347(9006):921-925. |
| [6] | Collinge J. Variant Creutzfeldt-Jakob disease[J]. Lancet,1999,354(9175):317-323. |
| [7] | Puoti G, Bizzi A, Forloni G, et al. Sporadic human prion diseases: molecular insights and diagnosis[J]. Lancet Neurol,2012,11(7):618-628. |
| [8] | Brandel JP, Peckeu L, Haik S. The French surveillance network of Creutzfeldt-Jakob disease. Epidemiological data in France and worldwide[J]. Transfus Clin Biol,2013,20(4):395-397. |
| [9] | Noguchi-Shinohara M, Hamaguchi T, Yamada M. Epidemiology and surveillance system of prion disease in Japan[J]. Nihon Rinsho,2007,65(8):1379-1383. |
| [10] | Klug GM, Boyd A, Lewis V, et al. Creutzfeldt-Jakob disease: Australian surveillance update to 31 December 2004[J]. Commun Dis Intell Q Rep,2005,29(3):269-271. |
| [11] | Krasnianski A, Heinemann U, Ponto C, et al. Clinical findings and diagnosis in genetic prion diseases in Germany[J]. Eur J Epidemiol,2015. |
| [12] | World Health Organization. World Health Organization department of communicable disease surveillance and response[M]. Geneva: WHO,2003. |
| [13] | Bratosiewicz-Wasik J, Smoleń-Dzirba J, Watala C, et al. Association of the PRNP regulatory region polymorphisms with the occurrence of sporadic Creutzfeldt-Jakob disease[J]. Folia Neuropathol,2012,50(1):68-73. |
| [14] | Hou XS, Gao C, Zhang BY, et al. Characteristics of polymorphism of 129th amino acid in PRNP among Han and Uighur Chinese[J]. Chinese Journal of Experimental and Clinical Virology,2002,16(2):105-108. (in Chinese)侯星生,高晨,张宝云,等. 中国不同民族人群中PrP蛋白基因第129位氨基酸多态性分析[J]. 中华实验和临床病毒学杂志,2002,16(2):105-108. |
| [15] | Chen C, Wang JC, Shi Q, et al. Analyses of the survival time and the influencing factors of chinese patients with prion diseases based on the surveillance data from 2008-2011[J]. PLoS One,2013,8(5):e62553. |
| [16] | Shibuya S, Higuchi J, Shin RW, et al. Protective prion protein polymorphisms against sporadic Creutzfeldt-Jakob disease[J]. Lancet,1998,351(9100):419. |
| [17] | Kobayashi A, Teruya K, Matsuura Y, et al. The influence of PRNP polymorphisms on human prion disease susceptibility: an update[J]. Acta Neuropathol,2015,130(2):159-170. |
| [18] | Nozaki I, Hamaguchi T, Sanjo N, et al. Prospective 10-year surveillance of human prion diseases in Japan[J]. Brain,2010,133(10):3043-3057. |
| [19] | Poser S, Mollenhauer B, Kraubeta A, et al. How to improve the clinical diagnosis of Creutzfeldt-Jakob disease[J]. Brain,1999,122(Pt 12):2345-2351. |
| [20] | Hamlin C, Puoti G, Berri S, et al. A comparison of tau and 14-3-3 protein in the diagnosis of Creutzfeldt-Jakob disease[J]. Neurology,2012,79(6):547-552. |
| [21] | Riva-Amarante E, Jiménez-Huete A, Toledano R, et al. Usefulness of high b-value diffusion-weighted MRI in the diagnosis of Creutzfeldt-Jakob disease[J]. Neurología,2011,26(6):331-336. |
 2016, Vol. 31
2016, Vol. 31


