扩展功能
文章信息
- 杨兰萍, 曹晓伟, 黄峥, 石维敏, 陶燕, 金汇明, 许学斌
- YANG Lan-ping, CAO Xiao-wei, HUANG Zheng, SHI Wei-min, TAO Yan, JIN Hui-ming, XU Xue-bin
- 1例乳糖发酵鼠伤寒沙门菌腹泻病例株的表型和分子特征研究
- Study on phenotype and molecular characteristics of lactose-fermenting Salmonella typhimurium isolated from one diarrhea case
- 疾病监测, 2016, 31(1): 34-39
- Disease Surveillance, 2016, 31(1): 34-39
- 10.3784/j.issn.1003-9961.2016.01.009
-
文章历史
- 收稿日期: 2015-08-13
2. 上海和睦家医院, 上海 200336;
3. 上海市长宁区疾病预防控制中心, 上海 200051;
4. 上海科玛嘉微生物技术中心, 上海 200434;
5. 上海市疾病预防控制中心, 上海 200336
2. Shanghai Hemujia Hospital, Shanghai 200336, China;
3. Changning District Center for Disease Control and Prevetnion, Shanghai, Shanghai 200051, China;
4. Shanghai Kemajia Bio-technique Center, Shanghai 200434, China;
5. Shanghai Municipal Center for Disease Control and Prevetnion, Shanghai 200336, China
2005年起,上海市持续开展沙门菌监测,至2012年,属病原型谱中鼠伤寒沙门菌一直是本地区仅次于肠炎的第2位人源沙门菌优势血清型,仅在2010年,超过肠炎而居诸型之首[1]。随着监测能力提高和范围扩大,除掌握沙门菌在区域人群中的流行现状和基线特征外,总体技术路线和网络实验室能力均得到科学验证和显著提升,促进临床和公共卫生实验室的交流[2]。2013年9月,上海和睦家医院报告1例1岁腹泻的女性幼童分离1株鼠伤寒沙门菌,经辖区公共卫生实验室确认属首次发现的乳糖发酵的鼠伤寒沙门菌,遂由区域性网络参比实验室进行系统表型和分子型鉴定,现将结果报道如下。
1 材料与方法 1.1 病例资料患儿来自国外(国籍不详),女,1岁,因急性腹泻于2013年9月2日至上海和睦家医院儿科就诊。入院时有乏力、腹痛、腹泻5次/d、体温38.5 ℃、精神萎靡。实验室血液常规检查:红细胞2.5×1012、白细胞0.9×109;粪便常规检查:便隐血试验阳性、镜检红、白细胞5~10个。流行病学调查否认外出就餐和旅游史、家中无豢养宠物、无接触腹泻患者史、家中近期亦无腹泻者。家中近期曾购买、料理和食用禽畜类肉制品和海水产品。
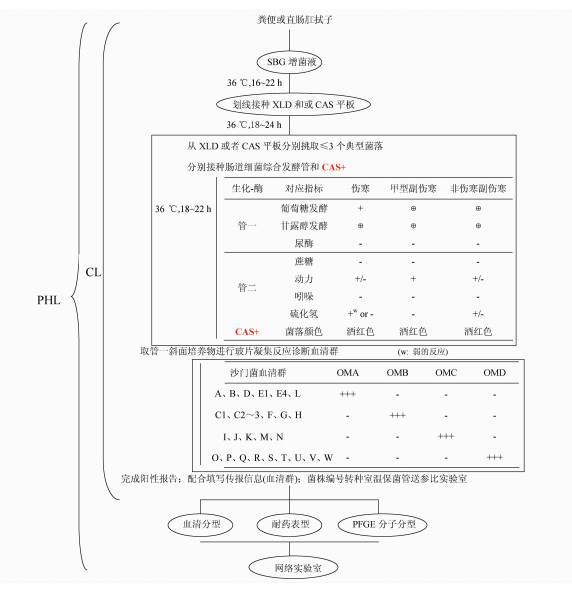
1.2 网络实验室病原学诊断与复核流程上海和睦家医院实验室按照临床实验室多病原检测程序分离并鉴定为鼠伤寒沙门菌感染[3],菌株由辖区内公共卫生实验室鉴定为乳糖发酵的鼠伤寒沙门菌,遂由区域性网络参比实验室验证分析血清型、耐药性、7种沙门菌选择性分离平板的典型菌落特征、分子型特征[4, 5]。
1.3 研究菌株2005-2012年上海市鼠伤寒沙门菌分子分型数据库:人源352株,环境食源69株,合计421株。大肠埃希菌ATCC25922和布伦登卢普沙门菌H9812分别是药敏试验和脉冲场凝胶电泳(PFGE)标准分子质量的质控菌株。
1.4 培养基和仪器改良亚硒酸盐磺绿增菌液(SBG)、CHROMagar®沙门菌显色琼脂平板(CAS);木糖赖氨酸脱氧胆酸盐琼脂平板(XLD);沙门菌-志贺菌琼脂平板(SS);丹麦SSI肠道菌琼脂平板(SSIEM);CHROMagar®plus沙门菌显色琼脂平板(CAS+);麦康凯(Mac)、亚硫酸铋琼脂平板(BS)、水解酪蛋白琼脂平板(MH)、沙门菌O和H相位鉴定与诱导琼脂平板、肠道双支糖综合鉴别管和系列生化鉴定管(上海科玛嘉微生物技术有限公司)、沙门菌分型血清145种(SSI,丹麦)、限制性内切酶XbaⅠ(TaKaRa,日本);低熔点琼脂糖(SeaKem Gold,Cambraex Bio Rockland,美国)。以上试剂和血清等均避光置10 ℃以下保存,有效期内使用。VitekAM-60自动生化鉴定仪和菌液比浊仪(生物梅里埃,法国);脉冲凝胶电泳仪(CHEF mapper system)和凝胶成像系统(GEL Doc2000,Bio-Rad,美国)。
1.5 抗生素敏感性试验药敏分配器和抗生素纸片[四环素(TET)、亚胺培南(IMP)、阿莫西林/克拉维酸(AMC)、氨苄西林(AMP)、复方新诺明(SXT)、环丙沙星(CIP)、氯霉素(C)、氧氟沙星(OFX)、萘啶酸(NA)、头孢吡肟(FEP)、头孢噻肟(CTX)、甲氧苄氨嘧啶(W)、头孢他啶(CAZ)、庆大霉素(CN)、磺胺异噁唑(S3)、链霉素(S)](Oxoid,英国);参照2012年CLSI(M-100)判别敏感(S)、中介(I)、耐药(R)。
1.6 PFGE按照PulseNet China技术方案规定的非伤寒沙门菌PFGE-XbaⅠ标准方法,完成沙门菌凝胶电泳并使用BioNumerics 6.0 软件进行聚类分析。
2 结果 2.1 病例治疗及预后患儿经医院会诊采取对症治疗措施(非抗生素治疗),医嘱1周后复诊。临床实验室在病程第4天报告检出鼠伤寒沙门菌。患者7 d后复诊症状自限,复查粪便培养为阴性。
2.2 药敏结果该菌株为多重耐药株:对TET、AMC、AMP、SXT、C、NA、W、CN、S3耐药,对CIP、S中介,对IMP、OFX、FEP、CTX、CAZ敏感。
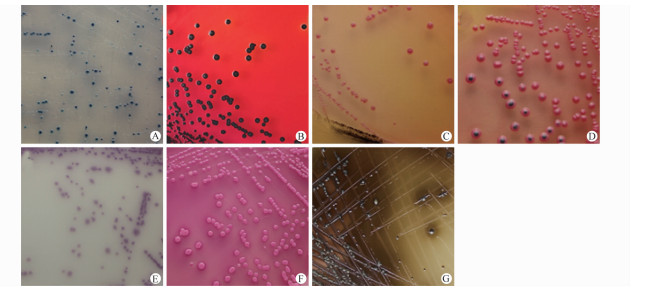
2.3 网络参比实验室复核结果该菌的血清型鉴定符合鼠伤寒沙门菌抗原表型,系统生化鉴定结果亦符合沙门菌属特征,乳糖发酵反应阳性;7种不同沙门菌选择性琼脂平板验证菌落特征:除XLD、CAS+和BS以外,其余平板均未见预期的典型沙门菌落生长,见图 1。
|
| 图 1 7种沙门菌选择性分离平板的典型菌落特征 Figure.1 The typical colony characteristics expected growth on Seven kinds of of Salmonella selectively medium 注:A:CAS:蓝色菌落(预期沙门菌落为酒红色);B:XLD:产硫化氢边缘淡红色菌落;C:SS:粉红色菌落(预期沙门菌落为产硫化氢边缘无色半透明);D:SSIEM:产硫化氢边缘红色菌落(预期沙门菌落为产硫化氢边缘无色不透明);E:CAS+:酒红色菌落;F:Mac:桃红色菌落(预期沙门菌落为无色半透明);G:BS:有金属光泽的棕黑色菌落。 |
通过沙门菌选择性琼脂平板(CAS)对乳糖发酵型沙门菌落的典型生长(敏感性特征)验证发现,乳糖发酵型沙门菌在原先设计的检测程序中存在漏检[3],同时鉴于乳糖发酵型沙门菌在CAS+平板上能够生长出预期的沙门菌典型菌落特征,故对原有分离流程给予补丁设计与优化,见图 2。
该菌经XbaⅠ酶切分型,录入本地鼠伤寒数据库(人源352株,环境食源69株,优势型谱命名对照国家数据库型谱编号),使用分析软件以5%误差值进行聚类绘图。422株鼠伤寒共分成171个带型,其中A和B分别构成优势克隆簇,克隆簇A的菌株间DNA相似度在85%,主要以1型(43株)、2型(19株)和5型(16株)为优势型;克隆簇B的菌株间DNA相似度在92%,由6型(48株)、49型(20株)为优势型。本次乳糖发酵鼠伤寒沙门菌的分子型为113型,属于一个新PFGE型,树状聚类图显示该菌的DNA遗传特征和克隆簇A菌株间具有85%的相似度(图 3)。

|
| 图 3 乳糖发酵的鼠伤寒沙门菌PFGE聚类分析 (限制性内切酶:XbaⅠ) Figure 3 Pulsed field gel electrophoresis patterns of lactose-fermenting Salmonella enterica serovar Typhimurium(restriction enzyme:Xba Ⅰ) |
已知沙门菌属中乳糖发酵的多为亚种Ⅲa或Ⅲb(即亚利桑那亚种),对人致病的多为乳糖阴性的亚种Ⅰ,其中乳糖发酵型的比例不足1%[6, 7]。1907-1975年,发现亚种Ⅰ的乳糖发酵型沙门菌在人、鸟、牛及肉奶制品皆有。1976年在澳大利亚发生乳糖发酵的鼠伤寒感染4日龄小牛犊导致动物疫情;1980年在欧洲波兰的新生儿、儿童的肠内、外标本也分离到此类菌,后证实1/3的腹泻样品中兼有乳糖表型各异的沙门菌型:阿贡纳、肠炎、奥雷宁堡、鼠伤寒和黄金海岸[7, 8]。自2005年以来,上海沙门菌监测网络实验室确认或报道的沙门菌变异型包括鼠伤寒粗糙型和乙型副伤寒单相变种、硫化氢阴性的山夫登堡[9, 10, 11]。但人源乳糖发酵型鼠伤寒沙门菌在本地区属首次发现。
乳糖发酵型沙门菌的筛检和选择性平板密切相关。国外报道用亚硫酸铋平板(BS)分离[8]。国内过去长期使用沙门菌/志贺菌平板(SS)因含有乳糖而必定漏检乳糖发酵型沙门菌,包括其漏检乳糖阳性的志贺菌Ⅰ型或宋内志贺菌等公认缺陷而在食品国家标准中被替换为XLD平板[3, 4]。本次发现的乳糖发酵型鼠伤寒虽源自XLD,但筛检流程中的CAS却未能验证预期菌落,若非临床实验室以系统生化确认,将难免漏检结局,所以有必要优化检测流程。CAS+是专为乳糖发酵型沙门菌而研发的新型显色平板,能获得高敏感性,其辛酸盐底物可保证所有沙门菌均能产生预期的酒红色菌落(图 1)[12]。已有研究支持CAS+作为确认沙门菌的材料使用[13]。所以,笔者从费效比和网络实验室能力建设角度提出优化原有的沙门菌检测流程,即便乳糖发酵型沙门菌的检出概率很低(图 3)。
PFGE是沙门菌监测网络实验室的核心技术。2001-2010年的国家数据库揭示全国鼠伤寒的分子流行病学特征:上海市和四川省的1型、上海市和广东省的2型、河南省和广东省的6型、上海市的49型均为全国的优势型[14, 15]。基于相同分型和命名法则构建的本地鼠伤寒数据库[5]:流行克隆簇A以1型和2型优势;克隆簇B中的6型和2010年广州市的婴幼儿腹泻株同型,自2010年开始在本地有渐增趋势、与49型皆属优势型。本次的乳糖发酵型鼠伤寒虽属新型,但其DNA遗传特征较克隆簇A有高同源性,应属进化变异。
沙门菌发酵乳糖常与lac基因及调控子突变有关,目前尚不知是何种因素促使细菌发生突变,但通常认为乳糖阴性的沙门菌具有更强的致病力。实验证实经过生物工程改造的乳糖发酵型沙门菌发生Ⅱ型毒力岛缺失而致使菌体的毒力下降[16, 17]。本次乳糖发酵的鼠伤寒沙门菌为多重耐药,说明乳糖表型的变异未影响到细菌的耐药特征,也有文献指出耐药性增加可能抑制肠道菌的侵袭能力[18, 19]。乳糖发酵株在遗传上源于本地鼠伤寒的流行克隆,表明某些优势克隆型易受环境(肠道微环境和抗生素耐药)等因素影响发生基因突变。本次感染患儿就诊点属涉外医院,其对感染性腹泻病例强调以实验室诊断为基础,且慎用抗生素的诊疗措施值得国内同行借鉴。
乳糖阳性的鼠伤寒沙门菌也许和农业养殖(如人工饲喂的牛)的动物疫病有关,目前暂时无病例证实可引发人类的暴发,但分离乳糖阳性沙门菌需要实验室使用更多的非常规选择性分离平板(如BS、CAS+)。国内曾有的乳糖阳性鼠伤寒院感病例报道经笔者验证,其SS分离株与本次的菌落特征不符,导致其乳糖假阳性结果可能和使用微量糖发酵管有关[20]。相对发达国家,国内沙门菌监测的能力建设起步较晚,但只要联合临床和公共卫生共同建立网络实验室共享优化流程即可分阶段完成能力建设,并不断发现新的沙门菌变异型[3, 8, 11]。
| [1] | Huang Z, Liu Y, Tang H, et al. Study on molecular epidemiology and antibiotic resistance of Salmonella Wandsworth[J]. Disease Surveillance, 2015,30(1):50-57. (in Chinese) 黄峥, 刘芸, 汤泓, 等.旺兹沃思沙门菌耐药分子流行病学特征研究[J]. 疾病监测, 2015,30(1):50-57. |
| [2] | Li YF, Xie XB, Xu XB, et al. Nontyphoidal Salmonella infection in children with acute gastroenteritis: prevalence, serotypes, and antimicrobial resistance in Shanghai, China[J]. Foodborne Pathog Dis, 2014,11(3):200-206. |
| [3] | Zhou YM, Chen XH, Xu W, et al. The fundamental role of stage control technology on the detectability for Salmonella networking laboratory[J]. Chinese Journal of Epidemiology, 2013,34(11):1105-1110. (in Chinese) 周永明, 陈秀华, 徐闻, 等.沙门菌常规检测方法分段控制技术在网络实验室构建中基础作用的评估[J]. 中华流行病学杂志, 2013,34(11):1105-1110. |
| [4] | Xu XB, Gu BK, Yang LP, et al. Comparison and application of five plating media for isolation of Salmonella species[J]. Chinese Journal of Health Laboratory Technology, 2005, 15(7):773-775. (in Chinese) 许学斌, 顾宝柯, 杨兰萍, 等.5种沙门菌分离培养基的应用和比较[J]. 中国卫生检验杂志, 2005, 15(7):773-775. |
| [5] | Xu XB, Jin HM, Xiao WJ, et al. Epidemiological characteristics and molecular typing of Salmonella typhimurium in Shanghai[J]. Shanghai Journal of Preventive Medicine, 2010,22(2):57-61. 许学斌, 金汇明, 肖文佳, 等.上海市鼠伤寒沙门菌流行特征及分子分型研究[J]. 上海预防医学, 2010,22(2):57-61. |
| [6] | Zhu C, Xu XB. Serological Diagnosis of Salmonella-Species[M]. Shanghai: Tongji University Press, 2009: 134-139. (in Chinese) 朱超, 许学斌.沙门菌属血清型诊断[M]. 上海: 同济大学出版社, 2009: 134-139. |
| [7] | Mcdonough PL, Shin SJ, Lein DH. Diagnostic and public health dilemma of lactose-fermenting Salmonella enterica serotype typhimurium in cattle in the northeastern United States[J]. J Clin Microbiol, 2000, 38(3):1221-1226. |
| [8] | Tyc Z, Szych J, Kałuzewski S, et al. Selection of methods of detecting lactose-fermenting Salmonella strains and evaluating their usefulness for diagnostic studies[J]. Med Dosw Mikrobiol, 1989, 41(2):106-114. |
| [9] | Cevallos-Cevallos JM, Gu GY, Danyluk MD, et al. Adhesion and splash dispersal of Salmonella enterica typhimurium on tomato leaflets: effects of rdar morphotype and trichome density[J]. Int J Food Microbiol, 2012,160(1):58-64. |
| [10] | Centers for Disease Control and Prevention. National antimicrobial resistance monitoring system for enteric bacteria (NARMS)[EB/OL].[2015-06-10]. 2010. http://www.cdc.gov/narms/. |
| [11] | Yi SJ, Xie J, Liu N, et al. Emergence and prevalence of Non-H2S-Producing Salmonella enterica serovar Senftenberg isolates belonging to novel sequence type 1751 in China[J]. J Clin Microbiol, 2014,52(7):2557-2565. |
| [12] | De Beaumont C, Breuil J, Dedicova D, et al. Evaluation of a new chromogenic medium, CHROMagarTM Salmonella Plus, for the detection of Salmonella spp[R]. Typhi S, Paratyphi S. Including lactose positive Salmonella, France ECCMID, 2006. |
| [13] | Luo ZY, Gu GY, Giurcanu MC, et al. Development of a novel cross-streaking method for isolation, confirmation, and enumeration of Salmonella from irrigation ponds[J]. J Microbiol Methods, 2014,101:86-92. |
| [14] | Yan MY. Lab Surveillance on Salmonella-molecular typing[R]. Shanghai: EID sub-project 6: 2010 annual conference. (in Chinese) 闫梅英.沙门菌实验室监测-分子分型[R]. 上海:2010年中美EID子项目6年会. |
| [15] | He DM, Ke BX, Deng XL, et al. Surveillance and analysis on the pathogenic features of Salmonella in Guangdong province in 2010[J]. Chinese Journal of Preventive Medicine, 2012,46(5):424-429. (in Chinese) 何冬梅, 柯碧霞, 邓小玲, 等.2010年广东省沙门菌监测及其病原学特征分析[J]. 中华预防医学杂志, 2012,46(5):424-429. |
| [16] | Eswarappa SM, Karnam G, Nagarajan AG, et al. Lac repressor is an antivirulence factor of Salmonella enterica: its role in the evolution of virulence in Salmonella[J]. PLoS One, 2009,4(6):e5789. |
| [17] | Jiang LY, Ni ZW, Wang L, et al. Loss of the lac operon contributes to Salmonella invasion of epithelial cells through derepression of flagellar synthesis[J]. Curr Microbiol, 2015,70(3):315-323. |
| [18] | Sengupta M, Austin S. Prevalence and significance of plasmid maintenance functions in the virulence plasmids of pathogenic bacteria[J]. Infect Immun, 2011,79(7):2502-2509. |
| [19] | Da Silva GJ, Mendonça N. Association between antimicrobial resistance and virulence in Escherichia coli[J]. Virulence, 2012,3(1):18-28. |
| [20] | Zhang JW, Li XB, Deng SJ, et al. The report of 10 cases nosocomial infection by lactose-fermenting Salmonella enterica serotype typhimurium[J]. Shanghai J Med Lab Sci, 2001, 16(3):156. (in Chinese) 张京文, 李显波, 邓书杰, 等.发酵乳糖的鼠伤寒沙门菌医院感染10例[J]. 上海医学检验杂志, 2001, 16(3):156. |
 2016, Vol. 31
2016, Vol. 31