扩展功能
文章信息
- 李欣悦, 李凤娟, 杜鹏程, 王瑞白, 王多春
- LI Xin-yue, LI Feng-juan, DU Peng-cheng, WANG Rui-bai, WANG Duo-chun
- rpoD和gyrA基因对气单胞菌鉴定的比较分析
- Comparative analysis of rpoD and gyrA gene in identification of Aeromonas
- 疾病监测, 2016, 31(3): 200-204
- Disease Surveillance, 2016, 31(3): 200-204
- 10.3784/j.issn.1003-9961.2016.03.006
-
文章历史
- 收稿日期: 2015-11-04
2. 河南省疾病预防控制中心, 河南郑州 450016;
3. 北京市地坛医院, 北京 100011
2. Henan Provincial Center for Disease Control and Prevention, Zhengzhou 450016, Henan, China;
3. Beijing Ditan Hospital Capital Medical University, Beijing 100011, China
气单胞菌为氧化酶阳性,能发酵葡萄糖,兼性厌氧的革兰阴性杆菌。气单胞菌在自然界尤其是水环境中广泛存在。该属细菌常引起一些感染性疾病,如腹泻、菌血症和软组织的感染[1]。目前,已经明确鉴定的种有26个[2],腹泻患者最常见的是嗜水气单胞菌(Aeromonas hydrophila),豚鼠气单胞菌(Aeromonas caviae)和维氏气单胞菌温和生物变种(Aeromonas veronii bv. sobria)[3]。
常用的鉴定气单胞菌的方法是系统生化和分子生物学技术。系统生化(如API20E)已被广泛使用,该方法对气单胞菌属常见的嗜水气单胞菌、豚鼠气单胞菌、维氏气单胞菌温和生物变种具有快速的诊断价值[4]。但由于气单胞菌属的新种不断被发现,以及部分气单胞菌不同种间的表型非常相似,生化方法不能对部分种进行准确鉴定。分子生物学技术的不断发展,为新种的发现和鉴定提供了新的技术和方法,16S rRNA序列分析已经成为研究细菌亲缘关系的常用方法之一,但因较高的保守性,使得其对亲缘关系比较近的细菌区分能力有限。相对保守又有一定变异率并能很好区分气单胞菌属内物种的已报道过的管家基因的有rpoD、gyrB、recA、rpoB、dnaJ和gyrA基因[5, 6, 7],其中rpoD基因已被广泛应用于气单胞菌属的单基因分型[8]。gyrA基因已用于气单胞菌的多位点系统进化分析,但并未作为分子指标单独用于对气单胞菌分型,有文献报道,gyrA基因可单独作为一个有效的分子指标用于枯草芽孢杆菌的快速鉴定和种的分类[9]。
本研究对生化鉴定为气单胞菌的共187株菌株分别进行rpoD和gyrA基因测序及分析,比较两者对气单胞菌的单基因分型能力,同时对使用菌株获得较为准确的种水平的鉴定。
1 材料与方法 1.1 实验菌株本研究选取本实验室保存的气单胞菌187株,2013-2015年北京、上海和安徽等地的患者粪便标本。经生化方法(API20E)鉴定为气单胞菌:嗜水气单胞菌95株,维氏气单胞菌温和生物变种64株,豚鼠气单胞菌28株。患者年龄在1~82岁之间,平均年龄为42±19岁,其中男性105人,女性82人。患者因腹泻入院接受治疗。
1.2 主要试剂及实验仪器2×Taq PCR MasterMix(天根科技有限公司),GoldView DNA染料(北京赛百盛),氯化钠(北京化工厂),细菌基因组提取试剂盒(QIAGEN,德国)。PTC-200型PCR扩增仪(MJ RESEARCH,美国),凝胶成像仪、电泳仪(BIO-RAD,美国)。引物由上海生工生物技术有限公司合成。
1.3 菌株培养及DNA的提取用接种环挑取普通琼脂平板上新鲜培养的单菌落1~2个,至5 ml液体LB培养基中,置37 ℃,250 r/min,振荡培养16~18 h,达到108 cfu/ml数量级,取1 ml菌液于1.5 ml EP管中,12 000 r/min离心2 min收集菌体。用细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit,天根生化科技有限公司)进行菌株DNA的提取,按试剂盒说明进行操作,提取的DNA用作聚合酶链反应(PCR)的模板,-20 ℃保存备用。
1.4 气单胞菌rpoD和gyrA基因的种特异性参比序列在美国国立生物技术中心(NCBI,http://www.ncbi.nlm.nih.gov)网站上,分别下载气单胞菌属每个种的rpoD及gyrA基因标准参考序列,共26个种的序列作为参比序列(表 1)。
| 气单胞菌种(英文) | 气单胞菌种(中文) | rpoD GenBank编号 | gyrA GenBank编号 |
| A.allosaccharophila | 异嗜糖气单胞菌 | HQ442836 | HQ442836 |
| A.aquariorum | 水族馆气单胞菌 | HQ442802 | HQ442802 |
| A.bestiarum | 兽气气单胞菌 | HQ442857 | HQ442857 |
| A.bivalvium | 贝壳气单胞菌 | HQ442817 | HQ442817 |
| A.cavernicola | 洞穴气单胞菌 | HQ442864 | HQ442864 |
| A.caviae | 豚鼠气单胞菌 | HQ442790 | HQ442790 |
| A.diversa | 异样气单胞菌 | HQ442806 | HQ442806 |
| A.encheleia | 鳗鱼气单胞菌 | HQ442780 | HQ442780 |
| A.enteropelogenes | 肠棕气单胞菌 | HQ442820 | HQ442820 |
| A.eucrenophila | 嗜矿泉气单胞菌 | HQ442773 | HQ442773 |
| A.fluvialis | 河流气单胞菌 | FJ603453 | FJ603453 |
| A.hydrophila | 嗜水气单胞菌 | HQ442795 | HQ442795 |
| A.jandaei | 简氏气单胞菌 | HQ442838 | HQ442838 |
| A.media | 中间气单胞菌 | HQ442784 | HQ442784 |
| A.molluscorum | 软体动物气单胞菌 | HQ442815 | HQ442815 |
| A.piscicola | 鱼蛭气单胞菌 | HQ442860 | HQ442860 |
| A.popoffii | 疱氏气单胞菌 | HQ442849 | HQ442849 |
| A.rivuli | 溪流气单胞菌 | FJ969437 | FJ969437 |
| A.salmonicida | 杀鲑气单胞菌 | HQ442846 | HQ442846 |
| A.sanarellii | 圣雷利气单胞菌 | FJ472929 | FJ807276 |
| A.schubertii | 舒氏气单胞菌 | HQ442807 | HQ442807 |
| A.simiae | 猿猴气单胞菌 | GQ860943 | GQ860943 |
| A.sobria | 温和气单胞菌 | HQ442868 | HQ442868 |
| A.taiwanensis | 台湾省气单胞菌 | FJ472928 | FJ472928 |
| A.tecta | 泰塔气单胞菌 | HQ442764 | HQ442764 |
| A. veroniibv. sobria | 维氏气单胞菌温和生物变种 | HQ442835 | HQ442835 |
采用rpoD基因引物(5′-GAA GGC GAA ATC GAC ATC GC-3′,5′-ATG CTC ATG CGR CGG TTG AT-3′)和gyrA基因引物(5′-ATG AGC GAT CTG GCC AGA GA-3′,5′-CGC GCC TTG TTC ACC TGA TA-3′)[5],分别进行rpoD和gyrA基因扩增并测序。PCR产物长度分别为760 bp(rpoD)和815 bp(gyrA)。反应体系(50 μl)为:2×Taq PCR MasterMix 25 μl,上下游引物(10 μmol/L)各1.5 μl,DNA模板1.5 μl,其余用水补足。扩增条件:94 ℃预变性5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,进行30个循环,最后72 ℃延伸7 min。PCR扩增结束后,PCR产物上样于1.0%的琼脂糖凝胶中进行电泳和读胶,验证其片段大小。阳性产物送商业公司进行双向测序,测序结果采用DNAstar软件BioEdit和Seqman(Ibis Biosciences,Carlsbad,CA,USA)进行剪切和拼接。获得的序列与参比序列一起,用Mega 5.0 软件采用最大似然法构建系统进化树,核苷酸替代模型选择Kimura双参数模型,Bootstrap值为1000(一般500次以上即认为较可靠),其他参数使用软件默认设置。当测试序列与26个种的某个参比序列聚类在同一个进化树分支时,则将此测试序列代表的菌株鉴定为该种气单胞菌,当测试序列与26个种的参比序列都不能聚类在一个进化树分支时,则将此测试序列代表的菌株定义为未定种。
2 结果根据构建的系统进化树结果,rpoD基因将187株气单胞菌鉴定为7个种(图 1A),而gyrA基因将这些菌株鉴定为9个种和1个未定种(图 1B)。两者鉴定最多的3个种均为维氏气单胞菌温和生物变种\豚鼠气单胞菌和水族馆气单胞菌。
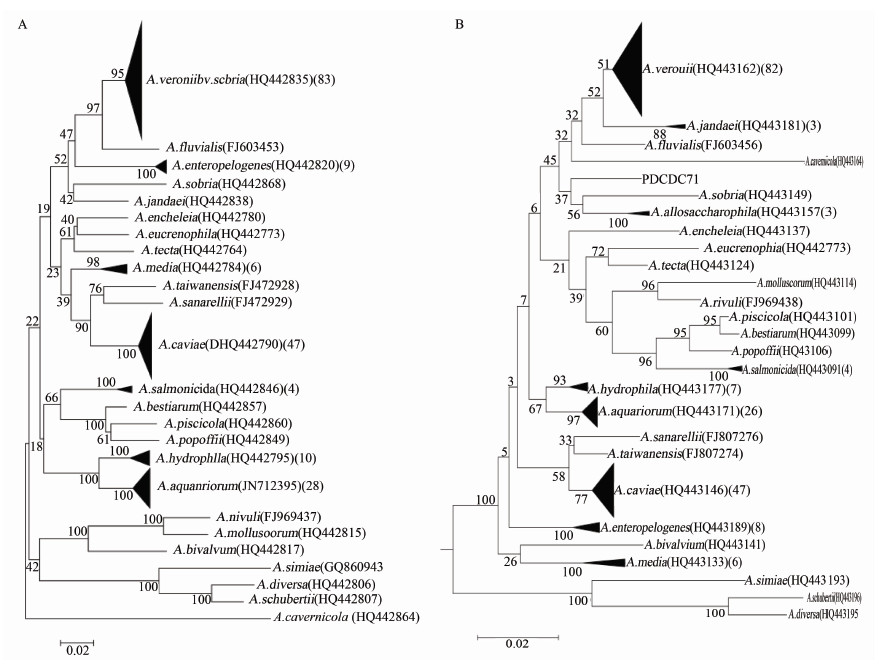
|
| 注:图中列出的是菌名,括号内为每个参考序列的GenBank号,第2个括号内数字表示本研究菌株鉴定为该种的数量。 图 1 187株菌的rpoD(A)和gyrA(B)基因序列系统发育树 Figure 1 Phylogenetic tree of 187 Aeromonas and reference strains based on rpoD(A) and gyrA(B) genes sequences |
rpoD和gyrA基因对187株气单胞菌分类的对应关系见表 2。两者鉴定一致的菌株有174株(93%),其中,两者对豚鼠气单胞菌、中间气单胞菌、杀鲑气单胞菌3个种的菌株鉴定完全一致(100%),对维氏气单胞菌温和生物变种、水族馆气单胞菌和肠棕气单胞菌的鉴定有较高的一致性,但两者对嗜水气单胞菌的鉴定一致性较低,只有60%。在13株(7%)鉴定不一致的菌株中,经rpoD基因鉴定为维氏气单胞菌温和生物变种的6株菌,经gyrA基因分别鉴定为简氏气单胞菌(3株)、异嗜糖气单胞菌(2株)和未定种(1株)。2株水族馆气单胞菌分别鉴定为1株维氏气单胞菌温和生物变种和1株嗜水气单胞菌。2株嗜水气单胞菌则鉴定为维氏气单胞菌温和生物变种和异嗜糖气单胞菌。另有1株肠棕气单胞菌鉴定为维氏气单胞菌温和生物变种。
| rpoD鉴定结果 | gyrA鉴定结果 | 菌株数 | 百分比(%) |
| 一致菌株 (n=174) | |||
| 维氏气单胞菌温和生物变种 | 维氏气单胞菌温和生物变种 | 77 | 92.8 |
| 豚鼠气单胞菌 | 豚鼠气单胞菌 | 47 | 100.0 |
| 水族馆气单胞菌 | 水族馆气单胞菌 | 26 | 92.9 |
| 嗜水气单胞菌 | 嗜水气单胞菌 | 6 | 60.0 |
| 肠棕气单胞菌 | 肠棕气单胞菌 | 8 | 88.9 |
| 中间气单胞菌 | 中间气单胞菌 | 6 | 100.0 |
| 杀鲑气单胞菌 | 杀鲑气单胞菌 | 4 | 100.0 |
| 不一致菌株 (n=13) | |||
| 维氏气单胞菌温和生物变种 | 简氏气单胞菌 | 3 | 3.6 |
| 维氏气单胞菌温和生物变种 | 异嗜糖气单胞菌 | 2 | 2.4 |
| 维氏气单胞菌温和生物变种 | 未知 | 1 | 1.2 |
| 水族馆气单胞菌 | 维氏气单胞菌温和生物变种 | 1 | 3.6 |
| 水族馆气单胞菌 | 嗜水气单胞菌 | 1 | 3.6 |
| 嗜水气单胞菌 | 维氏气单胞菌温和生物变种 | 3 | 30.0 |
| 嗜水气单胞菌 | 异嗜糖气单胞菌 | 1 | 10.0 |
| 肠棕气单胞菌 | 维氏气单胞菌温和生物变种 | 1 | 11.1 |
在实验室检测中,气单胞菌属的细菌不难从临床粪便标本中分离,但经常被错误鉴定为弧菌属或邻胞菌属[1]。为了避免与其他菌属细菌混淆,通过检测气单胞菌属共有的甘油磷脂胆固醇酰基转移酶(GCAT)基因保守区来鉴定气单胞菌属比较准确可靠[10]。由于气单胞菌属的细菌表型和基因型的异质性,对其在种水平上鉴定尤为复杂[1]。对气单胞菌表型鉴定的主要瓶颈在于,常规生化实验缺乏统一的方法和条件[4],而且商品化的生化鉴定系统对于气单胞菌种水平鉴定的准确性也没有明显改善[11]。分子检测技术的应用使得气单胞菌属的环境和临床分离株获得了更好的分类,但同时也表明生化分型和基因分型结果存在差异[10]。文献报道过的基于16S rRNA基因限制性片段长度多态性分型的方法能够对截止到2000年以前发现的气单胞菌种进行鉴定[12]。但这个方法的缺陷在于会产生非典型的限制性图谱,这种非典型图谱的产生可能表明这是未报道过的新种,另一种可能是同种不同株细菌存在差异性,从而影响气单胞菌株的准确鉴定。1997年之前的15个气单胞菌种主要以生化表型结合DNA分型(HG型)鉴别为主[1],自2002年起逐渐流行基于分子系统发育分析比对方法鉴定气单胞菌,主要有16S rRNA基因序列和管家基因序列分析。但气单胞菌属的16S rRNA基因序列高度保守,亦存在基因的多拷贝现象,限制了其在气单胞菌种的应用,管家基因序列分析在气单胞菌种水平鉴定上,得到了广泛应用[13]。本研究中用到的rpoD基因编码RNA聚合酶sigama70因子,gyrA基因编码DNA促旋酶A亚单位,为两个保守的管家基因,存在于所有细菌中[5]。本研究中,187株腹泻患者来源的气单胞菌经两种基因鉴定后一致的菌株是174株(93%),不一致菌株13株(7%),鉴定一致率较高,说明大部分菌株能单独使用rpoD或gyrA基因进行准确分类。rpoD基因将菌株鉴定为7个种,经gyrA基因鉴定为9个种,还有一株未定种。增加的两个种是异嗜糖气单胞菌和简氏气单胞菌,而rpoD基因的局限正是不能很好的区分异嗜糖气单胞菌以及维氏气单胞菌温和生物变种[5],所以笔者的研究结果表明在鉴定气单胞菌的这两个种上,gyrA基因是优于rpoD基因的分类方法。另据报道,rpoD基因能很好的区分杀鲑气单胞菌和兽气气单胞菌[14]。杀鲑气单胞菌是鲑科鱼类“疥疮病”、“败血症”和皮肤溃烂病的主要病原菌,导致渔业的巨大经济损失[6],因此准确鉴定此菌种,防治其引起的感染,对于渔业的持续发展有至关重要的作用。本研究中rpoD和gyrA基因均有4株鉴定为杀鲑气单胞菌,无兽气气单胞菌,鉴定结果一致,说明gyrA基因在这两个种的鉴别上,和rpoD基因具有相同的优势。两者对豚鼠气单胞菌和中间气单胞菌的鉴定结果也完全一致,表明对这两个种的鉴定,选择其中一个即可。对于13株不一致的菌株,不能明确两种基因鉴定结果中哪种更准确,因此不建议采用一个管家基因进行分类,综合多个管家基因的序列分析,或者做多位点系统进化分析能更好地区分相近的菌种。尽管气单胞菌属的gyrA基因序列相比rpoD基因序列更保守[5],但笔者的研究表明,gyrA基因序列用来对气单胞菌属的细菌进行分类和进化分析是有效的,甚至在对某些种的分类上优于rpoD基因。
本研究中的187株气单胞菌经生化方法鉴定最多的是嗜水气单胞菌(95株),其次是维氏气单胞菌温和生物变种(64株)和豚鼠气单胞菌(28株)。管家基因鉴定方法最多的3个种分别为维氏气单胞菌温和生物变种、豚鼠气单胞菌和水族馆气单胞菌,而嗜水气单胞菌则排在水族馆气单胞菌之后。水族馆气单胞菌与嗜水气单胞菌和豚鼠气单胞菌同源性较近,但由于传统生化方法的缺陷,临床上常将水族馆气单胞菌错误鉴定为嗜水气单胞菌[15]。有研究显示,临床分离的水族馆气单胞菌对血细胞系有极强的毒活性[16],对肠细胞也有毒作用[17],因此准确鉴定水族馆气单胞菌具有一定的临床意义。由于气单胞菌属的多个种能导致人类疾病,有必要对其在种的水平上进行快速准确鉴定,应采用管家基因鉴定的方法。
本研究比较了基于rpoD和gyrA基因序列分析,对气单胞菌进行种水平分类的方法。结合rpoD和gyrA基因序列分析,能够对绝大多数的气单胞菌进行分类和鉴定。本文的局限性在于,rpoD和gyrA基因鉴定仍有部分菌株鉴定不一致,对于这些菌株,应增加管家基因进行分析。
| [1] | Janda JM, Abbott SL. The genus Aeromonas:taxonomy, pathogenicity, and infection[J]. Clin Microbiol Rev,2010,23(1):35-73. |
| [2] | Parker JL, Shaw JG. Aeromonas spp. clinical microbiology and disease[J]. J Infect,2011,62(2):109-118. |
| [3] | Figueras MJ, Alperi A, Saavedra MJ, et al. Clinical relevance of the recently described species Aeromonas aquariorum[J]. J Clin Microbiol,2009,47(11):3742-3746. |
| [4] | Abbott SL, Cheung WKW, Janda JM. The genus Aeromonas:biochemical characteristics, atypical reactions, and phenotypic identification schemes[J]. J Clin Microbio,2003,41(6):2348-2357. |
| [5] | Martinez-Murcia AJ, Monera A, Saavedra MJ, et al. Multilocus phylogenetic analysis of the genus Aeromonas[J]. Syst Appl Microbiol,2011,34(3):189-199. |
| [6] | Khor WC, Puah SM, Tan JA, et al. Phenotypic and genetic diversity of Aeromonas species isolated from fresh water lakes in malaysia[J]. PLoS One,2015,10(12):e0145933. |
| [7] | Miñana-Galbis D, Farfán M, Albarral V, et al. Reclassification of Aeromonas hydrophila subspecies anaerogenes[J]. Syst Appl Microbiol,2013,36(5):306-308. |
| [8] | Senderovich Y, Ken-Dror S, Vainblat I, et al. A molecular study on the prevalence and virulence potential of Aeromonas spp. Recovered from patients suffering from diarrhea in Israel[J]. PLoS One,2012,7(2):e30070. |
| [9] | Chun J, Bae KS. Phylogenetic analysis of Bacillus subtilis and related taxa based on partial gyrA gene sequences[J]. Antonie Van Leeuwenhoek,2000,78(2):123-127. |
| [10] | Beaz-Hidalgo R, Alperi A, Buján N, et al. Comparison of phenotypical and genetic identification of Aeromonas strains isolated from diseased fish[J]. Syst Appl Microbiol,2010,33(3):149-153. |
| [11] | Lamy B, Laurent F, Verdier I, et al. Accuracy of 6 commercial systems for identifying clinical Aeromonas isolates[J]. Diagn Microbiol Infect Dis,2010,67(1):9-14. |
| [12] | Figueras MJ, SoleL, Chacón MR, et al. Extended method for discrimination of Aeromonas spp. by 16S rDNA RFLP analysis[J]. Int J Syst Evol Microbiol,2000,50(6):2069-2073. |
| [13] | Nhung PH, Hata H, Ohkusu K, et al. Use of the novel phylogenetic marker dnaJ and DNA-DNA hybridization to clarify interrelationships within the genus Aeromonas[J]. Int J Syst Evol Microbiol,2007,57(6):1232-1237. |
| [14] | Soler L, Yáiñez MA, Chacon MR, et al. Phylogenetic analysis of the genus Aeromonas based on two housekeeping genes[J]. Int J Syst Evol Microbiol,2004,54(5):1511-1519. |
| [15] | Aravena-Román M, Harnett GB, Riley TV, et al. Aeromonas aquariorum is widely distributed in clinical and environmental specimens and can be misidentified as Aeromonas hydrophila[J]. J Clin Microbiol,2011,49(8):3006-3008. |
| [16] | Morinaga Y, Yanagihara K, Eugenin FL, et al. Identification error of Aeromonas aquariorum:a causative agent of septicemia[J]. Diagn Microbiol Infect Dis,2013,76(1):106-109. |
| [17] | Wu CJ, Tsai PJ, Chen PL, et al. Aeromonas aquariorum septicemia and enterocolitis in a cirrhotic patient[J]. Diagn Microbiol Infect Dis,2012,74(4):406-408. |
 2016, Vol. 31
2016, Vol. 31


