扩展功能
文章信息
- 杜春红, 尹家祥, 栗冬梅, 王秀芳, 程晓藕, 杨光璨, 刘正祥
- DU Chun-hong, YIN Jia-xiang, LI Dong-mei, WANG Xiu-fang, CHENG Xiao-ou, YANG Guang-can, LIU Zheng-xiang
- 滇西地区室内鼠形动物巴尔通体感染情况调查研究
- Investigation of Bartonella infection in small rodents in households in western Yunnan
- 疾病监测, 2016, 31(3): 220-224
- Disease Surveillance, 2016, 31(3): 220-224
- 10.3784/j.issn.1003-9961.2016.03.010
-
文章历史
- 收稿日期: 2015-08-13
2. 大理大学公共卫生学院, 云南大理 671000;
3. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. Public Health School, Dali University, Dali 671000, Yunnan, China;
3. Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China
巴尔通体(Bartonella species)是一种可通过吸血节肢动物在脊椎动物间传播的病原微生物,在目前发现的24种及亚种的巴尔通体中,至少有12种可引起人类疾病[1]。该病临床表现复杂多样,可累及全身各器官和系统。如猫抓病(cat-scratch disease,CSD)、战壕热(trench fever)、Carrion病、杆菌性血管瘤(bacillary angiomatosis,BA)、心内膜炎等。既往调查表明,云南省巴尔通体呈高度流行态势,并具有宿主多样性及基因型别多样性特征。其中鼠形动物的感染率较高[2, 3, 4]。云南西部地区地形复杂,立体气候明显,造就了媒介生物多样性较高的区域特征,也是鼠传疾病高发地区,为进一步了解该区域内与人类密切接触的室内鼠形动物巴尔通体的感染情况,本研究对滇西10县、市20个自然村室内的鼠形动物感染情况进行调查研究。
1 材料与方法 1.1 标本采集在滇西地区的8个州(市)抽取德钦、玉龙、兰坪、永仁、祥云、南华、耿马、云县、芒市、隆阳区10个县(市、区),每个县(市、区)选择4个自然村,对每个自然村的全部住户进行编号,根据编号随机抽取20户家庭,共计800个家庭进行调查[5]。以笼夜法进行捕鼠,每户放置5个鼠笼,连续放3夜,每天检查。如有捕获则更换新笼继续放置。捕获的动物带回实验室进行种类鉴定和采集脏器组织材料。
1.2 试剂和设备血液组织DNA提取试剂盒(Qiagen DNeasy Blood & Tissue Kit),2×Taq MasterMix(TaKaRa),100 bp ladder Marker(Biomed),引物由北京天一辉远生物技术有限公司合成。高通量组织研磨仪(德国Retsch,MM400型)、水平电泳槽JY-SPFT型、PCR仪(德国SENSO,LabCycler Gradient Fuses型),成像仪(美国Syngene,G:Box)。
1.3 样品DNA提取取10 mg左右脾脏组织研磨后,按照Qiagen试剂盒说明书逐步提取DNA。
1.4 实验室检测以提取的DNA为模板,应用聚合酶链反应(PCR)扩增巴尔通体柠檬酸合成酶基因(citrate synthase gene,gltA),所用引物为BhCS781.p:5′-GGG GAC CAG CTC ATG GTG G-3′;BhCS1137.n:5′-AAT GCA AAA AGA ACA GTA AAC A-3′,扩增长度379 bp。PCR反应体系50 μl,DNA模板3.0 μl,10 μmol/L引物1.0 μl。PCR反应条件:94 ℃预变性3 min,30个循环包括94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,最后72 ℃总延伸5 min。PCR产物用1.5%的琼脂糖凝胶电泳后凝胶成像仪观察结果。每次实验均设立空白对照,为避免标本污染所造成的假阳性,DNA模板的提取、反应体系的配制、模板的添加、PCR的扩增均在不同的房间进行。
1.5 序列测定与分析PCR产物送北京擎科新业生物技术有限公司测序。登录美国国家生物技术信息中心(NCBI)站点,利用“Blast Sequence Similarity Searching”工具将测序结果与GenBank中注册基因序列进行同源性比对。采用Lasergene软件包的MegAlign程序进行序列比对。应用Mega 6.06软件,邻接法Neighbor-Joining、Kimura 2-parameter model、bootstrap 1000构建系统发育树。
2 结果 2.1 标本采集情况本次调查共捕获鼠形动物421只,分属于2目2科6属9种,采集有效脏器样本404份,其中黄胸鼠269份(66.58%),小家鼠75份(18.56%),褐家鼠23份(5.69%),大足鼠23份(5.69%),臭鼩鼱7份,齐氏姬鼠2份,短尾鼩2份,灰麝鼩2份,卡氏小鼠1份。
2.2 PCR扩增结果共检测出巴尔通体gltA基因阳性65份,经测序分析,64份为巴尔通体序列,阳性率为15.84%。部分阳性扩增产物电泳图见图 1。按采样点经纬度、不同鼠种捕获和检出情况进行比较,发现不同采样点的优势鼠种不同,仅黄胸鼠和褐家鼠检出阳性,黄胸鼠阳性率最高(62/269,23.05%),褐家鼠仅检出2份(8.70%,2/23)。经χ2检验分析,2种鼠的阳性率差异无统计学意义(χ2=1.781,P=0.1821)。从地域上看,在表 1中从德钦至耿马纬度逐渐降低,在纬度稍高的德钦、玉龙、兰坪、永仁、祥云和南华6个县仅检出3份阳性。检出阳性最多的芒市,该地也是鼠密度最高、黄胸鼠密度最高的地区。永仁县鼠密度也高,均为小家鼠,未检出阳性。
|
| 注:M:DNA相对分子质量标准;PC:阳性对照;NC:空白对照 图1 gltA基因片段的凝胶电泳结果 Figure 1 Gel electrophoresis image of amplified gltA partial sequence |
| 采样点 | 黄胸鼠 | 褐家鼠 | 小家鼠 | 大足鼠 | 其他鼠种 | 总计 | |||||||
| 样本数 | 阳性数 | 样本数 | 阳性数 | 样本数 | 阳性数 | 样本数 | 阳性数 | 样本数 | 阳性数 | 样本数 | 阳性数 | 阳性率(%) | |
| 德钦县 | - | - | - | - | - | - | 16 | 0 | - | - | 16 | 0 | 0.00 |
| 玉龙县 | 16 | 1 | 2 | 0 | - | - | - | - | 2 | 0 | 20 | 1 | 5.00 |
| 兰坪县 | 17 | 0 | 4 | 0 | - | - | 1 | 0 | - | - | 22 | 0 | 0.00 |
| 永仁县 | 4 | 0 | 2 | 0 | 72 | 0 | 6 | 0 | 1 | 0 | 85 | 0 | 0.00 |
| 祥云县 | 17 | 0 | 15 | 2 | - | - | - | - | 1 | 0 | 33 | 2 | 6.06 |
| 南华县 | 36 | 0 | - | - | - | - | - | - | - | - | 36 | 0 | 0.00 |
| 隆阳区 | 23 | 6 | - | - | - | - | - | - | 4 | 0 | 27 | 6 | 22.22 |
| 芒市县 | 94 | 35 | - | - | - | - | - | - | 6 | 0 | 100 | 35 | 35.00 |
| 云县县 | 37 | 11 | - | - | - | - | - | - | - | - | 39 | 11 | 28.21 |
| 耿马县 | 25 | 9 | - | - | - | - | - | - | - | - | 26 | 9 | 34.62 |
| 合计 | 269 | 62 | 23 | 2 | 75 | 0 | 23 | 0 | 14 | 0 | 404 | 64 | 15.84 |
| 注:其他鼠种包括臭鼩鼱7份,齐氏姬鼠2份,短尾鼩2份,灰麝鼩2份,卡氏小鼠1份。 | |||||||||||||
对阳性标本gltA基因262 bp序列进行分析,结果显示变异较大,核苷酸同源性为88.2%~100%,氨基酸同源性为93.1%~100%。与目前已知巴尔通体比较,其核苷酸同源性为88.2%~99.6%,氨基酸同源性为87.4%~100%。基于gltA基因的262 bp序列进行系统发育分析,结果显示滇西地区至少存在6种基因型的巴尔通体(图 2),其中,绝大多数毒株与B.tribocorum同源关系最近(A),主要分布在芒市、云县、耿马、隆阳区;11个毒株与B.queenslandensis拥有共同的进化祖先(B),可能属于B.queenslandensis型,主要分布在耿马、芒市、云县、玉龙;两株(260和278)与B.elizabethae同源关系最近(C),主要分布在芒市;另外11个毒株则形成了一个不同于所有已知巴尔通体的独立进化分支(D),推测他们可能属于一种新的巴尔通体。312号样本分布在芒市,它与B.rattaustraliani、B.coopersplainsensis、B.japonica的同源关系较近,但又形成一个独立分支,推测这也可能是一个新的基因型。此外,还有两个毒株(331和304)与B.rochalimae拥有共同的进化祖先(E),属于B.rochalimae型,主要分布在芒市。结果显示芒市毒株基因型较为复杂,6种均存在,以A群为主,两个可能的新型也分布于该地。
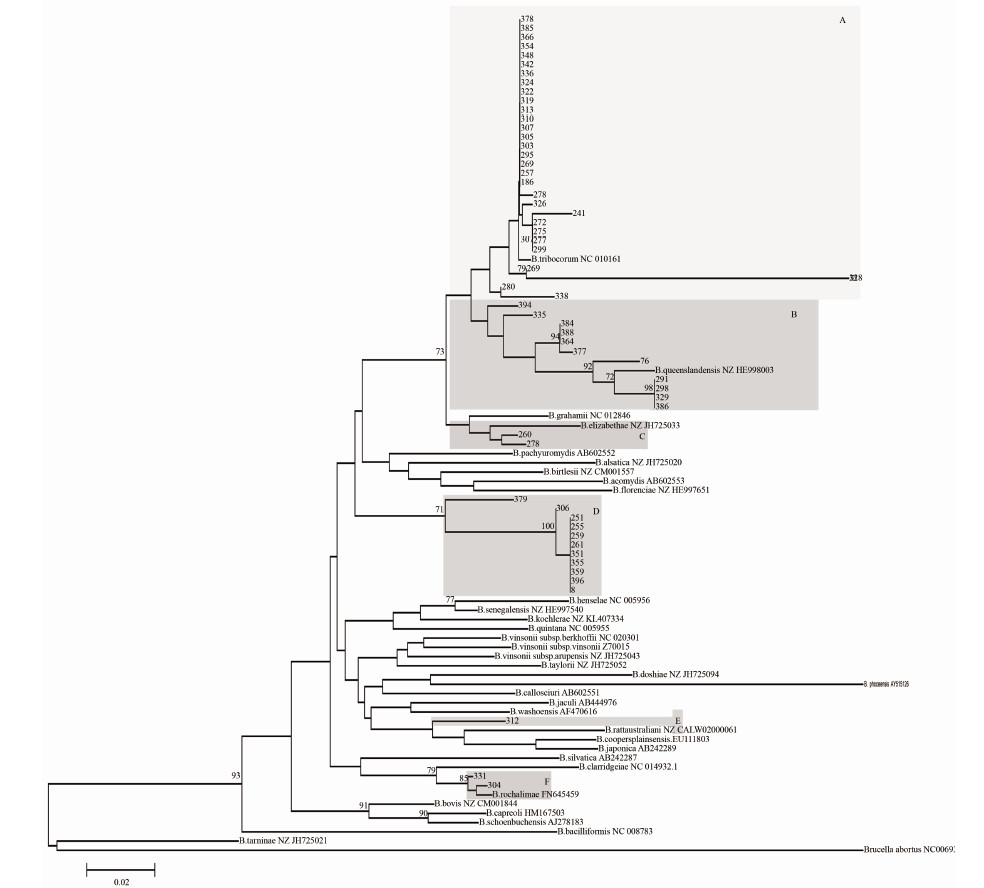
|
| 图2 基于巴尔通体gltA基因部分测序结果的进化分布 Figure 2 Phylogenetic analysis based on partial gltA gene of Bartonella |
小型兽类动物是巴尔通体最主要的自然宿主之一,也是最大的储存宿主群[6, 7]。国外调查显示其带菌率很高,英格兰62.2%、美国东南部42.7%、美国西北部33.3%[1]。到目前为止,国内已有15种小型兽动物检测到巴尔通体。云南省自1999年以来进行了多次的调查研究,证实巴尔通体在小型兽中普遍存在,平均阳性率14.0%~44.3%。并先后从5属11种小型兽及其寄生蚤中分离到菌株[8, 9]。呈现出不同地理和气候环境具有广泛适应性及宿主多样性特征。人类可能因与携带病原体的动物接触而感染或致病。居民区,尤其是农村居民区鼠形动物分布广泛,人被感染的风险更高。滇西地区是鼠疫、肾综合征出血热等鼠传疾病高发地区,本调查对该地区10县(市、区)的800户居民家中捕获的404份鼠形动物脏器进行巴尔通体gltA基因检测,结果6县(市)中检出阳性。其中芒市、云县、耿马、隆阳区的阳性率均在20%以上,比既往同地区阳性率略低[10]。可能与本次采样仅限于居民区、鼠种单一有关。在被检的9种小型兽中仅有黄胸鼠和褐家鼠检出阳性。黄胸鼠为阳性点的优势鼠种,也是阳性率最高的鼠种,与既往调查一致。阳性点黄胸鼠和褐家鼠为主要鼠种,且鼠密度、染蚤率、蚤指数均较高,主要蚤种为猫栉首蚤、缓慢细蚤、印鼠客蚤[11]。这些蚤种均有携带巴尔通体的分子证据。因此这些地区人群受巴尔通体感染的风险较高。同时,滇西地区也是重要的鼠疫疫源地,在鼠疫防治工作中进行的灭鼠灭蚤活动对巴尔通体的防治同样有意义。
在巴尔通体的分子生物学检测方法中,gltA的扩增较为常用,具有属水平特异性,是一种方便、快捷的检测方法。同源性较高的根癌土壤杆菌(Agrobacterium tumefaciens)及其他一些细菌均无扩增产物,国外被广泛地应用于巴尔通体的实验室诊断和调查研究[12]。国内栗冬梅等[13]、杨发莲等[14]从严重污染的血液标本、蚤中可扩增到该基因片段,证实是一种检测巴尔通体的有效方法。因此,本调查采用扩增gltA的方法对样本进行检测。结果表明,该方法是检测巴尔通体感染的较好手段。在巴尔通体家族中,目前发现的有24种及亚种,近年来还不断有新种被发现。既往调查表明,云南省巴尔通体呈现系统发育多样性、有特异性和有新型的特征。杨发莲等[9]对分离自云南的32株菌进行系统发育多样性分析,云南菌株可分为7个型,其中1个为云南特有新型。栗冬梅、白瑛等的研究也证实云南巴尔通体存在多样性,并有潜在新种。其中家鼠感染的巴尔通体主要分为3型:B.tribocorum、B.elizabethae和B.yunnannensis[4]。本次检出的阳性样品经测序后作同源性比对,构建系统发育树。结果发现他们变异度较大,至少可以分为6种基因型,除了B.tribocorum、B.elizabethae、B.queenslandensis、B.rochalimae外还有两个可能的新型。但无明显的地理分布聚集性,芒市6个型均有存在。这些迹象表明滇西居民区小型兽感染巴尔通体同样具有多样性特征,但具体有哪些型,以及与人类致病性之间有何关系,有待进一步探究。
巴尔通体作为一种新发传染病的病原体,引起的疾病谱较为广泛,而各方面的认识才刚开始。国内多地的调查显示小型兽等动物均有感染,但人群中的感染情况、媒介在疾病传播中的作用、临床特异性快速诊断方法的构建等都需要进一步研究。
[志谢:云南省地方病防治所钟佑宏、石丽媛、苏丽琼等同志参与了部分现场资料收集工作,以及参与此项工作的10县(市、区)疾病预防控制中心和乡镇卫生院的同志及配合调查的所有个人和家庭。]
| [1] | Zhang YY, Li H, Gong ZD, et al. Identification of Bartonella in small mammal reservoir from northwestern Yunnan province[J]. Acta Parasitologyet Medica Entomologica Sinica,2013,20(2):110-114. (in Chinese)张耀允,黎浩,龚正达,等. 云南省西北部分地区小型兽类宿主中巴尔通体感染特征研究[J]. 寄生虫与医学昆虫学报,2013,20(2):110-114. |
| [2] | Bai Y, Kosoy MY, Maupin GO, et al. Discovery of Bartonella species in rodents in Yunnan[J].Chinese Journal of Zoonoses,2002,18(3):5-9. (in Chinese)白瑛,Kosoy MY,Maupin GO,等. 首次证实巴尔通体在我国云南鼠群中流行[J]. 中国人兽共患病杂志,2002,18(3):5-9. |
| [3] | Li DM, Yu DZ, Liu QY, et al. Study on the prevalence of Bartonella species in rodent hosts from different environmental areas in Yunnan[J]. Chinese Journal of Epidemiology,2004,25(11):934-937. (in Chinese)栗冬梅,俞东征,刘起勇,等. 云南省不同环境鼠形动物巴尔通体感染情况的研究[J]. 中华流行病学杂志,2004,25(11):934-937. |
| [4] | Yang FL. The investigation of Bartonella in Yunnan province[J]. Endemic Diseases Bulletin,2005,20(1):73-74. (in Chinese)杨发莲.巴尔通体在云南省的调查研究[J]. 地方病通报,2005,20(1):73-74. |
| [5] | Yin JX, Yang GC, Liu ZX, et al. Evaluation for effect of capturing floor flea with water-containing plate method[J]. Chinese Journal of Control of Endemic Diseases,2013,28(5):328-329. (in Chinese)尹家祥,杨光璨,刘正祥,等. 水盘法捕获地面游离蚤的效果评估[J]. 中国地方病防治杂志,2013,28(5):328-329. |
| [6] | Birtles RJ, Harrison TG, Molyneux DH. Grahamella in small woodland mammals in the U.K.:isolation, prevalence and host specificity[J]. Ann Trop Med Parasitol,1994, 88(3):317-327. |
| [7] | Kosoy MY, Regnery RL, Tzianabos T, et al. Distribution, diversity, and host specificity of Bartonella in rodents from the southeastern United States[J]. Am J Trop Med Hyg,1997, 57(5):578-588. |
| [8] | Li DM, Zhang JZ, Liu QY. The research progress of Bartonella and related diseases in China[J]. Chinese Journal of Zoonoses,2008,24(8):762-765, 770. (in Chinese)栗冬梅,张建中,刘起勇.中国巴尔通体与相关疾病的研究进展[J]. 中国人兽共患病学报,2008,24(8):762-765, 770. |
| [9] | Yang FL, Bai HM, Yang H. Analysis of phylogenic diversity of Bartonella in Yunnan province[J]. China Tropical Medicine,2008,8(12):2075-2077. (in Chinese)杨发莲,白鹤鸣,杨慧.云南巴尔通体的系统发育多样性分析[J]. 中国热带医学,2008,8(12):2075-2077. |
| [10] | Yang FL, Bai HM, Yang H. The infection characteristics of Bartonella in small mammals in Yunnan[J]. Chinese Journal of Pest Control,2007,23(4):256-257. (in Chinese)杨发莲,白鹤鸣,杨慧.云南鼠形动物巴尔通体感染特征[J]. 医学动物防制,2007,23(4):256-257. |
| [11] | Liu ZX, Yin JX, Yang GC, et al. A survey of small mammals and their parasitic fleas in households of western Yunnan province[J]. Chinese Journal of Endemiology,2014,33(6):626-629. (in Chinese)刘正祥,尹家祥,杨光璨,等. 云南滇西地区室内鼠形动物及其寄生蚤调查[J]. 中华地方病学杂志,2014,33(6):626-629. |
| [12] | Norman AF, Regnery R, Jameson P, et al. Differentiation of Bartonella-like isolates at the species level by PCR-restriction fragment length polymorphism in the citrate synthase gene[J]. J Clin Microbiol,1995,33:1797-1803. |
| [13] | Li DM, Liu QY, Yu DZ, et al. Molecular evidence of Bartonella species from fleas in Yunnan[J]. Chinese Journal of Vector Biology and Control,2005,16(1):5-8. (in Chinese)栗冬梅,刘起勇,俞东征,等. 用PCR方法检出蚤类携带巴尔通体[J]. 中国媒介生物学及控制杂志,2005,16(1):5-8. |
| [14] | Yang FL, Bai HM, Yang H, et al. Culture and isolation of Bartonella and analysis of its biological characteristics[J]. China Tropical Medicine,2007,7(11):2001-2004. (in Chinese)杨发莲,白鹤鸣,杨慧,等. 巴尔通体分离培养及生物学特性研究[J]. 中国热带医学,2007,7(11):2001-2004. |
 2016, Vol. 31
2016, Vol. 31


