扩展功能
文章信息
- 李晶, 王洪霞, 阚飙, 梁未丽
- LI Jing, WANG Hong-xia, KAN Biao, LIANG Wei-li
- 霍乱弧菌宿主整合因子β亚单位的可溶性克隆表达
- Cloning and expression of soluble integration host factor β subunit of Vibrio cholerae
- 疾病监测, 2016, 31(4): 278-281
- Disease Surveillance, 2016, 31(4): 278-281
- 10.3784/j.issn.1003-9961.2016.04.005
-
文章历史
- 收稿日期: 2016-02-03
病原菌随环境的刺激而改变自身基因的表达能够帮助其适应环境从而增加生存机会。类核相关蛋白,如重组蛋白样类核结构蛋白(H-NS),宿主整合因子(IHF),Factor for Inversion Stimulation(Fis)等在这个过程中都具有相当重要的作用。IHF是不对称的组蛋白样蛋白质,具有DNA结合活性,大肠埃希菌的IHF是由位于染色体不同位置的IHF-α(HimA)(11.3 kDa)和IHF-β(HimD)(10.6 kDa)两个亚基1∶1组成的异二聚体。两个亚基分别由ihfA(himA)和ihfB(himD)基因编码,具有25%~35%的相似性[1]。IHF功能多样,可参与DNA复制、λ位点特异性重组、细菌拟核不同生长状态下的结构调控,调节多种不同基因的转录表达[1, 2, 3, 4]。IHF通常结合在DNA片段上的A/T富含区域,其中,一半以上的IHF结合区域都有一段13 bp的保守序列WATCAANNNNTTR(W为A或T,N为任意4种碱基,R为A或G)[5, 6]。IHF能够在结合位点将DNA弯折180°[7],形成蛋白DNA复合物,促使其与RNA聚合酶结合后调控转录[1]。
霍乱弧菌是引起急性肠道传染病——霍乱的病原体,广泛分布于海洋、江河、湖泊等自然水体中。在霍乱弧菌中,IHF的α和β亚单位分别由位于大染色体上的VC1222(ihfA)和VC1914(ihfB)编码。在霍乱弧菌古典型O395中,IHF能够促进毒力基因的表达,ihfA和ihfB的失活能够显著降低毒力共调节菌毛tcpA和霍乱毒素ctx的表达,抑制毒力共调节菌毛和霍乱毒素的形成[8]。但IHF在霍乱弧菌生理过程中的作用和对毒力因子等的调控机制缺乏系统研究。
前期工作中,笔者已成功构建El Tor生物型霍乱弧菌IHF-α亚单位基因的重组表达质粒,获得其可溶性表达产物。本研究尝试克隆表达IHF-β亚单位基因ihfB,通过将ihfA的C端与ihfB的N端融合,提高IHF-β的可溶性表达,为后续工作奠定基础。
1 材料与方法 1.1 实验用菌株和载体实验用菌株模板为El Tor型霍乱弧菌C7258(科室保存),表达纯化载体pXTB1(购于New England Biolabs#N6707),大肠埃希菌宿主细胞ER2566。
1.2 主要仪器和试剂几丁质树脂Chitin Resin购于New England Biolabs,用于纯化目的蛋白;NdeⅠ、SapⅠ购于New England Biolabs;PrimeSTAR® HS DNA Polymerase、dNTP、SolutionⅠ快速连接试剂盒购于TaKaRa宝生物工程(大连)有限公司;PCR扩增特异性引物由北京天一辉远有限公司合成;LB和LBA培养基按常规配置;氨苄西林终浓度100 μg/ml,IPTG 0.4 mmol/L,DTT 80 mmol/L。PCR扩增仪为MJ公司的PTC200,凝胶成像仪为Bio-Rad Gel Doc XR系统。紫外可见分光光度计为美国UNIC0公司的WEZUV-2102型产品。离心机为德国EPPENDORF的5417R。超声破碎仪为S0NICS & MATERIALS公司产品,聚丙烯酰胺凝胶电泳仪为Bio-Rad公司。
1.3 重组载体的构建 1.3.1 模板制备用接种环挑取C7258单菌落于60 μl去离子水中,煮8 min,冰浴10 min,12 000 r/min离心5 min,取上清。
1.3.2 扩增片段使用ihfB-NheⅠ-up: CTA GCT AGC ACT AAG TCC GAA CTG ATA GAA和ihfB-SapⅠ-dn: GGT GGT TGC TCT TC C GCA CAA GTT AAC GCG TTC GCG TAG用来扩增原始即野生型ihfB基因。扩增参数:94 ℃ 5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,共30个循环;最后72 ℃ 10 min。ihfB-NheⅠ-up和N-ihfB-dn: CAA AAC CGG AAC CAC GAA TCT CGA TGC GCT,用来扩增ihfB的N端序列;C-ihfA-up:GAT TCG TGG TTC CGG TTT TGG TAA TTT TGA和ihfA-SapⅠ-dn: GGT GGT TGC TCT TCC GCA TTT TTC GAC TTT GAT GTT CTC G,用来扩增ihfA的C端序列。扩增参数同上。将ihfB的N端和ihfA的C端两段扩增产物分别纯化后(QIAGEN PCR Purification Kit)各取1 μl做模板,使用ihfB-NheⅠ-dn和ihfA-SapⅠ-dn两对引物通过搭桥PCR扩增得到294 bp的目的片段产物N-ihfB-C-ihfA。扩增参数同上。
1.3.3 克隆转化将野生型ihfB和N-ihfB-C-ihfA通过PCR扩增产物分别经NheⅠ和SapⅠ双酶切纯化后,与相同酶切后载体pXTB1在Solution Ⅰ连接体系中16 ℃连接3 h,连接产物42 ℃转ER2566感受态,37 ℃ 1 h复苏后涂布Amp+LBA平板,37 ℃过夜培养,菌落PCR鉴定阳性克隆,提取质粒酶切验证并测序核实后保存。
1.4 IHF-β的表达纯化挑取4~5个新鲜的阳性克隆子分别到5 ml Ampr LB中,37 ℃ 200 r/min培养至A600约为0.5,加入IPTG至终浓度为0.4 mmol/L,28 ℃,200 r/min培养3~4 h,离心收集菌体沉淀,加入15 μl 3×SDS Loading Buffer煮8 min,离心后取上清,以pXTB1空载体为对照,进行SDS-PAGE电泳检测。挑取诱导阳性的克隆子到200 ml Ampr LB中,37℃ 200 r/min培养至A600约为0.5,加入IPTG至终浓度为0.4 mmol/L,28 ℃,200 r/min培养3~4 h。5400 r/min离心10 min收集菌沉淀弃上清,菌沉淀在冰上重悬于15 ml Column Buffer中(20 mmol/L Tris-HCl,pH 8.4,50 mmol/L NaCl,1 mmol/L EDTA,5%甘油)。在冰水浴中超声破碎细菌至菌悬液呈半透明(超声破碎5 s,停10 s,功率23%),12 000 r/min 4 ℃离心20 min去除细菌碎片,收集上清备用。按照IMPACTTM Kit说明书准备Chitin Resin(NEB#E6901S)填充柱。菌体裂解上清液上柱结合后,用20倍柱床体积Column Buffer、20倍柱床体积Wash Buffer(20 mmol/L Tris-HCl,pH 8.5,1 mol/L NaCl,1 mmol/L EDTA,5%甘油)分别洗柱,5倍柱床体积的Cleavage Buffer(Column Buffer+80 mmol/L DTT)快速冲洗柱后,用2倍柱床体积Cleavage Buffer重悬柱床后置4 ℃过夜。次日用Column Buffer洗脱,分管收集洗脱液。用SDS-PAGE电泳检测是否含有目的蛋白,将蛋白浓度高的数管合并,置于Column Buffer缓冲液4 ℃过夜透析去除DTT,期间更换1~2次缓冲液。透析后蛋白用Bio-Rad Protein Assay检测蛋白浓度,加入甘油至终浓度为20%,-80 ℃保存。
2 结果 2.1 重组pXTB1-ihfB和pXTB1-N-ihfB-C-ihfA的构建使用C7258为模板,分别扩增野生型ihfB和融合改造的N-ihfB-C-ihfA基因片段。引物ihfB-NheⅠ-up和ihfB-SapⅠ-dn扩增产生273 bp的野生型ihfB片段。融合改造的N-ihfB-C-ihfA基因片段通过搭桥PCR获得,用引物对ihfB-NheⅠ-up/N-ihfB-dn与C-ihfA-up/ihfA-SapⅠ-dn分别扩增ihfB的N端和ihfA的C端,产物分别为141 bp和159 bp,借助N-ihfB-dn和C-ihfA-up引物5′侧10 bp的互补搭桥序列,等比例混合两个片段作为模板,ihfB-NheⅠ-up/ihfA-SapⅠ-dn扩增得到294 bp的N-ihfB-C-ihfA片段。经NheⅠ和SapⅠ酶切后克隆入表达载体pXTB1,转化ER2566,阳性克隆经酶切、测序验证,分别获得表达野生型ihfB和嵌合体N-ihfB-C-ihfA的重组表达质粒pXTB1-ihfB和pXTB1-N-ihfB-C-ihfA(图 1、2)。
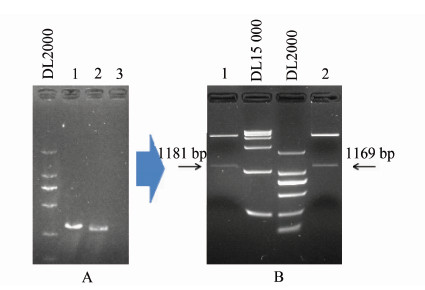
|
| 注: A:1. pXTB1-N-ihfB-C-ihfA (引物:ihfB-NheⅠ-dn/ihfA-SapⅠ-dn); 2. pXTB1-ihfB (引物:ihfB-NheⅠ-up/ihfB-SapⅠ-dn); 3. 阴性对照; B:1. pXTB1-N-ihfB-C-ihfA; 2. pXTB1-ihfB(泳道BamHⅠ和XbaⅠ酶切) 图1 重组pXTB1-ihfB和pXTB1-N-ihfB-C-ihfA的菌落PCR验证(A)和酶切验证(B)电泳结果 Figure 1 Electrophoresis result of colonies PCR verification(A) and digestion verification(B) of recombinant pTXB1-ihfB and pTXB1-N-ihfB-C-ihfA |
|
| 注:1:pXTB1-ihfB菌体收集液; 2:pXTB1-ihfB菌体超声后上清收集液; 3:pXTB1-N-ihfB-C-ihfA菌体收集液; 4:pXTB1-N-ihfB-C-ihfA菌体超声后上清收集液; 5:pXTB1-N-ihfB-C-ihfA上清液过柱洗脱后,得到纯化的目的蛋白。 图2 N-ihfB-C-ihfA构建模式图 Figure 2 Schematic diagram of N-ihfB-C-ihfA construction |
IHF-β是一个10.6 kDa大小的蛋白,在重组质粒pXTB1-ihfB中,ihfB与表达载体pXTB1的intein-CBD标签蛋白(28 kDa)形成C末端融合蛋白,预计大小为38 kDa。经IPTG诱导,SDS-PAGE电泳检测显示pXTB1-ihfB在菌体沉淀中存在高表达的IHF-β-intein-CBD融合蛋白,但超声破碎的细胞上清中却检测不到融合蛋白(图 3泳道1、2),说明目标蛋白形成包涵体,以不可溶的状态存在于细胞破碎沉淀中。克隆嵌合体pXTB1-N-ihfB-C-ihfA经IPTG诱导后,在超声破碎的菌体沉淀和裂解上清中都检测到高表达的融合蛋白(图 3泳道3、4),说明该融合蛋白能够可溶性表达。

|
| 图3 SDS-PAGE检测结果 Figure 3 SDS-PAGE result |
将裂解上清加载Chitin Resin的分离纯化柱,融合蛋白的intein-CBD标签蛋白中包含有一个几丁质结合域,能够与几丁质树脂亲和性结合,实现融合蛋白的分离纯化。通过巯基试剂DTT的柱上切割,可切除融合蛋白的intein-CBD标签,经过Column Buffer洗脱得到高纯度的游离目的蛋白(图 3泳道5)。
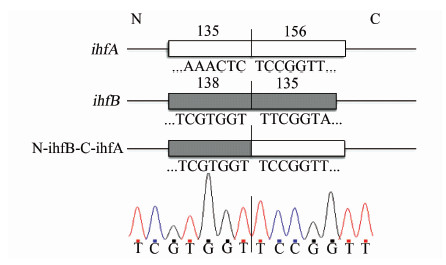
3 讨论IHF作为一种全局性调节因子,除参与DNA复制、λ位点特异性重组等重要的细胞生理机能外,还参与多种致病菌毒力基因的表达调控[8]。在本研究中,首先尝试克隆表达El Tor生物型霍乱弧菌IHF-β亚单位基因ihfB,结果显示目的蛋白形成不可溶的包涵体存在于细胞破碎沉淀中,与文献报道的E.coli中HimD的情况相似。Nash等[9]报道,在大肠埃希菌中单独过量表达HimD(即IHF-β),也会形成非可溶性的蛋白产物。为解决这一问题,Nash将HimA(即IHF-α)与HimD进行协同共表达,发现HimA的存在能够显著提高HimD的活性,形成大量可溶性的HimD。Zulianello等[10]进一步研究表明,大肠埃希菌中形成IHF异源二聚体结构主要依赖于两个亚基的N端,而C端的主要介导与DNA的结合。将himD(ihfB)的N端(编码47aa)与himA(ihfA)的C端(编码52aa)重组后进行表达,可形成具有HimD活性的嵌合体可溶蛋白,与HimA结合形成异源二聚体发挥IHF的功能。
为此,笔者分析比较了大肠埃希菌和霍乱弧菌IHF α和β亚基的氨基酸序列,发现HimA与IHF-α有81.63%的一致性,HimD与IHF-β有81.52%的一致性,并且两个亚基在C端的序列一致性更高,更为保守。该结果提示,采用相似的构建嵌合体蛋白的策略对霍乱弧菌的IHF-β进行改造,提高其可溶性表达。根据蛋白序列的一致性分析,本研究将霍乱弧菌ihfB中编码β亚基N端47aa的核苷酸序列与ihfA中编码α亚基C端52aa的核苷酸序列通过搭桥PCR进行拼接融合(图 2),克隆入pXTB1蛋白表达载体,成功构建嵌合体重组蛋白表达质粒,使非可溶性表达的IHF-β变为可在上清中稳定存在的可溶状态,并纯化出了完整的IHF-β嵌合体蛋白。该方法解决了因单独过量表达霍乱弧菌的IHF-β而导致蛋白产物不可溶的问题,获得了可溶性表达的纯化IHF-β嵌合体蛋白,为研究IHF在霍乱弧菌中的调控功能奠定了基础。
| [1] | Goosen N, van de Putte P. The regulation of transcription initiation by integration host factor[J].Mol Microbiol,1995, 16(1):1-7. |
| [2] | Nash HA, Robertson CA. Purification and properties of theEscherichia coli protein factor required for lambda integrative recombination[J].J Biol Chem,1981, 256(17):9246-9253. |
| [3] | Lee SY, Lim CJ, Drge P, et al. Regulation of bacterial DNA packaging in early stationary phase by competitive DNA binding of Dps and IHF[J].Sci Rep,2015,5:18146. |
| [4] | Ryan VT, Grimwade JE, Nievera CJ, et al. IHF and HU stimulate assembly of pre-replication complexes atEscherichia coli oriC by two different mechanisms[J].Mol Microbiol,2002,46(1):113-124 |
| [5] | Goodrich JA, Schwartz ML, McClure WR. Searching for and predicting the activity of sites for DNA binding proteins: compilation and analysis of the binding sites forEscherichia coli integration host factor (IHF)[J].Nucl Acids Res,1990, 18(17):4993-5000. |
| [6] | Craig NL, Nash HA.E. coli integration host factor binds to specific sites in DNA[J].Cell,1984, 39(3 Pt 2):707-716. |
| [7] | Swinger KK, Rice PA. IHF and HU: flexible architects of bent DNA[J].Curr Opin Struct Biol,2004,14(1):28-35. |
| [8] | Stonehouse E, Kovacikova G, Taylor RK, et al. Integration host factor positively regulates virulence gene expression inVibriocholerae[J].J Bacteriol,2008,190(13):4736-4748. |
| [9] | Nash HA, Robertson CA, Flamm E, et al. Overproduction ofEscherichia coli integration host factor, a protein with nonidentical subunits[J].J Bacteriol,1987, 169(9):4124-4127. |
| [10] | Zulianello L, de la Gorgue de Rosny E, van Ulsen P, et al. The HimA and HimD subunits of integration host factor can specifically bind to DNA as homodimers[J].EMBO J,1994, 13(7):1534-1540. |
 2016, Vol. 31
2016, Vol. 31


