扩展功能
文章信息
- 石琦, 陈操, 董小平
- SHI Qi, CHEN Cao, DONG Xiao-ping
- 进入疯牛病和变异型克雅氏病消除阶段的动物及人类朊病毒病监测
- Prion surveillance in animals and humans in bovine spongiform encephalopathy and variant Creutzfeldt-Jakoba disease eradication stage
- 疾病监测, 2016, 31(5): 360-364
- Disease Surveillance, 2016, 31(5): 360-364
- 10.3784/j.issn.1003-9961.2016.05.004
-
文章历史
- 收稿日期:2016-02-23
朊病毒病(prion disease)又称可传播性海绵状脑病(transmissible spongiform encephalopathy,TSEs),是一类侵袭人类及多种动物中枢神经系统的传染性退行性脑病,潜伏期长,病程短,病死率100%。目前认为其感染因子是一种不含核酸且具有自我复制能力的感染性蛋白粒子——朊病毒(prion)。其蛋白质一级结构与宿主细胞正常朊蛋白(PrPC)完全一致,称其为PrPSc。由PrPC经错误折叠从而转变成PrPSc,具有自我复制能力[1]。目前已经发现在人类及20余种动物中有自然发生或获得性感染的朊病毒病,包括人类的克雅氏病(Creutzfeldt-Jakob disease,CJD)、库鲁病(Kuru),动物的羊瘙痒病(Scrapie)、牛的海绵状脑病(bovine spongiform encephalopathy,BSE,又称“疯牛病”)、驼鹿和麋鹿的慢性消耗病(chronic wasting disease,CWD)等。人类朊病毒病的发病可分为散发型、家族遗传型和获得型。朊病毒病典型的神经病理学改变包括脑组织中出现海绵状空泡样变性、淀粉样斑块沉积、神经元丢失和胶质细胞增生[2]。
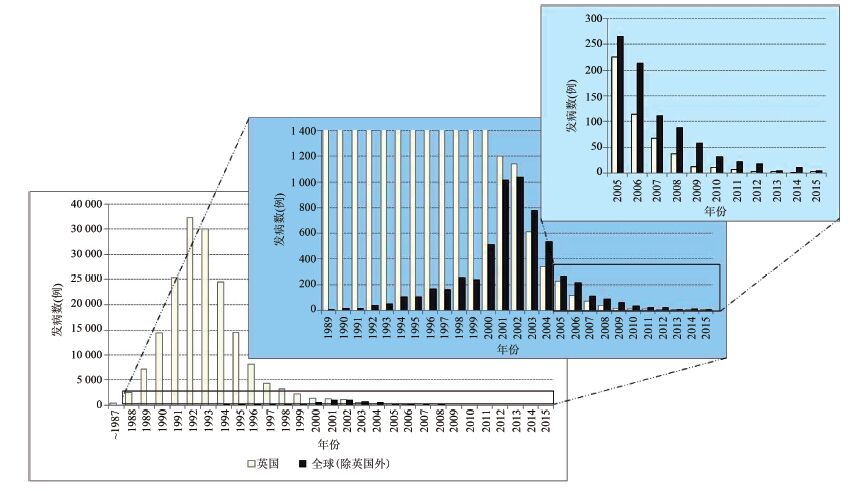
1 疯牛病的暴发与现状1986年,英国的农场最先发现疯牛病,随后大面积暴发,1992年达到高峰。1989年,疯牛病第1次出现在英国以外的国家——冰岛,随后的十几年间先后在欧洲的十几个国家报告了疯牛病。2001年,第1次出现在非欧洲国家——日本[3]。2003年在加拿大和美国也出现了患疯牛病的病牛[4-5]。根据世界动物卫生组织(office international des épizooties,OIE)统计,截至2015年全球共确诊患疯牛病的病牛187 469头,其中英国181 667头,占全球发病总数的96.91%。在此期间,受疯牛病病原潜在感染的牛大约超过100万头,这些潜在感染的牛大多数进入到人类的食物链。
疯牛病的暴发和消长在全球呈现明显的两个峰值曲线,即英国曲线和全球(除英国外)曲线(图 1)。英国的峰值出现在19921993年,期间确诊的病牛超过35 000头,1995年以后病牛数量开始迅速下降。英国确诊的病牛仅为1头(2014年)和2头(2015年)。截至2015年,全球除英国外共有25个国家报道有疯牛病发生,主要出现在欧洲。1989年冰岛报道首例疯牛病后,全球病牛呈缓慢上升,于20002001年间达到高峰(图 1)。2003年以后开始下降,2008年进入十位数阶段(88头),病牛数2014年11头,2015年4头。自2003年以来,全球其他国家每年的疯牛病病牛总数均超过英国。截至2015年累积超过千位数的国家有爱尔兰(1587头)、葡萄牙(1083头)和法国(1026头)。西班牙(787头)、瑞士(467头)、德国(421头)、意大利(144头)和比利时(133头)确诊病牛超过百位数。欧洲以外的国家以日本最多(36头),其次加拿大21头,美国3头,以色列1头。2015年仍出现疯牛病的国家有加拿大、爱尔兰、挪威和斯洛文尼亚(http://www.oie.int)。
|
| 图 1 19872015年间英国和全球疯牛病发病数 Figure 1 Case numbers of BSE in UK and worldwide,19872015 |
| |
伴随着疯牛病暴发,20世纪80年代末英国的其他反刍动物也暴发了海绵状脑病,包括南非大羚羊、阿拉伯大羚羊、大弯角羚、非洲旋角大羚羊、弯刀长角羚羊等。1990年在英国出现了猫海绵状脑病,涉及家猫和饲养的大型猫科动物如美洲狮、猎豹、老虎和豹猫等。已经证实,这些新型的动物海绵状脑病是由食用疯牛病致病因子污染的饲料所致,说明疯牛病可跨种属传播。
2 变异型克雅氏病(variant Creutzfeldt-Jakob disease,vCJD)的暴发与现状1995年英国出现一种新型克雅氏病,后命名为变异型克雅氏病[6]。此后,确诊的vCJD病例数逐年增加,2000年达到峰值(28例)。2004年以后,英国的vCJD病例数开始逐年下降,2012年无病例报告,2013年仅报告1例,2014年以来未发现新的vCJD病例出现(图 2)。截至2015年末,英国共确诊vCJD病例177例。

|
| 图 2 19952015年间英国和全球vCJD死亡病例数 Figure 2 Death numbers of vCJD in UK and worldwide,1995-2015 |
| |
除英国外,法国在1996年也确诊了首例vCJD病例,随后爱尔兰(1999年)、加拿大(2002年)、意大利(2003年)、美国(2004年)、日本(2004年)、荷兰(2005年)、西班牙(2005年)、葡萄牙(2007年)、中国台湾(2010年)和沙特阿拉伯(2010年)先后确诊其首例vCJD病例。病例总数(除英国外)达50人,其中法国病例达27例,其他国家vCJD病例数均在5人以下。病例数的峰值出现在2005(10例)和2006年(10例),随后逐年下降(图 2)(http://www.eurocjd.ed.ac.uk)。
3 疯牛病的控制和消除疯牛病自1986年暴发,于1992年达到发病高峰,随后迅速下降。目前全球每年确诊的病牛仅数头。短短30年,这种尚无任何有效预防和治疗措施且100%病死率的传染病得以控制,甚至接近消除,充分显示了公共卫生措施干预的效果。
3.1 严格的禁令和彻底的扑杀在疯牛病暴发伊始,英国制订了禁止使用肉骨粉等加工后的动物蛋白做反刍动物饲料后,很快扩展至其他动物。欧洲各国及世界许多国家也相继出台更为严格的限制令,禁止出售其他反刍动物(绵羊、山羊及鹿等)的带骨肉等;收购、宰杀30个月龄以上的牛必须进行检验;全面禁止从所有发生疯牛病国家进口活牛羊、牛羊肉及其制品、肉骨粉等相关产品。疯牛病病牛一经确诊,立即将该饲养场所有的牛进行扑杀和无害化处理。这些禁令的实施对于有效控制疯牛病的发生和蔓延起到了重要作用。
3.2 主动监测疯牛病发生后,英国及欧洲许多国家对该病在原有症状监测的基础上开展主动监测,即所有72周龄的牛在屠宰后都要进行脑组织朊病毒检测,一些国家的疯牛病病例就是通过主动监测发现的。此类监测涉及的范围广,潜在病牛的漏检率低,但所用费用高昂。
4 人类朊病毒病监测的现实意义20世纪90年代起,随着疯牛病暴发和vCJD的出现,欧美各国开始或重启了人类朊病毒病监测,监测内容涵盖vCJD和其他传统的人类朊病毒病。目前开展监测的国家和地区包括欧洲大部分国家(奥地利、比利时、保加利亚、塞浦路斯、捷克、丹麦、爱沙尼亚、芬兰、法国、德国、希腊、匈牙利、冰岛、爱尔兰、意大利、拉脱维亚、立陶宛、马耳他、荷兰、挪威、波兰、葡萄牙、斯洛伐克、斯洛文尼亚、西班牙、瑞典、瑞士及英国),以及北美洲(加拿大和美国)、中南美洲(墨西哥和阿根廷)和亚洲(中国、中国台湾、日本、以色列及韩国)的部分国家和地区,形成了国际克雅氏病监测网络(CJD International Surveillance Network)(http://www.eurocjd.ed.ac.uk)。全球朊病毒病监测系统对vCJD的发现和确诊、传统朊病毒病的流行状况和疾病特征、新的人类朊病毒病亚型的发现以及人类朊病毒病的疾病负担和对公共卫生的影响等方面做出了不可替代的贡献,对各国乃至全球人类朊病毒病和疯牛病等动物源性朊病毒病的防控策略和政策的制订及形成提供了重要的科学依据和智库资源,同时监测数据和资源为朊病毒及朊病毒病创新型科研提供了新的思路、方向和现场。
根据目前疯牛病和人朊病毒病监测数据,虽然疯牛病和vCJD在过去3年里还未完全清零,但短期内大规模反弹的可能性非常小[7]。是否仍然需要保持高强度的监测以及如何调整监测内容和范围已经成为热门话题。笔者结合国内外研究现状和大部分专家观点认为在今后的5~10年内保持高强度的疯牛病监测和人类朊病毒病监测十分必要,其原因归纳如下。
4.1 传染病消除的共性目前人类通过自身力量在全球范围内消灭的传染病只有天花,正在消灭的另一传染病是脊髓灰质炎。这两种传染病均为疫苗可预防性疾病,且人类是该病病原体的唯一宿主。疾病从有效控制到彻底消除无不经过十数年时间。在此期间,疾病监测不仅直接反映疾病流行状况,而且是疾病消除的重要手段。以天花为例,全球天花消除行动始于20世纪60年代,1980年世界卫生组织宣布天花被彻底根除[8]。能够在一个不太长的时间内消灭天花,和1969年前后发生的战略转移关系极大,把以往的普遍追求种痘率,调整为接种、监测和控制相结合的策略发挥了至关重要的作用。接种疫苗和有效的监测与隔离结合起来,在种痘率低于50%的地区,同样也能够消灭天花。时至今日,世界各国仍保留着一定的天花监测和检测能力。脊髓灰质炎的全球消除行动起始于20世纪90年代[9],广泛接种疫苗的同时,在全球范围内建立了覆盖面极广的监测系统[10],但时至今日,目标仍未实现。除了未能全面使用灭活脊髓灰质炎疫苗外,很重要的原因是一些国家的监测体系过于薄弱。而对于以人和其他动物为共同宿主的人兽共患病的消除则需要更长时间。因此,监测工作在任何传染性疾病消除阶段不仅不应被削弱,而更应加强。
4.2 朊病毒病的发病特征朊病毒病的特征之一就是暴露后潜伏期长,疯牛病的潜伏期为数月至数年,而人类传染获得型的朊病毒病(如库鲁病)最长可达40余年[11-12]。此阶段感染的人或动物基本没有临床症状,但其中枢神经组织已含有高滴度的感染性朊病毒。如无疯牛病的主动监测体系,这些处于潜伏期的感染动物将进入人类食物链,形成潜在威胁。人类历史上两起重大医源性克雅氏病暴发的原因就是使用了未经发现或处于潜伏期的克雅氏病患者的脑组织提取物[13-14]。对于潜伏期超长的传染病消除往往需要更长时间的监测评估。
4.3 朊病毒病新型别的出现近年来,伴随着典型疯牛病病例的下降,另外一种被称为“非典型性疯牛病”(atypical BSE)类型的病例逐渐显现[15]。非典型性疯牛病的致病因子呈现出不同的朊病毒分子特征,发病率低,目前被认为可能与人类的散发型CJD相似,属于牛的散发型朊病毒病,尚不能排除来自羊瘙痒因子污染饲料的可能。人源化转基因小鼠实验显示非典型性疯牛病具有明显感染性,甚至高于典型疯牛病[16-19],这提示可能会导致人类感染。近年来,人类朊病毒病监测发现了另一种新的类型——蛋白酶敏感型朊病毒病(variably proteinase-sensitive prionopathy,VPSPr)[20-22],呈散发性,其公共卫生意义尚不明确。
此外,最近研究显示羊瘙痒因子可以感染人源化转基因小鼠和非人类灵长类动物[23-24],这一结果强有力地挑战了“小反刍动物朊病毒不具备感染人类”的传统概念。
4.4 朊病毒病的多途径传播和携带者已经证实疯牛病具有垂直传播特性,即使没有饲料污染,处于潜伏期的母牛也可直接感染小牛[25-26]。广泛存在的羊瘙痒病具有更多的传播途径,除消化道和垂直传播外,密切直接接触也是传播途径之一。鹿的朊病毒病——慢性消耗性病,也是多途径传播。目前已知人类各种类型的朊病毒病尚不具备垂直和直接接触传播的能力。处于潜伏期的vCJD病例血液具有确定的感染性,目前已经证实3例vCJD患者通过输血感染[27-28]。与散发型CJD不同,vCJD的致病因子在中枢神经以外的淋巴组织(如脾脏、扁桃体、阑尾、淋巴结等)中有明显分布。最近英国的一项研究显示[29],32 000多份非CJD的阑尾样本中,有16份检测为朊病毒阳性,感染率大概为0.05%,这说明在英国人群中存在数量可观的“朊病毒携带者”。其他国家人群中朊病毒携带者的情况不详。这些朊病毒携带者的公共卫生意义仍不清楚。
4.5 朊病毒病监测的覆盖面目前,国际人类朊病毒病监测网络覆盖范围大多为发达国家和地区,而整个非洲、绝大部分南美洲和大部分的亚洲(东南亚、南亚、西亚)国家还没有建立监测系统,甚至没有朊病毒病病例报道,疯牛病、羊瘙痒病等动物朊病毒病的监测也基本空白。这些地区的许多国家牛羊存栏数很高,在19802000年期间也曾经从疯牛病发生国进口过肉骨粉,因此这些国家和地区存在潜在疯牛病病牛和vCJD病例的可能性极高,要达到全球消灭疯牛病和vCJD尚需时日。
4.6 朊病毒和“朊病毒样疾病”的科学研究作为一种不含核酸的传染性蛋白粒子,朊病毒的研究一直是生命科学中的热点之一。动物和人类朊病毒病的监测不仅可提供重要的基础数据、生物资源和现场,更为重要的是产生出许多新的创新型研究理念。朊病毒的生物学本质还有许多未解之谜,其基本理论仍不断地接受着质疑和挑战,运行良好的人类朊病毒病监测体系无疑会有力地推动该病的研究。近年来,一些神经退行性疾病的致病蛋白也呈现出朊病毒类似的复制和播散特征,甚至也具有潜在的传染性,被称之为“朊病毒样疾病”[30-32]。这些疾病(如阿尔茨海默病、帕金森病等)发病率远高于传统的朊病毒病,具有重要的公共卫生意义。目前已经公认,在“朊病毒样疾病”的研究中,朊病毒病已经成为此类疾病比较性研究的金标准[7]。
5 结语人类朊病毒病的全球监测始于1993年的部分欧洲国家,很快扩展到绝大部分欧洲国家、北美、大洋洲和东北亚地区。我国自2006年正式启动全国CJD监测,并加入国际朊病毒病监测网络。人类朊病毒病监测网络不仅极大地丰富了对朊病毒和朊病毒病的认识,也成为控制疯牛病和vCJD的重要手段。但对朊病毒的生物学本质还有许多未解之谜,目前仍没有特异性预防和治疗手段。为控制人类和动物朊病毒病,防止再次出现灾难性的公共卫生问题,全球朊病毒病的监测尤为重要。
| [1] | Prusiner SB, Scott MR, de Armond SJ, et al. Prion protein biology[J]. Cell, 1998, 93 (3) : 337–348 . |
| [2] | Shi Q, Dong XP. (Ctm)PrP and ER stress: a neurotoxic mechanism of some special PrP mutants[J]. Prion, 2011, 5 (3) : 123–125 . |
| [3] | Yoshikawa Y. Epidemiological study on BSE outbreak in Japan[J]. J Vet Med Sci, 2008, 70 (4) : 325–336 . |
| [4] | Kuehn BM. Canada wraps up BSE investigation[J]. J Am Vet Med Assoc, 2003, 223 (7) : 919–921 . |
| [5] | . Case of BSE confirmed in the USA[J]. Vet Rec, 2012, 170 (18) : 452. |
| [6] | Will RG, Ironside JW, Zeidler M, et al. A new variant of Creutzfeldt-Jakob disease in the UK[J]. Lancet, 1996, 347 (9006) : 921–925 . |
| [7] | Budka H, Will RG. The end of the BSE saga: do we still need surveillance for human prion diseases?[J]. Swiss Med Wkly, 2015 : . |
| [8] | . Global eradication of smallpox: WHO Global commission for the certification of Smallpox eradication[J]. J Med Assoc Thai, 1979, 62 (8) : 461. |
| [9] | Ward NA, Milstien JB, Hull HF, et al. The WHO-EPI initiative for the global eradication of poliomyelitis[J]. Biologicals, 1993, 21 (4) : 327–333 . |
| [10] | . Performance of acute flaccid paralysis (AFP) surveillance and incidence of poliomyelitis (data received in WHO Headquarters as of 25 August 2015)[J]. Wkly Epidemiol Rec, 2015, 90 (37) : 484–488 . |
| [11] | Huillard d'Aignaux JN, Cousens SN, Maccario J, et al. The incubation period of kuru[J]. Epidemiology, 2002, 13 (4) : 402–408 . |
| [12] | Collinge J, Whitfield J, McKintosh E, et al. A clinical study of kuru patients with long incubation periods at the end of the epidemic in Papua New Guinea[J]. Philos Trans R Soc Lond B Biol Sci, 2008, 363 (1510) : 3725–3739 . |
| [13] | Smith M. Human-and porcine-dura mater linked to iatrogenic CJD[J]. Tex Dent J, 2006, 123 (5) : 449. |
| [14] | Rudge P, Jaunmuktane Z, Adlard P, et al. Iatrogenic CJD due to pituitary-derived growth hormone with genetically determined incubation times of up to 40 years[J]. Brain, 2015 : . |
| [15] | Buschmann A, Gretzschel A, Biacabe AG, et al. Atypical BSE in Germany-proof of transmissibility and biochemical characterization[J]. Vet Microbiol, 2006, 117 (2/4) : 103–116 . |
| [16] | Comoy EE, Casalone C, Lescoutra-Etchegaray N, et al. Atypical BSE (BASE) transmitted from asymptomatic aging cattle to a primate[J]. PLoS One, 2008, 3 (8) : . |
| [17] | Balkema-Buschmann A, Ziegler U, McIntyre L, et al. Experimental challenge of cattle with German atypical bovine spongiform encephalopathy (BSE) isolates[J]. J Toxicol Environ Health A, 2011, 74 (2/4) : 103–109 . |
| [18] | Ono F, Tase N, Kurosawa A, et al. Atypical L-type bovine spongiform encephalopathy (L-BSE) transmission to cynomolgus macaques, a non-human primate[J]. Jpn J Infect Dis, 2011, 64 (1) : 81–84 . |
| [19] | Priemer G, Balkema-Buschmann A, Hills B, et al. Biochemical characteristics and PrPsc distribution pattern in the brains of cattle experimentally challenged with H-type and L-type atypical BSE[J]. PLoS One, 2013, 8 (6) : . |
| [20] | Will R, Head M. A new prionopathy[J]. Ann Neurol, 2008, 63 (6) : 677–678 . |
| [21] | Zou WQ, Gambetti P, Xiao XZ, et al. Prions in variably protease-sensitive prionopathy: an update[J]. Pathogens, 2013, 2 (3) : 457–471 . |
| [22] | Notari S, Xiao XZ, Espinosa JC, et al. Transmission characteristics of variably protease-sensitive prionopathy[J]. Emerg Infect Dis, 2014, 20 (12) : 2006–2014 . |
| [23] | Cassard H, Torres JM, Lacroux C, et al. Evidence for zoonotic potential of ovine scrapie prions[J]. Nat Commun, 2014 : 5821. |
| [24] | Comoy EE, Mikol J, Luccantoni-Freire S, et al. Transmission of scrapie prions to primate after an extended silent incubation period[J]. Sci Rep, 2015 : 11573. |
| [25] | Bradbury J. Maternal transmission of BSE demonstrated in cattle[J]. Lancet, 1996, 348 (9024) : 393. |
| [26] | Bosch X. European concern over BSE transmission[J]. JAMA, 2001, 285 (4) : 397–398 . |
| [27] | Pincock S. Patient's death from vCJD may be linked to blood transfusion. Committee to discuss need for further precautions to prevent possible vCJD transmission through blood[J]. Lancet, 2004, 363 (9402) : 43. |
| [28] | Douet JY, Bujdoso R, Andréoletti O. Leukoreduction and blood-borne vCJD transmission risk[J]. Curr Opin Hematol, 2015, 22 (1) : 36–40 . |
| [29] | Gill ON, Spencer Y, Richard-Loendt A, et al. Prevalent abnormal prion protein in human appendixes after bovine spongiform encephalopathy epizootic: large scale survey[J]. Br Med J, 2013, 347 (7929) : . |
| [30] | Beekes M, Thomzig A, Schulz-Schaeffer WJ, et al. Is there a risk of prion-like disease transmission by Alzheimer-or Parkinson-associated protein particles?[J]. Acta Neuropathol, 2014, 128 (4) : 463–476 . |
| [31] | Kumar A, Pate KM, Moss MA, et al. Self-propagative replication of Amyloid-βoligomers suggests potential transmissibility in Alzheimer disease[J]. PLoS One, 2014, 9 (11) : . |
| [32] | Sabate R, Rousseau F, Schymkowitz J, et al. Amyloids or prions? That is the question[J]. Prion, 2015, 9 (3) : 200–206 . |
 2016, Vol. 31
2016, Vol. 31


