扩展功能
文章信息
- 王怡婷, 金东, 杨晶, 卢珊, 濮吉, 孟祥莉, 张桂, 徐建国
- WANG Yi-ting, JIN Dong, YANG Jing, LU Shan, PU Ji, MENG Xiang-li, ZHANG Gui, XU Jian-guo
- 喜马拉雅旱獭源鹑鸡肠球菌的分离及其耐药性检测
- Isolation and antibiotic resistance detection of Enterococcus gallinarums from Marmota himalayana
- 疾病监测, 2016, 31(5): 380-386
- Disease Surveillance, 2016, 31(5): 380-386
- 10.3784/j.issn.1003-9961.2016.05.008
-
文章历史
- 收稿日期:2016-03-08
鹑鸡肠球菌(Enterococcus gallinarum)1984年首次从鸡粪便样本中分离得到,可引起人类感染,包括尿路感染、腹腔感染以及败血症、伤口感染、心内膜炎和脑膜炎等[1-2]。近年来研究发现,鹑鸡肠球菌对多种抗菌药物的耐药性呈上升趋势[3]。耐万古霉素鹑鸡肠球菌甚至可引起院内感染暴发。我国不同地区均可见关于鹑鸡肠球菌感染病例的报道,尤其多见于医院院内感染病例[4-6]。根据中国CHINET细菌耐药性监测网报道,2011年全国15所医院共计分离到102株鹑鸡肠球菌,分离率为2.2%,对万古霉素耐药率为82.7%,对磷霉素、氯霉素的耐药率分别为13.6%和7.5%,但对替考拉宁、利奈唑胺高度敏感[3]。
国外研究显示,鹑鸡肠球菌在多种野生动物的分离率较高,其中红鸠 71.2%,白鹳 46.9%,红腿鸽7.9%,野熊 4.9%。大多数鹑鸡肠球菌对四环素(66.3%)和红霉素(46.1%)耐药,对卡那霉素、庆大霉素、链霉素的耐药率分别为22.9%、9.4%和11.5%[7]。我国科学家从猪及禽类动物中也分离到鹑鸡肠球菌[8-9]。本研究从青藏高原捕获的79只喜马拉雅旱獭中分离鹑鸡肠球菌,并对其药物敏感性、耐药基因和常见毒力基因进行检测,以了解我国青藏高原喜马拉雅旱獭携带鹑鸡肠球菌的药物敏感性和致病性状况。
1 材料与方法 1.1 标本采集2013年78月在青海省玉树地区(N33°,E96°)采集标本。主要为国家动物鼠疫监测项目中捕获的喜马拉雅旱獭,鼠疫菌检测阴性,取其大肠肠段及肠内容物标本,置30%甘油保菌液的5 ml灭菌医用采样管中,立即冻存于低温冰箱,运输至本实验室,-80 ℃低温保存。
1.2 菌株分离与鉴定 1.2.1 菌株分离用无菌接种环蘸取少许旱獭粪便,三区划线接种于K-F链球菌选择性培养基,36 ℃、5%CO2孵箱培养48 h。挑取可疑单菌落,划线接种于哥伦比亚血平板,相同条件下进行纯化培养。纯培养物保存于含20%甘油的脑心浸液保菌液中,-80 ℃冰箱冻存。
1.2.2 生化鉴定使用法国生物梅里埃公司的API 20 Strep生化试剂条完成生化鉴定。挑取经纯化后的单菌落制成菌悬液并接种于API 20 Strep试剂条,培养24 h后根据实验说明加入指示剂,根据说明书判读反应,用apiweb 1.1.0软件鉴定试验结果。
1.2.3 细菌16SrRNA基因扩增、测序和分析 菌株核酸用全基因组核酸提取试剂盒(Genomic DNA purification kit,Promega)提取,步骤按说明书进行。16S rRNA基因PCR扩增体系为:10×rTaq PCR Buffer 5 μl,dNTP(2.5 mmol/L)2.5 μl,TaKaRa exTaq 0.5 μl,模板DNA(≤100 ng/μl)2 μl,上下游引物27F:AGA GTT TGA TCM TGG CTC AG;1492R:ACG GYT ACC TTY TTA CGA CTT各1 μl[10],无菌去离子水补至50 μl。扩增参数:94 ℃,预变性5 min,94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸1 min,30个循环,72 ℃后延伸10 min。
用1.5%琼脂糖凝胶电泳检测PCR产物,目的条带单一且大小与预期一致者,切胶回收。使用胶回收试剂盒(QIAquick Gel extraction kit,Qiagen)纯化PCR产物后,进行16S rRNA基因T-A克隆。使用pGEMT-EASY载体;热激转化大肠埃希菌JM109感受态细胞。复苏1 h后涂布LB氨苄抗性平板(表面涂布X-gal和IPTG);37 ℃孵箱培养过夜,挑取白斑,提取质粒并进行双向测序;测序结果用DNAStar 7.1软件拼接及NCBI网站在线去除载体序列,最终获得16S基因序列于NCBI网站用BLAST进行在线比对。
利用Mega 5.1软件对分离的 3株鹑鸡肠球菌以及52株肠球菌属参考菌株的16S rRNA 基因序列进行分析,构建Neighbor-joining(NJ)系统进化树后,用bootstrapping法重复500次检验系统进化树上的分支点并删除<50的分支。
1.2.4 药敏试验药敏纸片(Antimicrobio Susceptibility Test Discs,OXOID)及MH琼脂(MuellerHinton Agar,OXOID)、抗菌药物种类详见表 4。药敏试验根据美国临床试验室标准委员会(CLSI)推荐的K-B(Kirby-Bauer)纸片法进行,用一次性采样棉拭子在血平板上挑取纯化好的单个菌落,悬于2 ml生理盐水中以制成比浊度为0.5麦氏单位的菌悬液;用一次性采样棉拭子蘸取调制好的菌悬液,挤去多余菌液,在MH琼脂平板上分3次均匀涂抹,每次涂抹好后转60°再次涂抹,最后在边缘转2圈以确保均匀涂布;放置3~5 min,待表面水分吸干后,用药敏纸片分配器将药敏纸片贴于平板上,37 ℃培养16~18 h后读取抑菌环直径。以粪肠球菌ATCC51299、金黄色葡萄球菌ATCC25923、粪肠球菌ATCC29212为质控菌株,参照CLSI 2015标准判读结果[11]。
1.2.5 耐药基因检测采用PCR方法检测青霉素类耐药相关基因pbp5C、pbp5N;万古霉素耐药相关基因vanA、vanB、vanC1及vanC2;红霉素耐药相关基因ermA、ermB和ermC;四环素类耐药相关基因tetW和tetM;喹诺酮类抗生素耐药相关基因gyrA和parC;磷霉素类耐药相关基因fosA、fosB和fosC;奎奴普丁耐药相关钝化酶基因vatA、vatB、vatC、vatD和vatE;奎奴普丁耐药外排相关基因lsaE、msrC、vgaA和vgaB;链阳酶素失活酶编码相关的vgbA、vgbB基因。耐药基因引物及PCR扩增条件见表 1。
| 基因名 | 引物序列(5′~3′) | 退火温度(℃) | 产物大小(bp) | 参考文献 |
| pbp5C | F:AAC AAA ATG ACA AAC GGG | 54 | 779 | [12] |
| R:TAT CCT TGG TTA TCA GGG | ||||
| pbp5C | F:AAA AAT CGA ACA ACA GGC GCT TA | 54 | 1164 | [13] |
| R:TTG TGA GATC CCG TTT GTC A | ||||
| vanA | F:GGG AAA ACG ACA ATT GC | 55 | 732 | [14] |
| R:GTA CAA TGC GGC CGT TA | ||||
| vanB | F:ATG GGA AGC CGA TAG TC | 55 | 635 | [14] |
| R:GAT TTC GTT CCT CGA CC | ||||
| vanC1 | F:GAA AGA CAA CAG GAA GAC CGC | 54 | 796 | [15] |
| R:ATC GCA TCA CAA GCA CCA ATC | ||||
| vanC2 | F:CGG GGA AGA TGG CAG TAT | 54 | 484 | [15] |
| R:CGC AGG GAC GGT GAT TTT | ||||
| ermA | F:TCT AAA AAG CAT GTA AAA GAA | 47 | 645 | [16] |
| R:CTT CGA TAG TTT ATT AAT ATT AGT | ||||
| ermB | F:GAA AAG GTA CTC AAC CAA ATA | 50 | 639 | [16] |
| R:AGT AAC GGT ACT TAA ATT GTT TAC | ||||
| ermC | F:TCA AAA CATA ATA TAG ATA AA | 48 | 642 | [16] |
| R:GCT AAT ATT GTT TAA ATC GTC AAT | ||||
| tetW | F:GAG AGC CTG CTA TAT GCC AGC | 168 | 59 | [17] |
| R:GGG CGT ATC CAC AAT GTT AAC | ||||
| tetM | F:AGT TTT AGC TCA TGT TGA TG | 1863 | 55 | [17] |
| R:TCC GAC TAT TTA GAC GAC GG | ||||
| gyrA | F:CGG GAT GAA CGA ATT GGG TGT GA | 62 | 241 | [18] |
| R:AAT TTT ACT CAT ACG TGC TTC GG | ||||
| parC | F:TTC CCG TGC ATT TCG ATC AGT ACT TC | 62 | 191 | [19] |
| R:CGT ATG ACA AAG GAT TCG GTA AAT C | ||||
| fosA | F:GCT GCA CGC CCG CTG GAA TA | 62 | 217 | [20] |
| R:CGA CGC CCC CTC GCT TTT GT | ||||
| fosB | F:CAG AGA TAT TTT AGG GGC TGA CA | 58 | 312 | [20] |
| R:CTC AAT CTA TCT TCT AAA CTT CCT G | ||||
| fosC | F:GGG TTA CAT GCC CTT GCT CA | 60 | 354 | [20] |
| R:AAC CCG CAC AAC GAC AGA TG | ||||
| vatA | F:TGG AGT GTG ACA AGA TAG GC | 55 | 512 | [21] |
| R:GTG ACA ACA GCT TCT GCA GC | ||||
| vatB | F:GAA AAG AAT TGA AAA GCC TAA | 55 | 642 | [22] |
| R:CGT GTG TAA GTT CTT AGA ATC | ||||
| vatC | F:ATG AAT TCG CAA AAT CAG CAA GG | 60 | 579 | [21] |
| R:TCG TCT CGA GCT CTA GGT CC | ||||
| vatD | F:GCT CAA TAG GAC CAG GTG TA | 55 | 271 | [21] |
| R:TCC AGC TAA CAT GTA TGG CG | ||||
| vatE | F:ACT ATA CCT GAC GCA AAT GC | 52 | 511 | [21] |
| R:GGT TCA AAT CTT GGT CCG | ||||
| lsaE | F:TTG TAC GGA ATG TAT GG | 52 | 675 | [23] |
| R:TTC GCT TCT ATT AAG CAC TCT T | ||||
| vgaA | F:AGT GGT GGT GAA GTA ACA CG | 55 | 659 | [21] |
| R:CTT GTC TCC TCC GCG AAT AC | ||||
| vgaB | F:TGA CAA TAT GAG TGG TGG TG | |||
| R:GCG ACC ATG AAA TTG CTC TC | 52 | 576 | [21] | |
| msrC | F:AAG GAA TCC TTC TCT CTC CG | 52 | 343 | [24] |
| R:GTA AAC AAA ATC GTT CCC G | ||||
| vgbA | F:TAC AGA GTA CCC ACT ACC GA | 52 | 570 | [21] |
| R:TCA ATT CCT GCT CCA GCA GT | ||||
| vgbB | F:CAG CAG TCT AGA TCA GAG TGG | 60 | 424 | [21] |
| R:CAT ACG GAT CCA TCT TTT CC | ||||
| rtg1438 | F:ATG CAT GAA TTC CGA GGC GGC CGA GGG TTG T | 55 | 550 | [25] |
| R:ATG CAT AAG CTT CCG CGA GCG AGG ACC ACA CG |
根据文献[26],检测asa1、gelE、cylA、esp及hyl。PCR扩增采用50 μl体系:2×Taq MasterMix 25 μl、浓度为10 μmol/L的上下游引物各2.5 μl 加水至48 μl、模板DNA 2 μl;PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s;30个循环,最后72 ℃ 10 min完成扩增,相关引物见表 2。
| 基因名称 | 毒力因子 | 引物序列(5′~3′) | 产物大小(bp) |
| asa1 | 聚合物因子 | GCA CGC TAT TAC GAA CTA TGA | 375 |
| TAA GAA AGA ACA TCA CCA CGA | |||
| gelE | 明胶酶 | TAT GAC AAT GCT TTT TGG GAT | 213 |
| AGA TGC ACC CGA AAT AAT ATA | |||
| cylA | 细胞溶血素 | ACT CGG GGA TTG ATA GGC | 688 |
| GCT GCT AAA GCT GCG CTT | |||
| esp | 肠球菌表面蛋白 | AGA TTT CAT CTT TGA TTC TTG G | 510 |
| AAT TGA TTC TTT AGC ATC TGG | |||
| hyl | 透明质酸酶 | ACA GAA GAG CTG CAG GAA ATG | 276 |
| GAC TGA CGT CCA AGT TTC CAA |
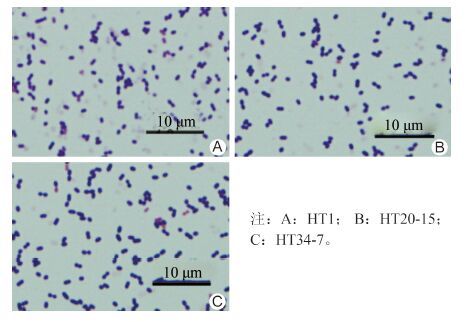
79份旱獭的肠道标本共分离到3株鹑鸡肠球菌,根据旱獭来源的不同,分别命名为HT 1、HT 20-15、HT 34-7。在哥伦比亚血平板上生长较好;革兰染色为阳性,镜下呈圆球状或椭球状,无芽孢、无鞭毛,属兼性厌氧菌(图 1)。
|
| 图 1 3株鹑鸡肠球菌(革兰染色×1000) Figure 1 Gram staining of 3 E. gallinarum(isolates×1000) |
| |
菌株生化结果见表 3。3株菌均能发酵D-核糖、L-阿拉伯糖、D-甘露醇、D-乳糖、D-海藻糖及淀粉;HT 1、HT 20-15 可发酵D-棉子糖,三者均不发酵D-山梨醇、菊糖(菊根粉)、糖原;VP试验、马尿酸钠水解试验、七叶灵、吡咯烷酮芳胺酶试验、α-半乳糖苷酶、β-葡萄糖醛酸酶、β-半乳糖苷酶、亮氨酸芳胺酶、精氨酸双水解酶试验均为阳性;碱性磷酸酶试验阴性,无β-溶血现象。
| 生化反应 | HT 1 | HT 20-15 | HT 34-7 | API 参考结果 |
| VP试验 | + | + | + | + |
| 马尿酸钠水解试验 | + | + | + | + |
| 七叶灵 | + | + | + | + |
| 吡咯烷酮芳胺酶试验 | + | + | + | + |
| α-半乳糖苷酶 | + | + | + | + |
| β-葡萄糖醛酸酶 | + | + | + | + |
| β-半乳糖苷酶 | + | + | + | + |
| 碱性磷酸酶 | - | - | - | - |
| 亮氨酸芳胺酶 | + | + | + | + |
| 精氨酸双水解酶 | + | + | + | + |
| D-核糖 | + | + | + | + |
| L-阿拉伯糖 | + | + | + | + |
| D-甘露醇 | + | + | + | + |
| D-山梨醇 | - | - | - | - |
| D-乳糖(牛源) | + | + | + | + |
| D-海藻糖 | + | + | + | + |
| 菊糖(菊根粉) | - | - | - | + |
| D-棉子糖 | + | + | - | + |
| 淀粉 | + | + | + | + |
| 糖原 | - | - | - | - |
| β溶血 | - | - | - | - |
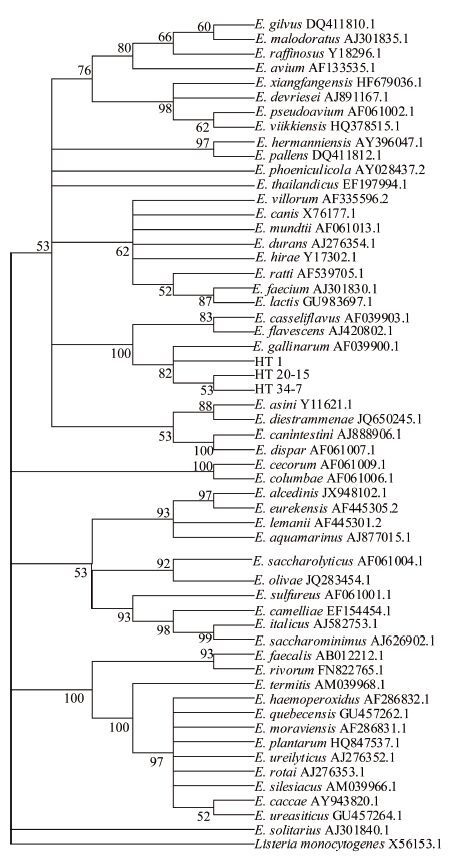
扩增测序后获得约1.5 kb大小的16S rRNA基因序列,从公共数据库获得已经发表的肠球菌属52株参考菌株的16S rRNA 基因序列,以单增李斯特菌为外群,使用Neighbor-joining方法构建系统发育图。从图 2可知,分离的3株菌与鹑鸡肠球菌标准菌株E. gallinarum AF 039900.1位于同一分支。
2.2 药敏试验HT 20-15对利福平中介,3株鹑鸡肠球菌均对奎奴普丁中介,对其他抗菌药物均敏感。
| 药物名称 | 药物分类 | 规格(μg) | 药敏结果 | ||
| HT 1 | HT 20-15 | HT 34-7 | |||
| 青霉素G | 青霉素类 | 10 | S | S | S |
| 氨苄西林 | 青霉素类 | 20 | S | S | S |
| 万古霉素 | 糖肽类 | 30 | S | S | S |
| 红霉素 | 大环内酯类 | 15 | S | S | S |
| 四环素 | 四环素类 | 30 | S | S | S |
| 强力霉素 | 四环素类 | 30 | S | S | S |
| 左氧氟沙星 | 喹诺酮类 | 5 | S | S | S |
| 环丙沙星 | 喹诺酮类 | 5 | S | S | S |
| 呋喃妥因 | 硝基呋喃类 | 300 | S | S | S |
| 利福平 | 利福霉素类 | 5 | S | I | S |
| 磷霉素 | 磷霉素类 | 30 | S | S | S |
| 氯霉素 | 氯霉素类 | 30 | S | S | S |
| 奎奴普丁 | 链阳性菌素类 | 15 | I | I | I |
| 利奈唑胺 | 唑烷酮类 | 30 | S | S | S |
| 高浓度庆大霉素 | 氨基糖苷类 | 120 | S | S | S |
| 注:S(Sensitive),敏感; I(Intermidiate),中介。 | |||||
|
| 图 2 Neighbor-joining 方法构建的基于16S rRNA序列的肠球菌属系统发育图 Figure 2 Neighbour-joining phylogenic tree ofEnterococcus based on 16S rRNA sequence |
| |
3株鹑鸡肠球菌的低浓度万古霉素耐药相关基因vanC1阳性,青霉素类耐药相关基因pbp5C、pbp5C,万古霉素耐药相关基因vanA、vanB及vanC2,红霉素耐药相关基因ermA、ermB、ermC,四环素类耐药相关基因tetW、tetM,喹诺酮类抗生素耐药相关基因gyrA、parC,利福平耐药相关基因rtg1438,磷霉素类耐药相关基因fosA、fosB、fosC,奎奴普丁耐药相关基因vatA、vatB、vatC、vatD、vatE、lsaE、msrC、vgaA、vgaB、vgbA、vgbB均为阴性。
2.3.2 毒力基因检测3株菌中均未检测到聚合物因子基因(asa1)、明胶酶基因(gelE)、细胞溶血素基因(cylA)、肠球菌表面蛋白基因(esp)及透明质酸酶基因(hyl)。
3 讨论鹑鸡肠球菌临床报道分离率低于粪肠球菌、屎肠球菌,可引起院内感染暴发,是重要的院内感染病原菌。由于开展的分离工作和研究较少,现有报道可能并不能反映实际情况。目前我国鹑鸡肠球菌的研究多集中于从院感患者分离病原菌并对其进行耐药性分析[27-29]。西班牙报道鹑鸡肠球菌在一些野生动物的分离率可高达50%左右[7],提示其在野生动物中可能广泛存在,医学意义可能被低估。根据美国食品药品管理局的研究表明,从奶牛及禽类等与人类密切接触的动物体内分离的鹑鸡肠球菌对万古霉素、庆大霉素、链阳酶素、四环素、红霉素、杆菌肽及环丙沙星等多种抗菌药物耐药;此外,从临床样本中分离的1株鹑鸡肠球菌经证实含有毒力基因cylA及esp[30]。我国鹑鸡肠球菌的耐药情况也较为严重,其对多种抗菌药物耐药;广东省报道从临床分离的30株鹑鸡肠球菌对青霉素耐药率高达95%以上,对红霉素、利福平、环丙沙星、庆大霉素及四环素的耐药率均高达70%以上[31]。
3株菌生化结果显示均不发酵菊糖,HT 34-7不发酵D-棉子糖。经计算API编码值并使用apiweb软件判读结果,鉴定为鹑鸡肠球菌。在16S rRNA 基因系统发育图中,HT 1、HT 20-15及HT 34-7与鹑鸡肠球菌标准菌株AF039900.1聚类于同一分支,表明在进化关系上3株菌与鹑鸡肠球菌同源性最高。经生化反应及16S rRNA 基因序列聚类分析,最终鉴定3株菌株为鹑鸡肠球菌。
不同于其他研究中分离的菌株,喜马拉雅旱獭肠道分离的3株鹑鸡肠球菌对15种常见抗菌药物均不耐药,且不携带常见的肠球菌属毒力基因和耐药基因。
喜马拉雅旱獭是青藏高原的特有物种,也是鼠疫菌的重要动物宿主之一。我国鼠疫防控的重要措施是严格限制人类和旱獭接触。因此,喜马拉雅旱獭肠道菌群相对而言较少或几乎没有受到人类的影响。从喜马拉雅旱獭中分离到3株鹑鸡肠球菌未检测到毒力基因和耐药基因,提示鹑鸡肠球菌最初可能来源于动物且未携带耐药基因及毒力基因,对人类无致病性。随着抗菌药物在畜牧业生产中的大量使用,细菌可能在进化过程中获得耐药基因以及毒力基因,最终产生耐药性和致病性。
| [1] | Sood S, Malhotra M, Das BK, et al. Enterococcal infections & antimicrobial resistance[J]. Indian J Med Res, 2008, 128 (2) : 111–121 . |
| [2] | Murray BE. The life and times of the Enterococcus[J]. Clin Microbiol Rev, 1990, 3 (1) : 46–65 . |
| [3] | Hu FP, Zhu DM, Wang F, et al. 2011 CHINET surveillance of bacterial resistance in China[J]. Chinese Journal of Infection and Chemotherapy, 2012, 12 (5) : 321–329 .(in Chinese) 胡付品, 朱德妹, 汪复, 等. 2011年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2012,12 (5) :321–329. |
| [4] | Cooper MP, Lessa F, Brems B, et al. Outbreak of Enterococcus gallinarum infections after total knee arthroplasty[J]. Infect Control Hosp Epidemiol, 2008, 29 (4) : 361–363 . |
| [5] | Reid KC, Cockerill III FR, Patel R. Clinical and epidemiological features of Enterococcus casseliflavus/flavescens and Enterococcus gallinarum bacteremia:a report of 20 cases[J]. Clin Infect Dis, 2001, 32 (11) : 1540–1546 . |
| [6] | Li S, Zhang Z, Mi ZH. Vancomycin-resistant enterococci in a Chinese hospital[J]. Curr Microbiol, 2007, 55 (2) : 125–127 . |
| [7] | Lozano C, Gonzalez-Barrio D, Camacho MC, et al. Characterization of fecal vancomycin-resistant enterococci with acquired and intrinsic resistance mechanisms in wild animals, Spain[J]. Microb Ecol, 2015 : 1–8 . |
| [8] | Liu Y, Wang Y, Dai L, et al. First report of multiresistance gene cfr in Enterococcus species casseliflavus and gallinarum of swine origin[J]. Vet Microbiol, 2014, 170 (3/4) : 352–357 . |
| [9] | Yuan L, Fu XL, Liu JH, et al. Genotype identifications of ESBLs and AmpC β-lactamase of a Enterococcus gallinarum isolated from chloebiagouidiae[J]. Chinese Journal of Veterinary Science, 2009, 29 (7) : 858–863 .(in Chinese) 苑丽, 付秀玲, 刘建华, 等. 1株鹑鸡肠球菌产ESBLs和AmpC酶的基因型鉴定[J]. 中国兽医学报,2009,29 (7) :858–863. |
| [10] | Jin D, Chen C, Li LQ, et al. Dynamics of fecal microbial communities in children with diarrhea of unknown etiology and genomic analysis of associated Streptococcus lutetiensis[J]. BMC Microbiol, 2013 : 141. |
| [11] | CLSI.M100-S24 Performance standards for antimicrobial susceptibility testing: twenty-fourth informational supplement[S].Wayne, PA: Clinicaland Laboratory Standards Institute,2014. |
| [12] | Jureen R, Top J, Mohn SC, et al. Molecular characterization of ampicillin-resistant Enterococcus faecium isolates from hospitalized patients in Norway[J]. J Clin Microbiol, 2003, 41 (6) : 2330–2336 . |
| [13] | Klibi N, Sáenz Y, Zarazaga M, et al. Polymorphism in pbp5 gene detected in clinical Enterococcus faecium strains with different ampicillin MICs from a Tunisian hospital[J]. J Chemother, 2008, 20 (4) : 436–440 . |
| [14] | Dutka-Malen S, Evers S, Courvalin P. Detection of glycopeptide resistance genotypes and identification to the species level of clinically relevant enterococci by PCR[J]. J Clin Microbiol, 1995, 33 (1) : 24–27 . |
| [15] | Clark NC, Teixeira LM, Facklam RR, et al. Detection and differentiation of vanC-1, vanC-2, and vanC-3 glycopeptide resistance genes in enterococci[J]. J Clin Microbiol, 1998, 36 (8) : 2294–2297 . |
| [16] | Sutcliffe J, Grebe T, Tait-Kamradt A, et al. Detection of erythromycin-resistant determinants by PCR[J]. Antimicrob Agents Chemother, 1996, 40 (11) : 2562–2566 . |
| [17] | Ng LK, Martin I, Alfa M, et al. Multiplex PCR for the detection of tetracycline resistant genes[J]. Mol Cell Probes, 2001, 15 (4) : 209–215 . |
| [18] | Korten V, Huang WM, Murray BE. Analysis by PCR and direct DNA sequencing of gyrA mutations associated with fluoroquinolone resistance in Enterococcus faecalis[J]. Antimicrob Agents Chemother, 1994, 38 (9) : 2091–2094 . |
| [19] | Deguchi T, Fukuoka A, Yasuda M, et al. Alterations in the GyrA subunit of DNA gyrase and the ParC subunit of topoisomerase Ⅳ in quinolone-resistant clinical isolates of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 1997, 41 (3) : 699–701 . |
| [20] | Chen CH, Xu XG, Qu TT, et al. Prevalence of the fosfomycin-resistance determinant, fosB3, in Enterococcus faecium clinical isolates from China[J]. J Med Microbiol, 2014, 63 (Pt 11) : 84–1489 . |
| [21] | Soltani M, Beighton D, Philpott-Howard J, et al. Mechanisms of resistance to quinupristin-dalfopristin among isolates of Enterococcus faecium from animals, raw meat, and hospital patients in Western Europe[J]. Antimicrob Agents Chemother, 2000, 44 (2) : 433–436 . |
| [22] | Jackson CR, Fedorka-Cray PJ, Barrett JB, et al. First report of vatB and vgaB from Enterococcus gallinarum in the USA[J]. Int J Antimicrob Agents, 2008, 31 (2) : 175–176 . |
| [23] | Li BB, Wendlandt S, Yao JN, et al. Detection and new genetic environment of the pleuromutilin–lincosamide–streptogramin a resistance gene lsa(E) in methicillin-resistant Staphylococcus aureus of swine origin[J]. J Antimicrob Chemother, 2013, 68 (6) : 1251–1255 . |
| [24] | McDermott PF, Cullen P, Hubert SK, et al. Changes in antimicrobial susceptibility of native Enterococcus faecium in chickens fed virginiamycin[J]. Appl Environ Microbiol, 2005, 71 (9) : 4986–4991 . |
| [25] | Spanogiannopoulos P, Thaker M, Koteva K, et al. Characterization of a rifampin-inactivating glycosyltransferase from a screen of environmental actinomycetes[J]. Antimicrob Agents Chemother, 2012, 56 (10) : 5061–5069 . |
| [26] | Vankerckhoven V, van Autgaerden T, Vael C, et al. Development of a multiplex PCR for the detection of asa1, gelE, cylA, esp, and hyl genes in enterococci and survey for virulence determinants among European hospital isolates of Enterococcus faecium[J]. J Clin Microbiol, 2004, 42 (10) : 4473–4479 . |
| [27] | Hou HL, Nie XH. Analysis of clinical characteristic and drug resistance of infected cases due to enterococcus gallinarum (a 35-case report)[J]. Journal of Clinical Pulmonary Medicine, 2010, 15 (3) : 308–309 .(in Chinese) 侯会玲, 聂秀红. 鹑鸡肠球菌感染的临床特点和耐药性分析(附35例)[J]. 临床肺科杂志,2010,15 (3) :308–309. |
| [28] | Wang SL, Qian XM. Analysis of clinical infection and antibiotic resistance of Enterococcus[J]. Laboratory Medicine, 2009, 24 (1) : 61–63 .(in Chinese) 王社梁, 钱小毛. 肠球菌临床感染及其耐药性分析[J]. 检验医学,2009,24 (1) :61–63. |
| [29] | Wang LL, Yang XY, Li G, et al. Clinical distribution of enterococci infection and drug resistance[J]. Chinese Journal of Nosocomiology, 2011, 21 (5) : 1043–1045 .(in Chinese) 王琳琳, 杨晓燕, 李刚, 等. 肠球菌属感染的临床分布及耐药性分析[J]. 中华医院感染学杂志,2011,21 (5) :1043–1045. |
| [30] | Khan SA, Nawaz MS, Khan AA, et al. Molecular characterization of multidrug-resistant Enterococcus spp. from poultry and dairy farms: detection of virulence and vancomyc in resistance gene markers by PCR[J]. Mol Cell Probes, 2005, 19 (1) : 27–34 . |
| [31] | Chen YQ, Jia J, Kuang ZW, et al. Study on distribution of clinical samples and drug resistance of Enterococcus gallinarum [J]. Journal of Clinical and Experimental Medicine, 2012, 11 (15) : 1211,1213.(in Chinese) 陈艳清, 贾建, 邝兆威, 等. 鹑鸡肠球菌感染的临床标本分布和耐药性分析[J]. 临床和实验医学杂志,2012,11 (15) :1211,1213. |
 2016, Vol. 31
2016, Vol. 31


