扩展功能
文章信息
- 张网, 白向宁, 赵爱兰, 许彦梅, 熊衍文
- ZHANG Wang, BAI Xiang-ning, ZHAO Ai-lan, XU Yan-mei, XIONG Yan-wen
- 多重PCR方法鉴定六类致泻性大肠埃希菌和志贺菌
- Multiplex polymerase chain reaction for identification of six diarrheagenic Escherichia coli and Shigella
- 疾病监测, 2016, 31(5): 416-421
- Disease Surveillance, 2016, 31(5): 416-421
- 10.3784/j.issn.1003-9961.2016.05.015
-
文章历史
- 收稿日期:2016-01-13
大肠埃希菌(Escherichia coli)是存在于人和温血动物肠道及食物、环境中的常见细菌。由于噬菌体、质粒等介导的水平基因转移或突变而获得特殊毒力因子的大肠埃希菌可引起尿道感染、败血症、脑膜炎、腹泻等,其中引起腹泻的大肠埃希菌称为肠道致病性大肠埃希菌或致泻性大肠埃希菌(Diarrheagenic E. coli,DEC)。目前主要将DEC分为六类,即肠产毒性大肠埃希菌(enterotoxigenic E. coli,ETEC)、肠致病性大肠埃希菌(enteropathogenic E. coli,EPEC)、肠侵袭性大肠埃希菌(enteroinvasive E. coli,EIEC)、肠出血性大肠埃希菌(enterohemorrhagic E. coli,EHEC)或产志贺毒素大肠埃希菌(Shigatoxin-producing E. coli,STEC)、肠集聚性大肠埃希菌(enteroaggregative E. coli,EAEC)及弥散黏附性大肠埃希菌(diffusely adherent E. coli,DAEC)[1]。
致泻性大肠埃希菌和志贺菌导致的腹泻发病率和死亡率在亚洲、非洲和拉丁美洲等发展中国家仍然高居不下[2]。最近我国调查表明,五类致泻性大肠埃希菌是引起我国5岁以下儿童最主要的病原菌[3]。常用的选择分离培养、生化鉴定、血清鉴定等费时费力,且不能有效区分DEC与非DEC。随着分子生物学技术和生物信息学的发展,采用多重PCR检测和鉴别DEC得到广泛发展。笔者最近的研究表明,DAEC在我国腹泻患者粪便中的分离率约为6%,值得关注[4]。而目前我国检测DEC的PCR方法中,尚不包括DAEC的检测。此研究在本实验室已建立的鉴定五类DEC和志贺菌多重PCR方法的基础上[5],增加了可检测DAEC的afaD基因和ETEC的另外一种猪源性耐热肠毒素基因estIa。因此本研究的多重PCR包含了鉴定STEC(eae、 stx1、 stx2)、ETEC(elt、 estIa、 estIb)、EAEC(aggR)、EPEC(eae)、EIEC(ipaH)和DAEC(afaD)的毒力基因,是目前较为完善的包括六类DEC的检测和鉴定方法,可为临床检验和感染性腹泻监测实验室提供技术支持。
1 材料与方法 1.1 菌株资料选取174株六类DEC,包括EPEC 34株、EAEC 53株、ETEC 25株、EHEC 20株、EIEC 13株、DAEC 29株;志贺菌24株,包括痢疾志贺菌5株、宋内志贺菌2株、鲍氏志贺菌5株、福氏志贺菌12株。除各标准菌株E2348/69(EPEC)、Ec042(EAEC)、10407(ETEC)、Xuzhou21(EHEC)、44825(EIEC)、DA07(DAEC)、2a 301(福氏志贺菌)、Ss046(宋内志贺菌)、Sd197(痢疾志贺菌)、Sb227(鲍氏志贺菌)及非DEC K12 DH5α外,其他菌株分离自腹泻患者、动物粪便或食物,经生化反应和毒力基因检测等鉴定后由中国疾病预防控制中心传染病预防控制所新病原室保存。常见肠道病原菌阴性对照菌株44株,包括非DEC(5株)、弗氏枸橼酸杆菌(4株)、小肠结肠炎耶尔森菌(4株)、单增李斯特菌(3株)、伊氏李斯特菌(3株)、普通变形杆菌(2株)、奇异变形杆菌(3株)、粪肠球菌(4株)、屎肠球菌(2株)、霍乱弧菌(2株)、副溶血性弧菌(1株)、类志贺邻单胞菌(1株)、甲型副伤寒沙门菌(1株)、肠炎沙门菌(1株)、猪霍乱沙门菌(1株)、运动克雷伯菌(1株)、肺炎克雷伯菌(1株)、粘质沙雷菌(1株)、摩氏摩根菌(1株)、阴沟肠杆菌(1株)、铜绿假单胞菌(1株)、鲍曼不动杆菌(1株)。
1.2 试剂与仪器细菌基因组DNA提取试剂盒(BacteriaGen DNA Kit)、2 × Taq Master Mix、dNTP购自北京康为世纪生物科技有限公司;脑心浸液培养基购自北京陆桥技术有限公司;rTaq DNA聚合酶、10 × Buffer和DL2000 DNA Marker购自日本TaKaRa公司;PCR仪LabCycler购自德国SensoQuest公司;凝胶成像系统Gel Doc XR+购自美国Bio-Rad公司。
1.3 DNA模板提取实验菌株接种于脑心浸液平板培养18~24 h后,按照试剂盒具体操作步骤提取细菌基因组DNA,并置于-20 ℃冻存备用。
1.4 引物本研究的10对参考引物由生工生物工程(上海)股份有限公司合成,引物的序列及扩增片段长度见表 1。
| 基因名称 | 引物序列(5′-3′) | 扩增片段长度(bp) | 参考文献 |
| rrs | F:CCC CCT GGA CGA AGA CTG AC R:ACC GCT GGC AAC AAA GGA TA | 401 | [5] |
| ipaH | F:GTT CCT TGA CCG CCT TTC CGA TAC CGT C R:GCC GGT CAG CCA CCC TCT GAG AGT AC | 619 | [5] |
| stx1 | F:AAA TCG CCA TTC GTT GAC TAC TTC T R:TGC CAT TCT GGC AAC TCG CGA TGC A | 370 | [5] |
| stx2 | F: CAG TCG TCA CTC ACT GGT TTC ATC AC R:GGA TAT TCT CCC CAC TCT GAC ACC | 283 | [5] |
| eae | F:TCA ATG CAG TTC CGT TAT CAG TT R:GTA AAG TCC GTT ACC CCA ACC TG | 482 | [5] |
| aggR | F: GTA TAC ACA AAA GAA GGA AGC R: ACA GAA TCG TCA GCA TCA GC | 254 | [5] |
| elt | F:TCT CTA TGT GCA TAC GGA GC R:CCA TAC TGA TTG CCG CAA | 322 | [6] |
| estIa | F: TTT CCC CTC TTT TAG TCA GTC AA R:GCA GGA TTA CAA CAC AAT TCA CAG CAG | 159 | [6] |
| estIb | F:TGC TAA ACC AGT AGA GTC TTC AAA A R:GCA GGA TTA CAA CAC AAT TCA CAG CAG | 138 | [6] |
| afaD | F: TGA ACG GGA GTA TAA GGA AGA TG R: GTC CAC CTG ACG CTC ATT CA | 212 | [4] |
分别以标准菌株E2348/69、Ec042、10407、Xuzhou21、44825、DA07、2a 301、Ss046、Sd197、Sb227、K12 DH5α染色体为模板,扩增相应的eae、aggR、elt、estIa、estIb、stx1、stx2、ipaH、afaD及rrs基因片段。单重PCR反应采用20 μl的PCR体系:2 × Taq Master Mix 10 μl,上、下游引物分别为 0.5 μmol/L,模板2 μl,蒸馏水6 μl。PCR反应条件为:95 ℃预变性5 min,94 ℃变性30 s,58 ℃退火45 s,72℃延伸45 s,共30个循环,最后72 ℃再延伸10 min。取PCR扩增产物6 μl于1.5%琼脂糖凝胶电泳,观察分析是否扩增出特异性条带。将PCR扩增产物纯化后送北京天一辉远生物科技有限公司测序,结果与目的基因序列进行比对,验证扩增产物的准确性。
1.6 多重PCR条件优化以10株标准菌株染色体为模板,根据本实验室已建立的多重PCR反应体系和文献中已报道的引物浓度、扩增条件等,重新优化反应的各引物浓度配比、退火温度、循环次数等。PCR扩增产物用1.5%琼脂糖凝胶电泳分析,并与目的基因片段大小进行比较。
1.7 多重PCR特异性检测以标准菌株E2348/69、Ec042、10407、Xuzhou21、44825、DA07、2a 301、Ss046、Sd197、Sb227、K12 DH5α为阳性对照,44株常见肠道病原菌DNA为模板,应用优化后的PCR反应体系及条件对其进行引物特异性PCR扩增,琼脂糖凝胶电泳观察分析是否有特异性扩增产物以及产物的大小。
1.8 多重PCR灵敏度检测分别将标准菌株Ec042(aggR)、10407(elt、 estIa、 estIb)、Xuzhou21(eae、stx1、stx2)、44825(ipaH)、DA07(afaD)和临床分离菌株ET28(elt、 estIa)接种于脑心浸液平板培养18~24 h,取1 ~ 3个菌落于5 ml脑心浸液液体培养基中,于37 ℃恒温振荡200 rpm培养,制备 A600 =0.6的菌液,1 × 磷酸盐缓冲溶液1∶10倍比稀释菌液,分别取10-5~10-7浓度菌液100 μl于脑心浸液平板中,孵育箱37 ℃培养24 h后以平板计数法进行菌落计数;同时分别取各浓度菌液100 μl试剂盒提取制备50 μl DNA模板,各取2 μl进行PCR扩增和电泳检测,3次独立试验后,以每个反应可检出最低菌落形成单位为各检测基因的检测下限。
1.9 多重PCR方法检测分离菌株采用优化后的PCR反应体系和条件,检测和鉴定本实验室已分离鉴定的174株DEC和24株志贺菌,并与单重PCR方法和本实验室已建立的多重PCR检测结果进行比较。
2 结果 2.1 单重PCR验证引物及PCR产物测序结果分别以标准菌株E2348/69、Ec042、10407、Xuzhou21、44825、DA07、2a 301、Ss046、Sd197、Sb227、K12 DH5α染色体为模板,在单重PCR反应体系与条件下扩增相应目的基因,10株阳性对照菌株均可扩增出清晰特异条带,且阳性对照菌株和阴性对照菌株K12 DH5α的rrs扩增均为阳性。PCR扩增产物测序结果显示,特异基因序列与标准菌株相应目的基因序列相同。
2.2 多重PCR条件优化结果重新优化PCR反应的各引物浓度配比、退火温度、循环次数等后,发现最佳多重PCR反应体系为:各引物上下游引物浓度分别为eae 0.4 μmol/L,aggR 0.5 μmol/L,elt 2 μmol/L,estIa 2 μmol/L,estIb 2 μmol/L,stx1 0.5 μmol/L,stx2 0.5 μmol/L,ipaH 0.4 μmol/L,afaD 1 μmol/L及rrs 0.4 μmol/L,10 × buffer 10 μl,rTaq DNA聚合酶4 U,dNTP 400 μmol/L,加蒸馏水至50 μl。PCR扩增条件:95 ℃预变性5 min,94 ℃变性30 s,62 ℃退火45 s,72 ℃延伸45 s,共30个循环,最后72 ℃再延伸10 min。
2.3 多重PCR特异性检测结果标准菌株E2348/69、Ec042、10407、Xuzhou21、44825、DA07、 2a 301、Ss046、Sd197、Sb227均能扩增出相应特异性基因片段,且无非特异性扩增;作为阴性对照的常见肠道病原菌,包括非DEC、小肠结肠炎耶尔森菌、普通变形杆菌、奇异变形杆菌、类志贺邻单胞菌、甲型副伤寒沙门菌、肠炎沙门菌、猪霍乱沙门菌、运动克雷伯菌、肺炎克雷伯菌、黏质沙雷菌、摩氏摩根菌、阴沟肠杆菌、鲍曼不动杆菌除对rrs内参照基因有扩增外,对毒力基因无非特异性扩增。其他阴性对照菌株,包括弗氏枸橼酸杆菌、单增李斯特菌、伊氏李斯特菌、粪肠球菌、屎肠球菌、霍乱弧菌、副溶血性弧菌、铜绿假单胞菌,对rrs内参照基因和毒力基因均无非特异性扩增。
2.4 多重PCR灵敏度检测结果本研究的多重PCR引物检测效率不同,其中ipaH检测下限最低,为4.56 × 101 CFU/反应(1.14 × 104 CFU/ml),eae、stx1、stx2检测下限为4.0 × 102 CFU/反应(1.0 × 105 CFU/ml),estIa检测下限为5.72 × 102 CFU/反应(1.43 × 105 CFU/ml),elt、estIb检测下限为3.24 × 102 CFU/反应(8.1 × 104 CFU/ml),aggR检测下限为7.88 × 102 CFU/反应(1.97 × 105 CFU/ml),afaD检测下限为2.24 × 102 CFU/反应(5.60 × 104 CFU/ml)。
2.5 多重PCR方法检测分离菌株结果用优化后的10重PCR体系和反应条件对174株不同DEC和24株志贺菌进行检测,检测结果与单重PCR方法完全一致。所有菌株可分为15种基因型:EHEC有5种基因型,EAEC、EPEC、DAEC各有1种基因型。ETEC有4种基因型,与本实验室已建立的五类DEC多重PCR方法鉴定方法相比,增加了1种基因型elt + estIa。EIEC和志贺菌各有2种基因型,且基因ipaH不能区分两者,13株EIEC中,其中2株以本实验室已建立多重PCR鉴定为基因型为ipaH的菌株,在本研究方法中同时检测到了ipaH和afaD基因,检测结果见表 2,15种基因型的PCR扩增电泳结果见图 1。
| 菌株类型 | 菌株数 | 单重PCR/10重PCR检测结果 | ||||||||
| eae | stx1 | stx2 | elt | estIa | estIb | aggR | ipaH | afaD | ||
| EHEC | 5 | +/+ | +/+ | +/+ | ||||||
| 4 | +/+ | +/+ | ||||||||
| 6 | +/+ | |||||||||
| 4 | +/+ | |||||||||
| 1 | +/+ | +/+ | ||||||||
| ETEC | 5 | +/+ | +/+ | |||||||
| 5 | +/+ | +/+ | ||||||||
| 8 | +/+ | |||||||||
| 7 | +/+ | |||||||||
| EPEC | 34 | +/+ | ||||||||
| EAEC | 53 | +/+ | ||||||||
| EIEC | 11 | +/+ | ||||||||
| 2 | +/+ | +/+ | ||||||||
| DAEC | 29 | +/+ | ||||||||
| 志贺菌 | 1 | + | +/+ | |||||||
| 23 | +/+ | |||||||||
| 注:“+/+”表示单重PCR和本研究建立的多重PCR检测结果均为阳性。 | ||||||||||
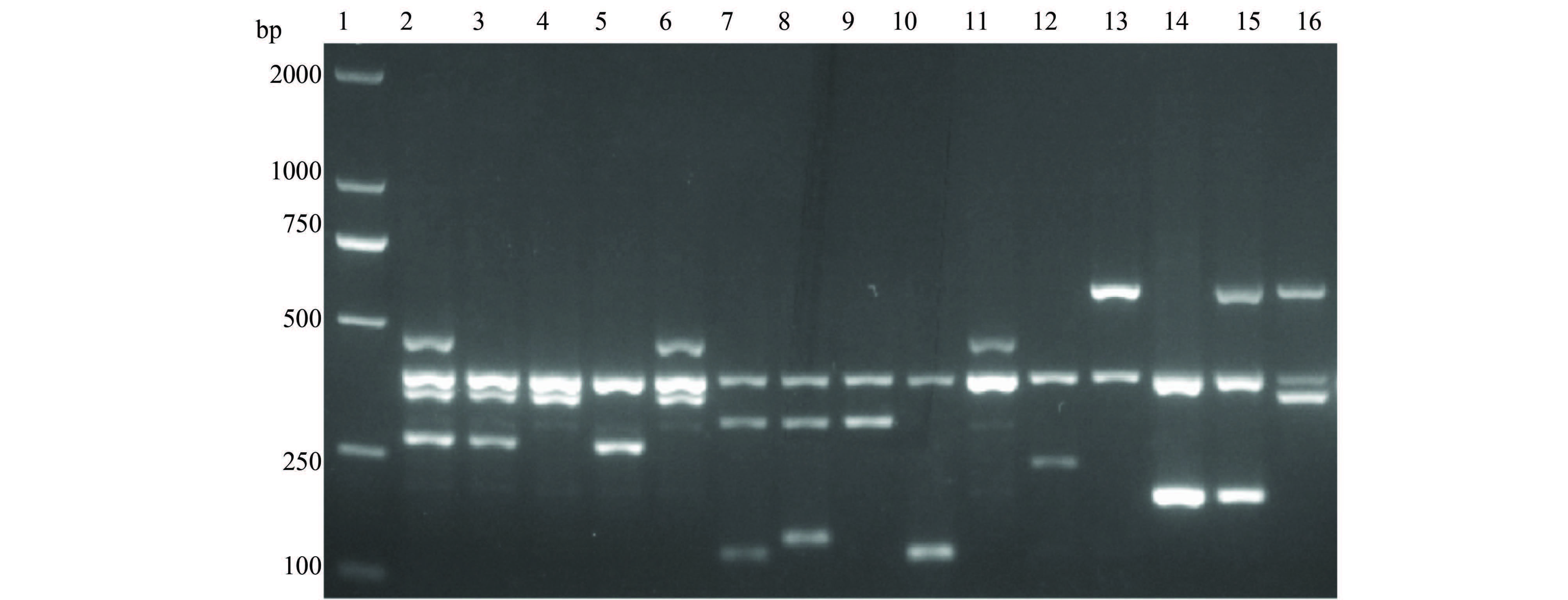
|
| 图 1 15种毒力基因型PCR扩增结果 Figure 1 Multiplex PCR amplification results of 15 virulence genes of diarrheagenic E. coli and Shigella strains |
| |
DEC和志贺菌导致的腹泻仍是发展中国家,尤其是亚洲、拉丁美洲、非洲等国家以及我国的重要公共卫生问题[2-3, 7]。由于非DEC在人体肠道及环境中广泛存在,依靠传统的分离培养、血清分型和生化鉴定方法费时费力,效率低下,且难以有效鉴别非DEC与DEC,不能满足临床检测和疾病监测基层实验室的需求。随着对DEC致病机制认识的深入,采用PCR方法检测不同的毒力基因来定义不同类型的DEC越来越被接受和广泛应用。DAEC主要引起18月龄至5岁儿童急性水样腹泻甚至持续血性腹泻,致病机制主要与afa/dra/daa操纵子编码的黏附素作用有关,操纵子包括afaF、afaA、afaB、afaC、afaD及afaE/daaE等多个基因[8]。其中C1845作为DAEC较为典型和重要的类型,常检测其黏附基因daaE作为鉴定DAEC的靶基因[9]。随着对DAEC认识的深入,发现daaE基因变异较大,以其为靶基因检测DAEC容易造成漏检。我国腹泻患者粪便分离的DAEC菌株检测结果也表明,只有少部分DAEC菌株daaE基因阳性,且daaE基因阳性菌株afaD基因也同时为阳性[4]。此外,afaD基因在DAEC菌株中相对保守和特异,因此是适合检测和鉴定DAEC的靶基因,在近年来也被逐渐采用[6, 10-11]。ETEC引起旅游者腹泻,主要分泌不耐热肠毒素LT和耐热肠毒素ST。ST主要分为STI和STII,其中STII目前尚未在人的分离株中发现,而STI据来源可分为STh/STIb和STp/STIa,STp/STIa可分离自人或动物[1]。有文献报道区别ETEC与其他DEC,对耐热肠毒素的检测常仅以estIb作为靶基因,可造成对一类产STp/STIa肠毒素ETEC菌株的漏检。本研究建立的多重PCR体系增加了对STp/STIa编码基因estIa的检测,可避免将含estIa的菌株误判为非DEC,在常规检测及暴发溯源工作中可发挥重要作用。
研究在本实验室已建立的鉴定五类DEC和志贺菌的多重PCR方法基础上,增加了可检测DAEC的黏附相关因子基因afaD和ETEC的另外一种耐热肠毒素STIa/STp的编码基因estIa,构建了10重PCR方法,可用于快速检测和鉴别六类DEC和志贺菌。对分离菌株的检测结果显示,所有EIEC和志贺菌均携带毒力基因ipaH。多序列和全基因组系统发育分析结果均表明EIEC和志贺菌序列差异不明显,且EIEC和志贺菌致病机制基本相同、引起腹泻的临床症状也极其相似。目前研究结果表明,最佳鉴别两者与其他DEC的毒力基因即为ipaH,进一步可依据系统生化鉴定,结合血清型等区分志贺菌与EIEC[12-13]。
本研究建立的10重PCR方法具有很好的特异性,对常见的致泻性病原菌均无非特异性扩增。2株ipaH阳性和生化鉴定为EIEC的菌株均检测为ipaH与afaD基因阳性,进一步对扩增产物测序,经序列比对分析后发现,2株菌EIEC的afaD基因序列与标准菌株DA07特异基因序列相似性高达 99%~100%,因此,可认为2株菌为同时含EIEC和DAEC毒力基因的杂合菌。同一大肠埃希菌菌株含2种不同致病类型的毒力基因并不少见,如2011年德国大肠埃希菌暴发菌株O104∶H4,即是在EAEC菌株(aggR阳性)遗传背景基础上,获得了产志贺毒素2的噬菌体(stx2阳性)和ESBL耐药质粒[14]。
本研究建立的多重PCR方法检测和鉴别六类DEC和志贺菌,可在一个反应体系中鉴定和区分DEC和志贺菌,为临床的快速检测、疾病预防控制的实验室筛查、腹泻的暴发溯源等提供了方便快捷的技术支持,有重要的公共卫生学意义。
| [1] | Croxen MA, Law RJ, Scholz R, et al. Recent advances in understanding enteric pathogenic Escherichia coli[J]. Clin Microbiol Rev, 2013, 26 (4) : 822–880 . |
| [2] | Kotloff KL, Nataro JP, Blackwelder WC, et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS):a prospective, case-control study[J]. Lancet, 2013, 382 (9888) : 209–222 . |
| [3] | Yu JX, Jing HQ, Lai SJ, et al. Etiology of diarrhea among children under the age five in China: results from a five-year surveillance[J]. J Infect, 2015, 71 (1) : 19–27 . |
| [4] | Zhang W, Bai XN, Xu YM, et al. Multiplex PCR detection of diffusely adherent Escherichia coli[J]. Chinese Journal of Zoonoses, 2016 : .(in Chinese) 张网, 白向宁, 许彦梅, 等. 多重PCR方法检测弥散黏附性大肠埃希菌[J]. 中国人兽共患病学报,2016 :. |
| [5] | Zhao AL, Xiong YW, Bai XM, et al. Multiplex PCR for identification of diarrheogenic Escherichia coli and Shigella spp[J]. Disease Surveillance, 2011, 26 (1) : 65–67 .(in Chinese) 赵爱兰, 熊衍文, 白雪梅, 等. 鉴定五类致泻性大肠埃希菌和志贺菌的多重PCR方法[J]. 疾病监测,2011,26 (1) :65–67. |
| [6] | Guion CE, Ochoa TJ, Walker CM, et al. Detection of diarrheagenic Escherichia coli by use of melting-curve analysis and real-time multiplex PCR[J]. J Clin Microbiol, 2008, 46 (5) : 1752–1757 . |
| [7] | Chen Y, Chen X, Zheng S, et al. Serotypes, genotypes and antimicrobial resistance patterns of human diarrhoeagenic Escherichia coli isolates circulating in southeastern China[J]. Clin Microbiol Infect, 2014, 20 (1) : 52–58 . |
| [8] | Zhang W, Xu YM, Xiong YW. Recent advances on diffusely adherent Escherichia coli[J]. Chin J Microbiol Immunol, 2015, 35 (6) : 473–476 .(in Chinese) 张网, 许彦梅, 熊衍文. 弥散黏附性大肠埃希菌研究进展[J]. 中华微生物学和免疫学杂志,2015,35 (6) :473–476. |
| [9] | Vidal M, Kruger E, Durán C, et al. Single multiplex PCR assay to identify simultaneously the six categories of diarrheagenic Escherichia coli associated with enteric infections[J]. J Clin Microbiol, 2005, 43 (10) : 5362–5365 . |
| [10] | Frommel U, Böhm A, Nitschke J, et al. Adhesion patterns of commensal and pathogenic Escherichia coli from humans and wild animals on human and porcine epithelial cell lines[J]. Gut Pathog, 2013, 5 (1) : 31. |
| [11] | Barletta F, Ochoa TJ, Cleary TG. Multiplex real-time PCR (MRT-PCR) for diarrheagenic[J]. Methods Mol Biol, 2013 : 307–314 . |
| [12] | Hsu BM, Wu SF, Huang SW, et al. Differentiation and identification of Shigella spp. and enteroinvasive Escherichia coli in environmental waters by a molecular method and biochemical test[J]. Water Res, 2010, 44 (3) : 949–955 . |
| [13] | van den Beld MJC, Reubsaet FAG. Differentiation between Shigella, enteroinvasive Escherichia coli (EIEC) and noninvasive Escherichia coli[J]. Eur J Clin Microbiol Infect Dis, 2012, 31 (6) : 899–904 . |
| [14] | Rasko DA, Webster DR, Sahl JW, et al. Origins of the E. coli strain causing an outbreak of hemolytic-uremic syndrome in Germany[J]. N Engl J Med, 2011, 365 (8) : 709–717 . |
 2016, Vol. 31
2016, Vol. 31


