扩展功能
文章信息
- 耿启彬, 赖圣杰, 余建兴, 张子科, 杨婉琪, 李中杰, 吴建国, 杨维中
- GENG Qi-bin, LAI Sheng-jie, YU Jian-xing, ZHANG Zi-ke, YANG Wan-qi, LI Zhong-jie, WU Jian-guo, YANG Wei-zhong
- 中国26省(直辖市、自治区)2011-2014年5岁以下儿童腹泻病例轮状病毒流行特征分析
- Epidemiological characteristics of rotavirus caused diarrhea in children aged < 5 years in 26 provinces in China, 2011-2014
- 疾病监测, 2016, 31(6): 463-470
- Disease Surveillance, 2016, 31(6): 463-470
- 10.3784/j.issn.1003-9961.2016.06.006
-
文章历史
- 收稿日期:2016-03-19
2. 中国疾病预防控制中心传染病预防控制处, 传染病监测预警中国疾病预防控制中心重点实验室, 北京 102206;
3. 南安普顿大学地理环境系, 南安普顿SO17 1BJ, 英国;
4. 中国医学科学院病原生物学研究所梅里埃实验室, 北京 100176;
5. 浙江大学医学院第一附属医院传染病诊断与治疗重点实验室, 浙江 杭州 310003;
6. 中国疾病预防控制中心, 北京102206
2. State Key Laboratory for Communicable Disease Control and Prevention, Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Department of Geography and Environment, University of Southampton, Southampton, SO17 1 BJ, UK;
4. Institute of Pathogen Biology, Chinese Academy of Medical Science, Beijing 100176, China;
5. Key Laboratory for Communicable Disease Diagnosis and Treatment, No. 1 Affiliated Hospital of Medical College of Zhejiang University, Hangzhou 310003, Zhejiang, China;
6. Chinese Center for Disease Control and Prevention, Beijing 102206, China
轮状病毒是世界上5岁以下儿童严重急性腹泻的主要病原体[1],疾病给医疗保健系统和患者家庭带来了巨大负担。每年全球约有60万5岁以下儿童死于轮状病毒感染。近85%与轮状病毒相关的腹泻发生在非洲和亚洲的贫困地区[2]。轮状病毒最早由Bishop和其同事于1973年发现,为呼肠孤病毒科双链无包膜RNA病毒[3]。病毒基因组包括11节双链RNA,编码6个结构蛋白(VPs) 和6个非结构蛋白(NSP)。外层蛋白VP4(糖蛋白)和VP7(蛋白酶切割蛋白)能导致人体产生中和抗体;VP6蛋白是病毒颗粒中间层的一个组分,具有抗原性并决定轮状病毒A~H组和亚组的特性[4-5],它们被用来研究和确定轮状病毒的不同毒株以及这些毒株的类型及其随着时空变化的规律[6]。已知A、B和C组轮状病毒可导致人类胃肠炎发生[4],其中A组轮状病毒是5岁以下儿童急性水样腹泻最为常见的病原体[4]。轮状病毒疫苗是预防轮状病毒腹泻的有效手段,然而,目前全国范围内轮状病毒的流行状况报道较少,轮状病毒疫苗也尚未列入我国计划免疫。2009年开始,由中国疾病预防控制中心牵头联合全国多家单位参与了传染病防治国家科技重大专项的“传染病监测技术平台”项目[7],旨在建立我国基于症候群的病原学监测实验网络,对具有腹泻症候群的临床病例开展轮状病毒等十余种肠道病原体的监测。本文拟对“十二五”期间(20112014年)腹泻症候群监测中收集的5岁以下儿童轮状病毒监测结果进行分析,以期为疫苗研究、推介,以及干预措施的制定等提供借鉴。
1 材料与方法 1.1 监测地区和医院在综合考虑轮状病毒的监测和实验室检测能力以及地域代表性的基础上,2011年1月1日至2014年12月31日,在全国26个省(直辖市、自治区)(不包括安徽、山西、广西、海南和西藏)选取162家哨点医院对“腹泻症候群”病例开展轮状病毒监测(图 1)。气候带的划分参考郑景云等[8]和余建兴等[9]的研究,地域的划分参考Zhou等[10]的研究,将我国大致分成7个地区,本次监测点设置综合考虑气候因素和地区差异对研究结果代表性的影响。
1.2 病例定义与纳入标准在每家哨点医院,医生或护士对到监测科室(内科、儿科和感染科门诊,以及急诊和肠道门诊)就诊的患者进行筛选,纳入符合“腹泻症候群”病例定义的患者。“腹泻症候群”监测病例定义为[11-12]:24 h内腹泻3次以上,并伴有粪便性状改变(如水样便、稀便、黏液便和血便等)的病例。纳入病例数量在综合考虑网络实验室的检测能力和哨点医院上年度的门急诊总量后确定(每家医院每年纳入腹泻症候群病例的中位数为106例)。哨点医院根据分配的任务量纳入符合病例定义的患者。为了解不同季节和地区的腹泻症候群病原体检出情况,每家哨点医院每月纳入的病例数要求不少于年度任务量的5%。
1.3 标本采集、检测与信息录入医生或护士在征得患者监护人口头知情同意后,使用无菌采样杯采集5 g粪便标本,不添加保存液,立即置于-20 ℃条件保存,如4 ℃以下保存,时间不超过48 h。采集的标本由专人负责运送至网络实验室。实验室工作人员在接到标本后,对标本的质量进行检查并逐一核对病例信息,对不符合要求的标本拒绝接收或要求重新采样、送样。全国共有92家实验室参与了“腹泻症候群”轮状病毒的实验室检测工作(图 1)。网络实验室使用酶联免疫吸附试验(ELISA)商品化试剂盒(ProSpecTTM Rotavirus kit,Oxoid Ltd,Basingstoke,UK)检测A组轮状病毒,对阳性标本采用反转录-聚合酶链反应(RT-PCR)和巢式PCR等技术做进一步基因分型;轮状病毒B和C组检测使用多重PCR的方法。检测流程(SOP)详见监测方案及相关报道[13-14]。粪便标本中病毒核酸的提取使用商品化试剂盒(No. VR100,Geneaid Biotech或No. 51304,Qiagen等公司),检测中使用的引物及其PCR产物信息详见表 1。对纳入研究的病例,由临床医生或护士使用统一的《腹泻症候群监测病例信息调查表》收集病例的人口学(性别、年龄、职业、住址)和临床信息(发病日期、就诊日期、症状、实验室检查和治疗情况)。病例个案信息和实验室检测结果由医生、护士或实验室工作人员录入中国疾病预防控制中心建立的网络信息报告管理系统。
1.4 数据分析阳性检出率反映监测病例中轮状病毒的流行水平。阳性检出率的95%置信区间(95%CI)使用二项分布方法计算。率的比较使用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。采用Excel 2016软件整理数据,使用R 2.15.3软件进行统计分析,并采用ArcGIS 10.0绘制地图。
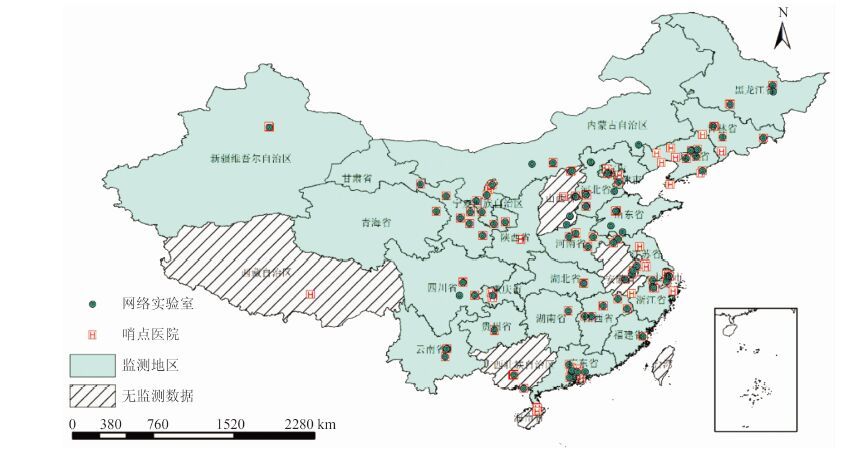
|
| 图 1 2011-2014年中国162家腹泻症候群监测哨点医院和92家网络实验室分布 Figure 1 Distribution of 162 sentinel hospitals and 92 network laboratories for diarrheal diseases in China,2011-2014 |
| |
| 病毒型别 | 引物 | 引物序列(5′~3′)(1) | 产物(bp) |
| 轮状病毒A[15-17] | |||
| G分型(2) | VP7F | ATG TAT GGT ATT GAA TAT ACC AC | 881 |
| VP7R | AAC TTG CCA CCA TTT TTT CC | ||
| G1 | aBT1F | CAA GTA CTC AAA TCA ATG ATG G | 618 |
| G2 | aCT2F | CAA TGA TAT TAA CAC ATT TTC TGT G | 521 |
| G3 | aET3F | ACG AAC TCA ACA CGA GAG G | 682 |
| G4 | aDT4F | CGT TTC TGG TGA GGA GTT G | 452 |
| G8 | aAT8F | GTC ACA CCA TTT GTA AAT TCG | 754 |
| G9 | aFT9F | CTT GAT GTG ACT AYA AAT AC | 179 |
| P分型(3) | VP4F | TAT GCT CCA GTN AAT TGG | 663 |
| VP4R | ATT GCA TTT CTT TCC ATA ATG | 663 | |
| P[4] | 2T-1R | CTA TTG TTA GAG GTT AGA GTC | 362 |
| P[6] | 3T-1R | TGT TGA TTA GTT GGA TTC AA | 146 |
| P[8] | 1T-1DR | TCT ACT GGR TTR ACN TGC | 224 |
| P[9] | 4T-1R | TGA GAC ATG CAA TTG GAC | 270 |
| P[10] | 5T-1R | ATC ATA GTT AGT AGT CGG | 462 |
| P[11] | P[11] R | GTA AAC ATC CAG AAT GTG | 191 |
| 轮状病毒B[18] | VP7-B5-2F | GGC AAT AAA ATG GCT TCA TTG C | 814 |
| VP7-B3-3R | GGG TTT TTA CAG CTT CGG CT | ||
| 轮状病毒C[19] | VP7-G8NS1F | ATT ATG CTC AGA CTA TCG CCA C | 352 |
| VP7-G8NA2R | GTT TCT GTA CTA GCT GGT GAA C | ||
| 注:“F”=正向引物。“R”=反向引物;(1) B=C、G或T;H=A、C或T;K=G、T;N=A、C、G或T;R=A或G;S=G或C;V=A、C或G;W=A或T;Y=C或T。(2)在第一轮半巢式的PCR中用来扩增编码VP7 G基因型全长的引物。(3) 在第一轮半巢式的PCR中用来扩增编码VP7 P基因型全长的引物。 | |||
162家哨点医院共纳入19 849例5岁以下儿童腹泻症候群病例用于检测轮状病毒,监测病例年龄均值为1.1岁,中位数0.8岁 (IQR:0.5~1.3岁),其中男性12 768例(64.3%),女性7081例(35.7%)。轮状病毒检测阳性共4553例,检出率为22.9% (95%CI: 22.4~23.5)。其中,男性轮状病毒阳性病例3025例,检出率为23.7%(95%CI: 23.0~24.4),显著高于女性患者的检出率21.6% (95%CI:20.6~22.5)(P<0.01);不同年龄组儿童轮状病毒检出率差异有统计学意义(P<0.01)。其中,1~2岁年龄组儿童轮状病毒检出率最高,为29.0%(95%CI:27.8~30.3),其次是6月龄至1岁年龄组,检出率为26.1%(95%CI:25.1~27.1),而4~5岁年龄组检出率最低,为11.0% (95%CI:8.3~13.7)。除此之外,不同粪便性质标本中轮状病毒检出率差异也有统计学意义(P<0.01),水样便检出率最高,为26.2%(95%CI:25.5~27.0),其次是稀便,为18.0%(95%CI:16.8~19.3),血便中检出率最低,为10.6% (95%CI:7.6~13.7),见表 2。
2.2 季节分布特征轮状病毒在本研究范围内的不同年份、季节和月份之间的检出率差异均有统计学意义(P<0.01)。2013年检出率最高,检测5577例,阳性1423例,阳性率为25.5%(95%CI:24.4~26.7);2014年检测5266例,阳性1069例,检出率最低,为20.3%(95%CI:19.2~21.4)。4个连续监测年度中,轮状病毒感染的季节性发病特征明显(P<0.01),冬季检出率最高,为39.4%(95%CI: 37.9~41.0),其次是秋季,为26.7%(95%CI: 25.6~27.8),夏季检出率最低,仅为9.9%(95%CI:9.1~10.7)。轮状病毒在12月和1月形成流行高峰,检出率分别为45.4%(95%CI:43~47.9)和39.2%(95%CI:36.6~41.8),在6、7月的检出率最低,分别为9.9%(95%CI:8.5~11.3)和9.5%(95%CI:8.1~10.8)。见表 2和图 2。
| 特征 | 检测例数(构成比,%) | 阳性例数(构成比,%) | 检出率(%)(95%CI) |
| 性别 | P=0.001 | ||
| 男 | 12 768(64.3) | 3025(66.4) | 23.7(23.0~24.4) |
| 女 | 7 081(35.7) | 1528(33.6) | 21.6(20.6~22.5) |
| 年龄 | P<0.001 | ||
| 0~4周 | 537(2.7) | 80(1.8) | 14.9(11.9~17.9) |
| 4周至6月龄 | 4 627(23.3) | 728(16.0) | 15.7(14.7~16.8) |
| 6月龄至1岁 | 7 087(35.7) | 1851(40.6) | 26.1(25.1~27.1) |
| 1~岁 | 5 002(25.2) | 1451(31.9) | 29.0(27.8~30.3) |
| 2~岁 | 1 329(6.7) | 261(5.7) | 19.6(17.5~21.8) |
| 3~岁 | 739(3.7) | 124(2.7) | 16.8(14.1~19.5) |
| 4~5岁 | 528(2.7) | 58(1.3) | 11.0(8.3~13.7) |
| 季节 | P<0.001 | ||
| 春 | 4 363(22.0) | 859(18.9) | 19.7(18.5~20.9) |
| 夏 | 5 567(28.0) | 553(12.1) | 9.9(9.1~10.7) |
| 秋 | 6 060(30.5) | 1619(35.6) | 26.7(25.6~27.8) |
| 冬 | 3 859(19.5) | 1522(33.4) | 39.4(37.9~41.0) |
| 气候带 | P<0.001 | ||
| 高原寒带 | 437(2.2) | 75(1.7) | 17.2(13.6~20.7) |
| 中温带 | 2 291(11.5) | 468(10.3) | 20.4(18.8~22.1) |
| 暖温带 | 3 156(15.9) | 789(17.3) | 25.0(23.5~26.5) |
| 亚热带 | 13 965(70.4) | 3221(70.7) | 23.1(22.4~23.8) |
| 地区 | P<0.001 | ||
| 东北 | 744(3.8) | 154(3.4) | 20.7(17.8~23.6) |
| 西北 | 2 221(11.2) | 501(11.0) | 22.6(20.8~24.3) |
| 北部 | 2 072(10.4) | 310(6.8) | 15.0(13.4~16.5) |
| 东部 | 3 162(15.9) | 567(12.5) | 17.9(16.6~19.3) |
| 中部 | 4 617(23.3) | 1247(27.4) | 27.0(25.7~28.3) |
| 西南 | 4 035(20.3) | 934(20.5) | 23.1(21.8~24.4) |
| 南部 | 2 998(15.1) | 840(18.4) | 28.0(26.4~29.6) |
| 粪便性状 | P<0.001 | ||
| 水样便 | 13 139(66.2) | 3446(75.7) | 26.2(25.5~27.0) |
| 稀便 | 3 633(18.3) | 654(14.4) | 18.0(16.8~19.3) |
| 黏液便 | 2 682(13.5) | 411(9.0) | 15.3(14.0~16.7) |
| 血便 | 395(2.0) | 42(0.9) | 10.6(7.6~13.7) |
| 合计 | 19 849(100.0) | 4553(100.0) | 22.9(22.4~23.5) |
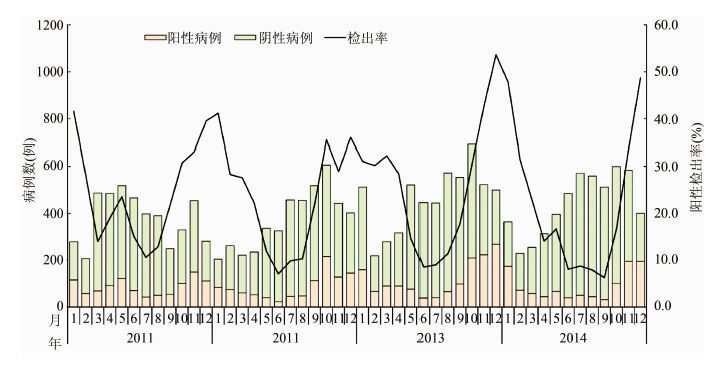
|
| 图 2 2011-2014年中国162家腹泻症候群哨点监测医院轮状病毒感染病例检出率月分布 Figure 2 Monthly detection rates of rotavirus in 162 sentinel hospitals in China,2011-2014 |
| |
轮状病毒在我国不同地区和气候带之间检出率差异均有统计学意义(P<0.01),南部和中部地区检出率最高,分别为28.0%(95%CI:26.4~29.6)和27.0%(95%CI:25.7~28.3),北部和东部地区检出率最低,分别只有15.0%(95%CI:13.4~16.5)和17.9%(95%CI:16.6~19.3)。此外,暖温带轮状病毒的检出率最高,为25.0% (95%CI:23.5~26.5);高原寒带检出率最低,只有17.2%(95%CI:13.6~20.7),见表 2和图 3。
2.4 基因分型5岁以下儿童轮状病毒腹泻患者中,A组轮状病毒是所有毒株中比重最高的血清型,平均构成比为95.1%(4404例),B、C组分别只有2.8%(129例)和2.1%(98例)。A组轮状病毒中有1225例开展了基因分型,其中 G9 P[8]、G1 P[8]和G3 P[8]构成比最高,平均构成比分别为39.5%(484例)、16.8%(206例)和9.9%(121例)。不同监测年份A组轮状病毒各基因型构成变化特征明显,G9 P[8]基因型从2011年的17.9%(42例)上升至2014年的65.4%(214例);而G1 P[8]、G3 P[8]和GP混合感染在2012年较高,分别占当年毒株的27.5%(47例)、14.0%(24例)和14.6%(25例),之后逐年下降至2014年的7.7%(25例)、7.3%(24例)和 2.0%(0.6例);G9 P[11]从2011年的15.0%(35例)降至2014年的 0.3%(1例),与此相反的是,GP的其他型别从2011年的0%(0例)攀升至2014年的4.6%(15例),见表 3。
3 讨论本研究首次在全国范围内通过开展前瞻性的、多中心的以实验室为基础的腹泻症候群主动监测对轮状病毒的流行特征进行了研究。20112014年连续4年监测,共纳入19 849例5岁以下的儿童腹泻病例,其中22.9%的患者(4553例)轮状病毒检测阳性。该结果与国内和国外在未引入轮状病毒疫苗之前腹泻患儿中轮状病毒的流行特征类似[5, 7, 20-25]。作为儿童腹泻的主要病原,轮状病毒给全球人群健康带来了巨大的疾病负担[26-27]。儿童在早期都会被其感染,大部分儿童在2岁之前会经历2次以上的轮状病毒感染[7],在东地中海区域,有75%的儿童在3岁之前至少会经历1次轮状病毒感染[23]。虽第1次感染只伴随着轻微腹泻,仍有15%~20%需要去门诊治疗,有1%~3%会导致脱水需要住院。虽然随着口服补液等治疗方法和卫生及水源的改善,腹泻导致的死亡在过去的20年中下降了很多,但轮状病毒感染导致的死亡却并没有下降太多。我国门/急诊腹泻患儿中轮状病毒较高的流行水平提示轮状病毒给人群健康带来的负担仍然较重。
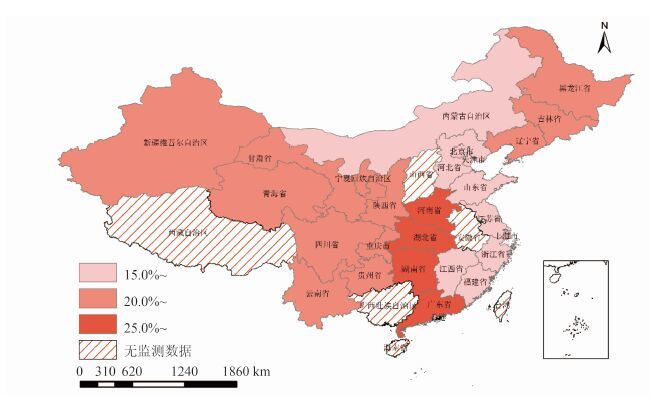
|
| 图 3 2011-2014年中国162家哨点监测医院腹泻症候群轮状病毒检出率地区分布 Figure 3 Area specific detection rates of rotavirus in 162 sentinel hospitals in China,2011-2014 |
| |
| 基因分型 | 2011年 | 2012年 | 2013年 | 2014年 | 总计 | |||||
| 例数 | 构成比 (%) | 例数 | 构成比 (%) | 例数 | 构成比 (%) | 例数 | 构成比 (%) | 例数 | 构成比 (%) | |
| 轮状病毒A组(GP分型) | 1019 | 97.8 | 1001 | 99.4 | 1386 | 95.1 | 998 | 88.7 | 4404 | 95.1 |
| G9 P[8] | 42 | 17.9 | 29 | 17.0 | 199 | 40.4 | 214 | 65.4 | 484 | 39.5 |
| G1 P[8] | 31 | 13.2 | 47 | 27.5 | 103 | 20.9 | 25 | 7.7 | 206 | 16.8 |
| G3 P[8] | 18 | 7.7 | 24 | 14.0 | 55 | 11.2 | 24 | 7.3 | 121 | 9.9 |
| G2 P[4] | 11 | 4.7 | 18 | 10.5 | 36 | 7.3 | 12 | 3.7 | 77 | 6.3 |
| GO(2)P[11] | 50 | 21.3 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 50 | 4.1 |
| G9 P[11] | 35 | 15.0 | 3 | 1.8 | 0 | 0.0 | 1 | 0.3 | 39 | 3.2 |
| GO(2)PO(3) | 0 | 0.0 | 0 | 0.0 | 18 | 3.6 | 15 | 4.6 | 33 | 2.7 |
| G1 P[4] | 2 | 0.9 | 18 | 10.5 | 4 | 0.8 | 4 | 1.2 | 28 | 2.3 |
| GO(2)P[8] | 3 | 1.3 | 0 | 0.0 | 21 | 4.3 | 0 | 0.0 | 24 | 2.0 |
| G8 P[8] | 0 | 0.0 | 1 | 0.6 | 1 | 0.2 | 13 | 4.0 | 15 | 1.2 |
| G2 P[8] | 2 | 0.9 | 2 | 1.2 | 2 | 0.4 | 5 | 1.5 | 11 | 0.9 |
| G3 P[11] | 8 | 3.4 | 0 | 0.0 | 3 | 0.6 | 0 | 0 | 11 | 0.9 |
| G9 P[4] | 3 | 1.3 | 0 | 0.0 | 5 | 1.0 | 2 | 0.6 | 10 | 0.8 |
| 其他 | 25 | 10.7 | 4 | 2.3 | 29 | 5.9 | 10 | 3.1 | 68 | 5.5 |
| GP-mixed(4) | 4 | 1.7 | 25 | 14.6 | 17 | 3.4 | 2 | 0.6 | 48 | 3.9 |
| 合计 | 234 | 100.0 | 171 | 100.0 | 493 | 100.0 | 327 | 100.0 | 1225 | 100.0 |
| 注:(1)不同型别之间存在混合感染情况,因此,不同组轮状病毒感染总和不等于4553;(2)除G1、 G2、 G3、 G4、 G8和G9以外的其他G 基因型;(3)除P[4]、 P[6]、 P[8]、 P[9]、 P[10]和 P[11]以外的其他P 基因型;(4)混合感染情况。 | ||||||||||
本研究1~2岁儿童轮状病毒检出率最高,为29.0%,其次是6月龄至1岁年龄组,检出率为26.1%,提示这2个年龄组人群可能是轮状病毒感染的高危人群。母亲胎传抗体对预防新生儿轮状病毒腹泻有一定保护作用,但随着胎传抗体的消退和年龄的增加,6月龄至2岁儿童轮状病毒腹泻的比例快速增加,之后,随着轮状病毒感染后机体获得性免疫的建立,2~5岁儿童轮状病毒腹泻的比例会逐渐降低。本研究发现轮状病毒感染的高峰是每年的秋冬季,检出率分别为26.7%和39.4%,12月检出率可高达45.4%;轮状病毒在夏季的检出率最低,只有9.9%,在7月的检出率更是低至9.5%;这种季节性分布特征在其他研究中也有所涉及[7, 28-31]。轮状病毒在水样便和稀便中的检出率最高,分别为26.2%和18.0%,提示秋冬季5岁以下儿童水样腹泻轮状病毒感染的可能性较高。本研究发现轮状病毒在我国南部和中部地区的检出率最高,分别为28.0%和27.0%,在北部和东部地区的检出率最低,分别只有15.0% 和17.9%。此外,在暖温带轮状病毒的检出率最高,为25.0%;在高原寒带的检出率最低,只有17.2%。这些差异提示轮状病毒在人群中的流行可能与环境、经济情况有关,比如环境、温度、降水、空气湿度等因素,能影响患者暴露的频率、病毒和人体的免疫状态。关于年龄、时间、空间的研究结果将对我国制定及时的和针对目标人群的干预措施提供有用的帮助[32]。
疫苗研究和推介的关键是掌握轮状病毒主要型别及G和P亚型在人群中流行的特征数据[33]。研究发现,A组轮状病毒在我国5岁以下儿童中最为流行,占95.1%。在A组轮状病毒中,又以G9 P[8]、G1 P[8]和G3 P[8]最为流行,分别为39.5%、16.8%和9.9%。根据Santos和Hoshino[33]的研究,4种常见的G亚型 (G1、 G2、 G3和G4) 和 P[8] 或P[4] 的组合代表了世界上超过88%的流行株,且不同A组轮状病毒常呈现出区域高发流行的特征,例如泰国报道的主要流行株为G1 P[8] (53%),G2 P[4](18%) 和 G3 P[8](12%)[5];中国台湾为G1 P[8] (40%),G3 P[8] (27%)和 G9 P[8] (17%)[34];北美、欧洲和澳大利亚为G1 P[8],占70%以上,但是G1 P[8]在南美和亚洲只有30%,非洲只有23%;在非洲,G8的相对频率和在全球普遍流行的G3 或G4一样高,P[6]则几乎代表了P亚型的近1/3的流行株,有27%的感染是和一些不常见的组合(如G8 P[6] 或 G8 P[4])有关[33]。本研究发现G9 P[8]基因型所占构成比从2011年的17.9%上升至了2014年的65.4%,成为A组轮状病毒最主要的流行株。而我国2012年以来5岁以下轮状病毒腹泻主要的流行株G1 P[8](27.5%)比重在逐年降低,2014年降低至7.7%;G3 P[8]和G9 P[11]等也从2011年的15.0%和14.0%降至2014年的 0.3%和7.3%。本研究观察到的这一结果与国内其他研究结果基本一致,如Zhang等[21]发现G9 P[8]近几年在北京(60.6%)和甘肃(77.6%)很流行;王鹏等[20]发现南京地区G9基因型要比G3基因型更为流行。本研究发现G和P的其他型别从2011年的0%攀升至2014年的4.6%,提示其他亚型已在我国出现和流行。轮状病毒在时空分布上的差异性,进一步强调了在不同地区持续开展轮状病毒的监测和研发、推介疫苗(比如下一代多价轮状病毒疫苗根据地区进行G和P型别的调整)的重要性。
接种轮状病毒疫苗是控制和降低轮状病毒腹泻危害的有效手段。美国的一项研究表明,轮状病毒疫苗的使用能显著的降低腹泻病疾病负担,与腹泻有关的死亡在美国5岁以下儿童中从1968年的1100例降到了1985年的300例[25]。WHO建议所有国家应将轮状病毒疫苗纳入儿童常规免疫规划,特别是在腹泻病发病率高的国家[35]。中国是腹泻病高发的国家,为了降低腹泻病的危害,轮状病毒应是国家公共卫生部门防控腹泻病的首要任务和优先领域[7]。并不是所有的腹泻疾病都可以通过卫生水平的改善来预防和阻止[7, 36],因此把轮状病毒疫苗纳入国家免疫计划是强力推荐的。新的针对婴幼儿和儿童轮状病毒G1和非G1(G3、 G4 和 G9)型疫苗已经出现,但是还未被引入到中国。中国目前使用的兰州羊轮状病毒G10 P[12]型疫苗,由于交叉免疫其对轮状病毒所致的腹泻约有78%的保护效率[37],但是该疫苗仍然不是国家免疫计划的一部分。此外,只有部分(2.5%)有腹泻病史的儿童被记载至少使用1剂量的轮状病毒疫苗[21]。
本研究存在一定局限性。首先,各地实验室检测任务和条件的差异,并非所有纳入研究儿童腹泻病例都进行了轮状病毒的检测;仅部分A组轮状病毒进行了G、P分型,在所有的亚型中也仅检测了G1、G2、G3、G4、G8、G9和P[4]、P[6]、P[8]、P[9]、P[10]、P[11] 等亚型。尽管如此,目前流行的主要G和P亚型都已被纳入研究中,该研究仍是目前我国在5岁以下腹泻症候群的儿童中开展的范围较大、时间较长的轮状病毒流行病学研究。其次,由于地区差异,样本收集可能会带来偏倚,如东部地区的哨点医院较多,寒带地区收集的病例数较少,热带地区未纳入病例,对这些地区儿童腹泻的代表性不足。再者,同一时间我国不同地区所处的季节可能存在较大差异,如气候、温度、降水和湿度等都可能影响轮状病毒流行,对其季节性感染的精确判断。此外,4年的监测和检测不能代表轮状病毒在我国的长期流行趋势,尚需进行持续的监测和检测。
| [1] | Dennehy PH. Rotavirus infection:a disease of the past?[J]. Infect Dis Clin North Am, 2015, 29 (4) : 617–635 . |
| [2] | Ahmadi E, Alizadeh-Navaei R, Rezai MS. Efficacy of probiotic use in acute rotavirus diarrhea in children:a systematic review and meta-analysis[J]. Caspian J Intern Med, 2015, 6 (4) : 187–195 . |
| [3] | Anderson EJ, Weber SG. Rotavirus infection in adults[J]. Lancet Infect Dis, 2004, 4 (2) : 91–99 . |
| [4] | Wang YH, Kobayashi ND, Zhou DJ, et al. Molecular epidemiologic analysis of group A rotaviruses in adults and children with diarrhea in Wuhan city, China,2000-2006[J]. Arch Virol, 2007, 152 (4) : 669–685 . |
| [5] | Chieochansin T, Vutithanachot V, Phumpholsup T, et al. The prevalence and genotype diversity of Human Rotavirus A circulating in Thailand,2011-2014[J]. Infect Genet Evol, 2016 : 129–136 . |
| [6] | Kawai K, O'Brien MA, Goveia MG, et al. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia:a systematic review[J]. Vaccine, 2012, 30 (7) : 1244–1254 . |
| [7] | Yu JX, Jing HQ, Lai SJ, et al. Etiology of diarrhea among children under the age five in China:results from a five-year surveillance[J]. J Infect, 2015, 71 (1) : 19–27 . |
| [8] | Zheng JY, Yin YH, Li BY. A new scheme for climate regionalization in China[J]. Acta Geographica Sinica, 2010, 65 (1) : 3–12 .(in Chinese) 郑景云, 尹云鹤, 李炳元. 中国气候区划新方案[J]. 地理学报,2010,65 (1) :3–12. |
| [9] | Yu JX, Lai SJ, Wang X, et al. Analysis of epidemiology characteristics of norovirus among diarrheal outpatients in 27 provinces in China,2009-2013[J]. Chinese Journal of Epidemiology, 2015, 36 (3) : 199–204 .(in Chinese) 余建兴, 赖圣杰, 王鑫, 等. 中国27省(市、自治区) 2009-2013年门诊腹泻病例诺如病毒流行特征分析[J]. 中华流行病学杂志,2015,36 (3) :199–204. |
| [10] | Zhou XY, Zhu FM, Li JP, et al. High-resolution analyses of human leukocyte antigens allele and haplotype frequencies based on 169995 volunteers from the China bone marrow donor registry program[J]. PLoS One, 2015, 10 (9) : e0139485. |
| [11] | World Health Organization. The treatment of diarrhoea:a manual for physicians and other senior health workers[R]. Geneva:World Health Organization ,2005. |
| [12] | World Health Organization. WHO recommended surveillance standards[R].Geneva:World Health Organization ,1999. |
| [13] | 国家科技重大专项传染病监测技术平台项目专项实施管理办公室.腹泻症候群监测方案(2012版) [S].北京:中国疾病预防控制中心,2011. Management Office of National Science and Technology Major Project of China. Diarrheal syndrome surveillance protocol (2012 version) [S]. Beijing:Chinese Center for Disease Control and Prevention ,2011. (in Chinese) |
| [14] | Chen Y, Li ZJ, Han DS, et al. Viral agents associated with acute diarrhea among outpatient children in Southeastern China[J]. Pediatr Infect Dis J, 2013, 32 (7) : e285-290. |
| [15] | Iturriza Gómara M, Kang G, Mammen A, et al. Characterization of G10 P[11] rotaviruses causing acute gastroenteritis in neonates and infants in Vellore, India[J]. J Clin Microbiol ,2004,42(6):2541-2547. |
| [16] | Gouvea V, Glass RI, Woods P, et al. Polymerase chain reaction amplification and typing of rotavirus nucleic acid from stool specimens[J]. J Clin Microbiol, 1990, 28 (2) : 276–282 . |
| [17] | Simmonds MK, Armah G, Asmah R, et al. New oligonucleotide primers for P-typing of rotavirus strains:strategies for typing previously untypeable strains[J]. J Clin Virol, 2008, 42 (4) : 368–373 . |
| [18] | Phan TG, Nguyen TA, Yan H, et al. Development of a novel protocol for RT-multiplex PCR to detect diarrheal viruses among infants and children with acute gastroenteritis in Eastern Russia[J]. Clin Lab, 2005, 51 (7/8) : 429–435 . |
| [19] | Yan H, Nguyen TA, Phan TG, et al. Development of RT-multiplex PCR assay for detection of adenovirus and group A and C rotaviruses in diarrheal fecal specimens from children in China[J]. Kansenshogaku Zasshi, 2004, 78 (8) : 699–709 . |
| [20] | Wang P, Yuan XH, Lin Q, et al. The monitoring on molecular epidemiology of rotavirus diarrhea of children in Nanjing city during 2011-2013[J]. Chinese Journal of Experimental and Clinical Virology, 2015, 29 (3) : 207–209 .(in Chinese) 王鹏, 原新慧, 林谦, 等. 南京2011-2013年婴幼儿腹泻轮状病毒分子流行病学研究[J]. 中华实验和临床病毒学杂志,2015,29 (3) :207–209. |
| [21] | Zhang J, Liu HX, Lei J, et al. Active, Population-based surveillance for rotavirus gastroenteritis in Chinese children:Beijing municipality and Gansu province, China[J]. Pediatr Infect Dis J, 2015, 34 (1) : 40–46 . |
| [22] | Liu XN, Meng L, Li JS, et al. Etiological epidemiology of viral diarrhea on the basis of sentinel surveillance in children younger than 5 years in Gansu, Northwest China,2009-2013[J]. J Med Virol, 2015, 87 (12) : 2048–2053 . |
| [23] | Malek MA, Teleb N, Abu-Elyazeed R, et al. The Epidemiology of Rotavirus Diarrhea in Countries in the Eastern Mediterranean Region[J]. J Infect Dis, 2010, 202 (Suppl 1) : S12-22. |
| [24] | Wilopo SA, Soenarto Y, Bresee JS, et al. Rotavirus surveillance to determine disease burden and epidemiology in Java, Indonesia, August 2001 through April 2004[J]. Vaccine, 2009, 27 (Suppl 5) : F61-66. |
| [25] | Glass RI, Kilgore PE, Holman RC, et al. The epidemiology of rotavirus diarrhea in the United States:surveillance and estimates of disease burden[J]. J Infect Dis, 1996, 174 (Suppl 1) : S5-11. |
| [26] | Soriano-Gabarró M, Mrukowicz J, Vesikari T, et al. Burden of rotavirus disease in European Union Countries[J]. Pediatr Infect Dis J, 2006, 25 (1) : S7-11. |
| [27] | Parashar UD, Hummelman EG, Bresee JS, et al. Global illness and deaths caused by rotavirus disease in children[J]. Emerg Infect Dis, 2003, 9 (5) : 565–572 . |
| [28] | Li DD, Liu N, Yu JM, et al. Molecular epidemiology of G9 rotavirus strains in children with diarrhoea hospitalized in Mainland China from January 2006 to December 2007[J]. Vaccine, 2009, 27 (Suppl) : F40-45. |
| [29] | Xu J, Yang Y, Sun JE, et al. Molecular epidemiology of rotavirus infections among children hospitalized for acute gastroenteritis in Shanghai, China,2001 through 2005[J]. J Clin Virol, 2009, 44 (1) : 58–61 . |
| [30] | Duan ZJ, Liu N, Yang SH, et al. Hospital-based surveillance of rotavirus diarrhea in the people's republic of China, August 2003-July 2007[J]. J Infect Dis, 2009, 200 (Suppl 1) : S167-173. |
| [31] | Chen Y, Li ZJ, Han DS, et al. Viral agents associated with acute diarrhea among outpatient children in southeastern China[J]. Pediatr Infect Dis J, 2013, 32 (7) : e285-290. |
| [32] | Liu N, Yen C, Fang ZY, et al. Projected health impact and cost-effectiveness of rotavirus vaccination among children <years of age in China[J]. Vaccine, 2012, 30 (48) : 6940–6945 . |
| [33] | Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine[J]. Rev Med Virol, 2005, 15 (1) : 29–56 . |
| [34] | Wu FT, Liang SY, Tsao KC, et al. Hospital-based surveillance and molecular epidemiology of rotavirus infection in Taiwan,2005-2007[J]. Vaccine, 2009, 27 (Suppl 5) : F50-54. |
| [35] | Tate JE, Burton AH, Boschi-Pinto C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes:a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012, 12 (2) : 136–141 . |
| [36] | Nelson EAS, Bresee JS, Parashar UD, et al. Rotavirus epidemiology:the Asian rotavirus surveillance network[J]. Vaccine, 2008, 26 (26) : 3192–3196 . |
| [37] | Duan ZJ. Progress of human group A rotavirus vaccine[J]. Chinese Journal of New Drugs, 2012, 21 (10) : 1088–1092 .(in Chinese) 段招军. 人A组轮状病毒疫苗研究进展[J]. 中国新药杂志,2012,21 (10) :1088–1092. |
 2016, Vol. 31
2016, Vol. 31


