扩展功能
文章信息
- 袁梦, 袁月明, 罗锦雁, 陈宏彬, 胡鹏威, 段永翔
- YUAN Meng, YUAN Yue-ming, LUO Jin-yan, CHEN Hong-bin, HU Peng-wei, DUAN Yong-xiang
- 金黄色葡萄球菌毒力基因检测及Spa分型研究
- Virulence gene detection and Spa typing of Staphylococcus aureus
- 疾病监测, 2016, 31(7): 603-608
- Disease Surveillance, 2016, 31(7): 603-608
- 10.3784/j.issn.1003-9961.2016.07.015
-
文章历史
- 收稿日期:2016-02-29
金黄色葡萄球菌(Staphylococcus aureus,SA),为医院感染和社区感染的重要病原菌,也是引起食品污染导致食物中毒最常见的细菌之一。其致病性与它产生的多种外毒素有关,肠毒素是引起食物中毒的主要因子,中毒性休克综合征毒素可引起多个器官系统的功能紊乱或中毒性休克综合征[1],表皮剥脱毒素与人葡萄球菌性烫伤样皮肤综合征密切相关[1],白细胞毒素在坏死性皮肤损害和坏死性肺炎等疾病中起了重要作用[2],溶血毒素易引起化脓性炎症。本研究对24种毒力基因进行检测,分别是肠毒素基因(SEA、SEB、mpSEC、SED、SEE、SEG、SHE、SEI、mpSEJ、mpSEN、mpSEO和mpSEM),中毒性休克综合征毒素基因(TST),表皮剥脱素基因(mpETA、mpETB),白细胞毒素基因(PVL、LUKDE、LUKM),溶血素基因(HLA、HLB、HLD、mpHLG1、mpHLG2)及表皮细胞分化抑制因子(EDIN),以研究各种毒力基因分布情况以及不同样本间携带毒力基因的差异。
耐甲氧西林金黄色葡萄球菌(methicillin-resistant S. aureus,MRSA)已成为临床上治疗感染的较为棘手的难题之一。对不同样本进行MRSA检测,了解MRSA的分布情况以及与携带毒力基因的相关关系对临床治疗有重要作用。
表面蛋白A是SA编码的毒力因子之一,编码蛋白A的基因包括X区,X区由于重复序列数目、特征和排列顺序不同而具有高度多态性[3],通过对蛋白A基因保守区域扩增测序,序列上传数据库进行比对,此分型方法为 蛋白A基因多态性分型(single locus DNA-sequencing of the repeat region of the Staphylococcus protein A gene,Spa)分型。该分型方法具有高分辨率,分型准确,快速,重复性好和易于操作等特点,结果利于国际及国内数据比较[4]。本研究采用Spa分型方法分析医院内患者临床检测标本、医院台面与医护人员双手涂抹样以及食物中毒样本中SA蛋白A基因多态性分型,以掌握Spa优势型别为疾病溯源提供科学依据。
1 材料与方法 1.1 菌株来源60株SA分离自院内患者临床检验样本,其中穿刺液3株;粪便1株;活检组织块1株;尿液2株;脓液5株;伤口分泌物11株;痰28株;胸水1株;血液3株;咽拭子5株。8株SA分离自医院其他样本(医院台面涂抹样与医护人员双手涂抹样),19株分离自食物中毒样本,共计87株。菌株分离年代:2009年分离11株(3株食物中毒样,8株医院其他样本);2011年分离21株(8株食物中毒样,13株院内患者样本);2013年分离3株均为食物中毒样;2015年分离52株(51株院内患者样本,1株医院其他样本)。
1.2 主要试剂聚合酶链反应(PCR)相关试剂购自大连宝生物工程有限公司,PCR产物测序由上海生工生物有限公司完成,DNA提取试剂盒由美国Qiagen公司生产。
1.3 主要仪器基因扩增仪(英国Barloworl公司);电泳仪(Major Science);凝胶成像系统(Bio-Rad公司)。
1.4 方法 1.4.1 菌株的分离鉴定所有菌株均经全自动细菌生化鉴定仪鉴定。
1.4.2 引物设计与合成24种毒力基因及蛋白A基因引物序列见相关文献[5-7],由上海生物工程有限公司合成。模板DNA制备按照Qiagen公司试剂说明书(51304)进行。多重PCR检测mecA、femA基因方法见参考文献[8-9]。PCR检测24种毒力基因方法见参考文献[10]。PCR检测蛋白A基因方法见参考文献[7, 11]。PCR扩增产物电泳,凝胶成像仪观察结果并拍照。蛋白A基因PCR产物测序,测序结果上传Spa数据库。
2 结果 2.1 MRSA检测同时检出mecA与femA基因判定为MRSA,仅检出femA基因为甲氧西林敏感金黄色葡萄球菌(methicillin-sensitiveS.aureus,MSSA)。87株SA经多重PCR扩增,48株菌(55.2%,48/87)判定为MRSA。45株分离自患者样本,其中样本来源以痰为主25株,占52.1%,其余依次为伤口分泌物8株(16.7%);脓液4株(8.3%);咽拭子4株(8.3%);穿刺液、粪便、活检组织块、尿液和血液各1株,占2.1%。食物中毒食品样本和医院台面涂抹样中分别有2株和1株判定为MRSA,占4.2%和2.1%。
2.2 毒力基因检测 2.2.1 检出情况共检出21种毒力基因,SEE、LUKM 和EDIN 3种毒力基因未检出。21种毒力基因检出率见图 1。分离率>60.0%以上的毒力基因有LUKDE、SHE、mpHLG2、HLD和HLA。
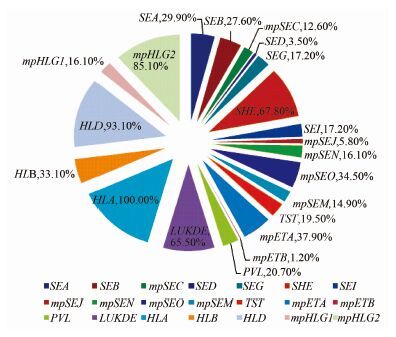
|
| 图 1 21种毒力基因检出率 Figure 1 Positive rates of 21 kinds of virulence genes |
| |
共有11种毒力基因的携带率在三类样本间存在差异,见表 1。
2.3 Spa分型结果 2.3.1 SA不同Spa型别菌株分布 87株SA经过扩增蛋白A基因,PCR产物测序,测序结果上传数据库比对,结果分为24种Spa型。每种Spa型检出菌株数见图 2,t437型和t030型最多,分别为22株和18株。t030与t437型别来源于患者株,t127来源于食物中毒株,t091型4株来源于医院其他样本株,4株来源于食物中毒株,1株来源于患者株。
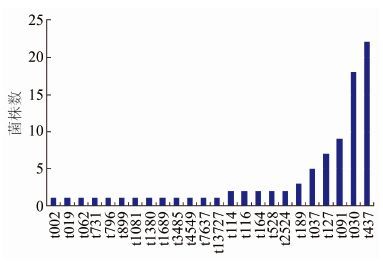
|
| 图 2 不同Spa型别菌株数分布情况 Figure 2 Distribution of S. aureus strains with different Spa types |
| |
87株SA分为24种Spa型,不同Spa型别的重复序列号、菌株类型、样本来源以及相应型别检出的菌株数,见表 2。
| 毒力基因 | 医院其他样本(n=8,%) | 患者临床标本分离株(n=60,%) | 食物中毒株(n=19,%) | P值 | MRSA(n=48,%) | MSSA(n=39,%) | P值 |
| 肠毒素基因 | |||||||
| SEA | 37.5 | 25.0 | 42.1 | 0.323 | 22.9 | 38.5 | 0.115 |
| SEB | 25.0 | 35.0 | 5.3 | 0.040 | 27.1 | 28.2 | 0.907 |
| mpSEC | 12.5 | 5.0 | 36.8 | 0.002 | 8.3 | 17.9 | 0.309 |
| SED | 0.0 | 1.7 | 10.5 | 0.226 | 2.1 | 5.1 | 0.855 |
| SEG | 37.5 | 15.0 | 15.8 | 0.284 | 10.4 | 25.6 | 0.062 |
| SEH | 87.5 | 63.3 | 73.7 | 0.321 | 68.8 | 64.1 | 0.647 |
| SEI | 37.5 | 15.0 | 15.8 | 0.284 | 10.4 | 23.1 | 0.110 |
| mpSEJ | 0.0 | 1.7 | 21.1 | 0.013 | 4.2 | 7.7 | 0.811 |
| mpSEN | 37.5 | 13.3 | 15.8 | 0.194 | 10.4 | 17.9 | 0.311 |
| mpSEO | 62.5 | 25.0 | 52.6 | 0.019 | 27.1 | 43.6 | 0.107 |
| mpSEM | 37.5 | 11.7 | 15.8 | 0.143 | 10.4 | 20.5 | 0.189 |
| 中毒性休克综合征毒素基因 | |||||||
| TST | 0.0 | 15.0 | 42.1 | 0.020 | 16.7 | 23.1 | 0.453 |
| 表皮剥脱素基因 | |||||||
| mpETA | 0.0 | 41.7 | 42.1 | 0.055 | 47.9 | 25.6 | 0.033 |
| mpETB | 0.0 | 1.7 | 0.0 | - | 0.0 | 2.6 | 0.448 |
| 白细胞毒素基因 | |||||||
| PVL | 0.0 | 30.0 | 0.0 | - | 29.2 | 10.3 | 0.030 |
| LUKDE | 62.5 | 68.3 | 57.9 | 0.694 | 66.7 | 64.1 | 0.802 |
| 溶血素基因 | |||||||
| HLA | 100.0 | 100.0 | 100.0 | - | 100.0 | 97.5 | - |
| HLB | 25.0 | 53.3 | 0.0 | 0.000 | 47.9 | 28.2 | 0.061 |
| HLD | 62.5 | 95.0 | 100.0 | 0.018 | 95.8 | 89.7 | 0.491 |
| mpHLG1 | 37.5 | 18.3 | 0.0 | 0.018 | 20.8 | 10.3 | 0.182 |
| mpHLG2 | 62.5 | 83.3 | 100.0 | 0.030 | 77.1 | 94.9 | 0.021 |
| Spa型别 | 重复序列号 | 菌株类型 | 样本来源 | 菌株数 |
| t002 | 26-23-17-34-17-20-17-12-17-16 | MSSA | 食物中毒样 | 1 |
| t019 | 08-16-02-16-02-25-17-24 | MRSA | 伤口分泌物 | 1 |
| t062 | 26-23-17-12-17-16 | MSSA | 伤口分泌物 | 1 |
| t731 | 07-06-17-21-34-22-34 | MSSA | 医院双手涂抹样 | 1 |
| t796 | 07-23-21-17-12-23-02-12-23 | MSSA | 食物中毒样 | 1 |
| t899 | 07-16-23-02-34 | MSSA | 伤口分泌物 | 1 |
| t1081 | 08-16-02-43-34-17-34 | MRSA | 痰 | 1 |
| t1380 | 04-17-20-17-25-34 | MRSA | 穿刺液 | 1 |
| t1689 | 07-23-21-17-34-66-23-02-12-23 | MSSA | 医院台面涂抹样 | 1 |
| t3485 | 04-20-17-20-17-20-17-25-34 | MSSA | 胸水 | 1 |
| t4549 | 04-34-21-17-21-17-34-22-25 | MRSA | 伤口分泌物 | 1 |
| t7637 | 04-34-21-17-21-17-34-22-25 | MRSA | 伤口分泌物 | 1 |
| t13727 | 26-17-34-17-17-17-17-16 | MRSA | 脓液 | 1 |
| t114 | 07-16-34-33-13 | MRSA | 食物中毒样 | 2 |
| t116 | 08-16-02-16-13-13-17-34-16-34 | MRSA | 痰 | 2 |
| t164 | 07-06-17-21-34-34-22-34 | MSSA | 食物中毒样 | 2 |
| t528 | 4 | MSSA | 咽拭子,渗出液 | 2 |
| t2524 | 14 | MSSA | 病灶、医院台面涂抹样 | 2 |
| t189 | 07-23-12-21-17-34 | MSSA | 食物中毒样,医院台面涂抹样 | 3 |
| t037 | 15-12-16-02-25-17-24 | MRSA | 痰 | 5 |
| t127 | 07-23-21-16-34-33-13 | MSSA | 7份食物中毒样 | 7 |
| t091 | 07-23-21-17-34-12-23-02-12-23 | MRSA | 医院双手涂抹样 | 1 |
| t091 | 07-23-21-17-34-12-23-02-12-23 | MSSA | 4份食物中毒样,3份医院双手涂抹样,1份痰 | 8 |
| t030 | 15-12-16-02-24-24 | MSSA | 尿液、痰 | 2 |
| t030 | 15-12-16-02-24-24 | MRSA | 1份尿液,3份咽拭子,12份痰 | 16 |
| t437 | 04-20-17-20-17-25-34 | MSSA | 1份痰,1份伤口分泌物,2份血液,2份穿刺液 | 6 |
| t437 | 04-20-17-20-17-25-34 | MRSA | 1份咽拭子,1份血液,1份粪便,1份活检组织块,2份脓液,5份痰,5份伤口分泌物 | 16 |
MRSA目前已成为医院感染的主要病原菌之一,MRSA与MSSA相比,具有更强的能力引起医院感染及菌血症[12]。mecA基因的存在是MRSA耐β内酰胺类抗菌药物的主要原因之一[13],因此mecA基因可作为MRSA的分子标记 [14],一旦SA检出mecA基因即可定为MRSA[15]。本研究采用多重PCR方法对三大类样本的87株SA进行MRSA与MSSA检测。结果表明,48株为MRSA,分离率55.2%与文献报道MRSA分离率为40%~60%一致[16]。来源于患者株样本类型较为复杂,每种类型样本数量不同,每种类型样本均有MRSA株检出。3株MRSA分离自食物中毒与医院其他样本,2株为一起食物中毒食品中分离得到,该起食物中毒,肛拭子中未分离到MRSA菌株,经过Spa分型显示,食品与肛拭子型别不一致,肛拭子分离的SA携带毒力基因数量较多,可能与分离菌株中存在多种Spa型别有关,提示在食物中毒检测中,不能以单纯检出目标菌就说明该起食物中毒是由该菌引起,挑取菌落应挑取多个,而不是单一菌落进行鉴定,才有利于进一步做相应的溯源研究。虽仅有1株双手涂抹样为MRSA,但Spa型别为t091型,是医院其他样本中的优势型别,故还需加强医院环境监测。
SA的致病性与其高毒力有关,本研究检测SA的24个毒力基因,仅有3个毒力基因未检出。结果表明,有5株MRSA携带毒力基因少于5个,其余菌株均携带5个以上的毒力基因,25.0%(10/40)的MSSA与14.9%(7/47)的MRSA携带10个或以上的毒力基因, 两者差异无统计学意义(P=0.236)。本研究结果与有关报道不同,湖北省黄州区医院,MSSA菌株携带15个或以上毒力基因明显高于MRSA菌株[17],相反,浙江省医院,MSSA菌株携带 10个或以上毒力基因明显低于MRSA菌株[18],具体原因尚不清楚,可能与地域差异有关。
有研究报道[19],SA菌株获得耐药的同时伴随毒力因子的改变,是否会使毒力因子表达降低,有待本课题进一步研究。
本研究中三类样本中有4种肠毒素基因存在差异,患者株SEB基因携带率最高,其余3种肠毒素mpSEC,mpSEJ与mpSEO均为食物中毒株携带率较高,亦说明SA导致食物中毒的致病因子主要表现为肠毒素。MRSA与MSSA携带肠毒素基因分布情况,该毒素基因携带率MRSA普遍低于MSSA与报道相符[20]。溶血素基因HLA与HLD携带率分别为100%与93.1%,为本研究中21种毒力基因携带率较高基因与多处文献报道一致[21-22],这两种溶血素基因普遍分布于SA中。
PVL在SA所致的皮肤及软组织损害和坏死性肺炎等疾病中起重要作用,SA通过噬菌体溶源转换机制获得产PVL能力,因此对MRSA菌株监测筛查PVL基因值得临床高度重视[23]。MRSA菌株PVL基因的检出率明显高于MSSA和文献报道类似[24]。PVL毒素基因仅存在患者株中,14株为MRSA,4株为MSSA,MRSA检出率高于MSSA。携带PVL毒素在患者临床检测样本中均有不同程度的分布,可见样本分布范围较广且复杂。携带PVL毒素基因的型别主要为t437与t030型,为本研究患者株的优势型别。因此,本研究中携带PVL毒素基因的菌株,无论是从样本来源、型别特征还是MRSA菌株,因其易感性和易传播增加,更应加强感染防控措施。
本研究利用Spa分型方法对SA进行分型,87株菌共分为24种Spa型,t030(2011年5株,2015年13株)与t437型(2011年1株,2015年21株)为患者样本的优势型别,t030与文献报道的该型别为我国的主要的流行克隆型结果一致[3, 25]。Geng等[26]的研究显示,t437是社区获得性感染的最主要的克隆株,李克诚等[27]研究也表明t437克隆株的患者均为住院患者,两者研究结果与本研究结果一致。推断这些患者有可能为社区感染,但也不排除院内感染。两种型别分别检出18(30.0%)株与22(36.7%)株。其中t030型,16株为MRSA,13株携带5个以上毒力基因,3株携带10个毒力基因,样本来源以痰为主。t437型,16株为MRSA,16株均携带5个以上毒力基因,样本来源以痰及伤口分泌物为主。两种型别为优势型别,大部分为MRSA且携带较多毒力基因,提示医院要加强检测,控制传染源,防止院内感染。为何为MRSA的t030与t437型携带较多的毒力基因,有待进一步的研究。医院其他样本、食物中毒株与患者株Spa型有较大区别,前两者与患者株之间没有共同的优势型别。食物中毒株t127与t091型为优势型别,分别检出7株(2011年4株,2013年3株)与4株(2009年3株,2011年1株)。医院其他样本t091型为优势型别,检出4株(2009年4株)。两类样本中均检出t091型,其中仅有1株t091型为MRSA,其余为MSSA,两种型别均携带5个以上毒力基因,其中2株t091携带10个毒力基因。食物中毒株没有检出MRSA但携带毒力基因较多,说明引起食物中毒与菌株携带毒力基因有相关关系。7株t127型SA均来源于食物中毒样本,食品与肛拭子分离出SA型别与携带毒力基因一致,均检出肠毒素基因,能够进行溯源。Spa分型对于调查疾病源头,尽快查找原因有着积极意义,并且Spa分型有着快速简单高效、易于推广的特点,可以广泛应用于SA的溯源研究。
监测医院内MRSA菌株及来自于外环境与医院样本分离的SA所携带毒力基因,可为临床治疗和感染控制措施提供依据。快速、高效的Spa分型技术不仅能分析各分离株的亲缘性还可为院内感染、食物中毒提供溯源。
| [1] | Zhou ZR, Li F. Medical microbiology[M]. Beijing: People's Medical Publishing House, 2005 : 139 . (in Chinese) 周正任, 李凡. 医学微生物学[M]. 北京: 人民卫生出版社, 2005 : 139 . |
| [2] | Lina G, Piémont Y, Godail-Gamot F, et al. Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia[J]. Clin Infect Dis, 1999, 29 (5) : 1128–1132 . |
| [3] | Zou ZY, Han L, Xiong J, et al. Spa typing and resistance profile of Staphylococcus aureus isolated from clinical specimens[J]. Chinese Journal of Infection and Chemotherapy, 2014, 14 (2) : 142–145 .(in Chinese) 邹自英, 韩黎, 熊杰, 等. 金黄色葡萄球菌临床分离株Spa分型和耐药特征研究[J]. 中国感染与化疗杂志,2014,14 (2) :142–145. |
| [4] | Strommenger B, Braulke C, Heuck D, et al. Spa typing of Staphylococcus aureus as a frontline tool in epidemiological typing[J]. J Clin Microbiol, 2008, 46 (2) : 574–581 . |
| [5] | Wang LX, Hu YM, Hu ZD, et al. Analysis of the antimicrobial-resistant gene and virulence gene carried by staphylococcus aureus collected from bloodstream infections in Tianjin:2006-2011[J]. Tianjin Medical Journal, 2013, 41 (4) : 334–336 .(in Chinese) 王立新, 胡祎明, 胡志东, 等. 2006-2011年60株血感染金黄色葡萄球菌毒素及耐药基因分析[J]. 天津医药,2013,41 (4) :334–336. |
| [6] | Wu X, Wang CQ, Yan XF, et al. Study on antibiotic resistance and resistance genes of methicillin-resistant Staphylococcus aureus in children[J]. Chinese Journal of Infectious Diseases, 2013, 31 (11) : 641–645 .(in Chinese) 吴霞, 王传清, 严秀峰, 等. 儿童耐甲氧西林金黄色葡萄球菌的耐药性和耐药基因研究[J]. 中华传染病杂志,2013,31 (11) :641–645. |
| [7] | Harmsen D, Claus H, Witte W, et al. Typing of methicillin-resistant Staphylococcus aureus in a university hospital setting by using novel software for spa repeat determination and database management[J]. J Clin Microbiol, 2003, 41 (12) : 5442–5448 . |
| [8] | Xu SJ, Xu DZ. The detection on mecA and femA genes of methicillin resistant Staphylococcus aureus (MRSA) strains and study of antimicrobial sensitivity[J]. Modern Preventive Medicine, 2013, 40 (3) : 531–532 .(in Chinese) 许顺姬, 许东哲. 耐甲氧西林金黄色葡萄球菌中mecA、femA检测及其抗生素敏感性研究[J]. 现代预防医学,2013,40 (3) :531–532. |
| [9] | Zheng B, Li JT. Multiplex PCR for identification of methicillinresistant staphylococci[J]. Chinese Journal of Laboratory Medicine, 1999, 22 (3) : 145–148 .(in Chinese) 郑波, 李家泰. 多重聚合酶链反应检测耐甲氧西林葡萄球菌[J]. 中华医学检验杂志,1999,22 (3) :145–148. |
| [10] | Jarraud S, Mougel C, Thioulouse J, et al. Relationships between Staphylococcus aureus genetic background, virulence factors, agr Groups(Alleles), and human disease[J]. Infection and Immunity, 2002, 70 (2) : 631–641 . |
| [11] | Votintseva AA, Fung R, Miller RR, et al. Prevalence of Staphylococcus aureus protein A(spa)mutants in the community and hospitals in Oxfordshire[J]. BMC Microbiol, 2014 : 63. |
| [12] | Melzer M, Eykyn SJ, Gransden WR, et al. Is methicillin-resistant Staphylococcus aureus more virulent than methicillin-susceptible S. aureus? A comparative cohort study of British patients with nosocomial infection and bacteremia[J]. Clin Infect Dis, 2003, 37 (11) : 1453–1460 . |
| [13] | Jiang AY, Ying J, Guan Y, et al. Detection of mecA and qacA/B genes in clinical isolates of Staphylococcus aureus[J]. Chinese Journal of Nosocomiology, 2010, 20 (9) : 1212–1215 .(in Chinese) 姜爱英, 应俊, 管瑜, 等. 临床分离的金黄色葡萄球菌mecA和qacA/B基因检测[J]. 中华医院感染学杂志,2010,20 (9) :1212–1215. |
| [14] | Huang ZQ, Ju ZL. Dual polymeras chain reaction in the measurement of methicillin resistant Staphylococcus aureus[J]. World Journal of Infection, 2002, 2 (4) : 242–244 .(in Chinese) 黄振球, 居中亮. 应用双重PCR技术检测耐甲氧西林金黄色葡萄球菌[J]. 世界感染杂志,2002,2 (4) :242–244. |
| [15] | Hu JH, Gao ZX, Yin MF. The United States of America NCCLS2002 edition about theantibiotic susceptibility test operation standard updates[J]. Chinese Journal of Laboratory Medicine, 2002, 25 (6) : 367–369 .(in Chinese) 胡继红, 高振翔, 尹铭芳. 美国NCCLS2002年版抗生素药敏试验操作标准更新内容[J]. 中华检验医学杂志,2002,25 (6) :367–369. |
| [16] | Hoseini ASM, Motamedifar M, Hadi N, et al. Analysis of virulence genes among methicillin resistant Staphylococcus aureus (MRSA) strains[J]. Jundishapur J Microbiol, 2014, 7 (6) : e10741. |
| [17] | Tong J, Zhan ZP. Study of the virulence genes and molecular characteristics of Staphylococcus aureus strains[J]. Chinese Journal of Microbiology and Immunology, 2015, 35 (1) : 46–50 .(in Chinese) 童俊, 占志平. 金黄色葡萄球菌毒力基因检测及分子分型研究[J]. 中华微生物学和免疫学杂志,2015,35 (1) :46–50. |
| [18] | Yu FY, Li TJ, Huang XY, et al. Virulence gene profiling and molecular characterization of hospital-acquired Staphylococcus aureus isolates associated with bloodstream infection[J]. Diagn Microbiol Infect Dis, 2012, 74 (4) : 363–368 . |
| [19] | Collins J, Rudkin J, Recker M, et al. Offsetting virulence and antibiotic resistance costs by MRSA[J]. ISME J, 2010, 4 (4) : 577–584 . |
| [20] | Wang JR, Du XL, Ta L, et al. Genotyping and detection of virulence genes for methicillin-resistant and-sensitive Staphylococcus aureus[J]. Chinese Journal of Infection and Chemotherapy, 2015, 15 (1) : 70–75 .(in Chinese) 王俊瑞, 杜小莉, 塔拉, 等. 甲氧西林耐药/敏感金黄色葡萄球菌基因分型和毒力基因检测[J]. 中国感染与化疗杂志,2015,15 (1) :70–75. |
| [21] | Shukla SK, Karow ME, Brady JM, et al. Virulence genes and genotypic associations in nasal carriage, community-associated methicillin-susceptible and methicillin-resistant USA400Staphylococcus aureus isolates[J]. J Clin Microbiol, 2010, 48 (10) : 3582–3592 . |
| [22] | Kateete DP, Namazzi S, Okee M, et al. High prevalence of methicillin resistant Staphylococcus aureus in the surgical units of Mulago hospital in Kampala, Uganda[J]. BMC Res Notes, 2011 : 326. |
| [23] | Zhu J, Lu J, Yu XL, et al. Research on virulence gene of multi-source methicillin-resistant Staphylococcus aureus[J]. Laboratory Medicine, 2012, 27 (6) : 475–478 .(in Chinese) 祝进, 陆军, 余旭良, 等. 不同来源耐甲氧西林金黄色葡萄球菌毒力基因的研究[J]. 检验医学,2012,27 (6) :475–478. |
| [24] | Martinez-Aguilar G, Avalos-Mishaan A, Hulten K, et al. Community-acquired, methicillin-resistant and methicillin-susceptible Staphylococcus aureus musculoskeletal infections in children[J]. Pediatr Infect Dis J, 2004, 23 (8) : 701–706 . |
| [25] | Liu YD, Wang H, Du N, et al. Molecular evidence for spread of two major methicillin-resistant Staphylococcus aureus clones with a unique geographic distribution in Chinese hospitals[J]. Antimicrob Agents Chemother, 2009, 53 (2) : 512–518 . |
| [26] | Geng WJ, Yang YH, Wu DJ, et al. Molecular characteristics of community-acquired, methicillin-resistant Staphylococcus aureus isolated from Chinese children[J]. FEMS Immunol Med Microbiol, 2010, 58 (3) : 356–362 . |
| [27] | Li KC, Li Q, Xia F, et al. Study on spa typing of methicillin resistant Staphylococcus aureus[J]. Disease Surveillance, 2012, 27 (11) : 877–880 .(in Chinese) 李克诚, 李琼, 夏菲, 等. 耐甲氧西林金黄色葡萄球菌spa基因分型[J]. 疾病监测,2012,27 (11) :877–880. |
 2016, Vol. 31
2016, Vol. 31


