扩展功能
文章信息
- 郑霄, 王鲁茜, 朱雄, 陈海, 吴华, 麦文慧, 李伟, 夏连续
- ZHENG Xiao, WANG Lu-xi, ZHU Xiong, CHEN Hai, WU Hua, MAI Wen-hui, LI Wei, XIA Lian-xu
- 强台风后类鼻疽发病情况及临床菌株分子特征的初步分析
- Preliminary study on incidence of melioidosis and molecular characteristics of clinical strains of Burkholderia pseudomallei after Typhoon Rammasun attack
- 疾病监测, 2016, 31(8): 628-632
- Disease Surveillance, 2016, 31(8): 628-632
- 10.3784/j.issn.1003-9961.2016.08.004
-
文章历史
- 收稿日期:2016-03-25
2. 北京市昌平区疾病预防控制中心, 北京 102200;
3. 海南省三亚市人民医院, 海南 三亚 572000;
4. 海南省人民医院, 海南 海口 570311;
5. 海口市第三人民医院, 海南 海口 571100
2. Changping District Center for Disease Control and Prevention, Beijing 102200, China;
3. Sanya People's Hospital, Sanya 572000, Hainan, China;
4. Hainan Provincial People's Hospital, Haikou 570311, Hainan, China;
5. The Third People's Hospital of Haikou, Haikou 571100, Hainan, China
类鼻疽是由类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,类鼻疽伯克菌)引起的一种严重热带传染病。潜伏期多为2~4周,可导致肺炎、败血症等严重临床表现,病死率达20%~40%[1]。受感染途径、传播方式等因素影响,此病一般为散发,暴发及聚集性病例罕见[1]。
我国类鼻疽疫区主要位于海南、广东、广西、香港、台湾等省(自治区、地区),其中海南省及台湾地区报道的病例数最多。研究发现,台湾地区的类鼻疽发病多呈聚集性,且常由台风引发[2]。与此相比,近年海南省类鼻疽病例上升明显[3],但流行特征及感染来源尚不明确。2014年7月,超强台风“威马逊”(Rammasun)袭击海南省并造成严重人员、财产损失。为了解灾后类鼻疽流行特点及病原菌遗传学特征,初步探讨海南地区台风与类鼻疽发病的关系,在海南省3所具有类鼻疽诊治能力的大型医院对类鼻疽的发病情况进行了主动监测,并对临床菌株进行了分子分型及同源性比对,报告如下。
1 资料与方法 1.1 类鼻疽病例主动监测“威马逊”台风灾后2个月内(2014年7月18日至9月18日)在海南3所大型医疗中心(海南省人民医院、三亚市人民医院和海口市第三人民医院)开展针对类鼻疽病的主动监测工作。类鼻疽的确诊通常依赖病原学诊断,因此本次调查以自患者的血液、脓液等生物标本分离出“类鼻疽伯克菌”作为病例确诊标准[1]。将患者的生物标本接种于血平板,37 ℃培养48 h;生长出的疑似菌落通过API 20NE(法国生物梅里埃公司)生化反应、16S rDNA序列比对等方法进一步确认。查阅相关病历,采集患者个人信息及临床表现、病史等资料并进行描述流行病学分析。同时,与3所医院2013年同期(未发生台风)类鼻疽病例的分布情况进行了比较分析。
1.2 绘制类鼻疽病例分布地图“威马逊”台风相关信息采自深圳台风网(http://tf.szmb.gov.cn/)。患者住址信息(以乡镇为单位)源自病历资料。通过百度地图工具(http://map.baidu.com/)对台风路径及患者住址进行地理定位并转化为地理信息。采用Arc GIS 9.0软件绘制类鼻疽病例分布地图。
1.3 临床菌株的分子分型及同源性比较 1.3.1 多位点序列分型(MLST)参照文献[4],PCR扩增7个等位基因(ace、gltB、gmhD、lepA、lipA、narK、ndh)目的片段并测序。序列校对后提交类鼻疽伯克菌MLST数据库(http://bpseudomallei.mlst.net),获得各等位基因序列号并确定菌株序列型(Sequence Type,ST)。
1.3.2 脉冲场凝胶电泳(PFGE)采用CHEF Mapper System(美国BIORAD公司产品)进行PFGE,所用内切酶(SpeⅠ)、操作程序及电泳参数与以往文献相同[5]。采用BioNumerics 5.0软件(比利时Applied Maths公司)进行图像比对及同源性分析。
1.3.3 多位点可变数目串联重复序列多态性分析(MLVA)采用类鼻疽伯克菌MLVA-4分型方案[6],简述如下:提取细菌染色体DNA,然后进行4个VNTR位点(2341、1788、933、389)的PCR扩增;经毛细管电泳(北京天一辉远生物技术有限公司)确定PCR产物长度;最后根据产物长度计算各位点VNTR的重复次数,获得MLVA-4指纹谱。
2 结果 2.1 病例基本情况“威马逊”台风灾后2个月内3所医院共收治经病原学确诊的类鼻疽病例16例,高于2013年(未发生台风)同期的7例,见图 1。患者平均年龄53.9(17~81)岁,男性12例(75.0%),农民10例(62.5%),患有糖尿病,肝、肾及免疫系统疾病的病例12例(75.0%),见表 1。临床表现:肺炎12例(75.0%),败血症11例(68.8%),泌尿系感染3例(18.8%),颅内感染1例(6.3%),局部软组织感染2例(12.5%)(表 1);4例患者(25.0%)并发感染性休克。经规范治疗,16例患者中8例治愈,8例死亡。死亡病例中,5例合并肺部感染及败血症(62.5%)。
2.2 病例时空分布首例类鼻疽患者于台风后第6日入院,第2周入院病例达高峰(4例),随后逐渐降低(图 1)。12例患者于台风后2~4周内发病,与其引发类鼻疽感染的潜伏期一致。2013年同期7例病例时间分布每周0~2人(图 1),未见聚集性。
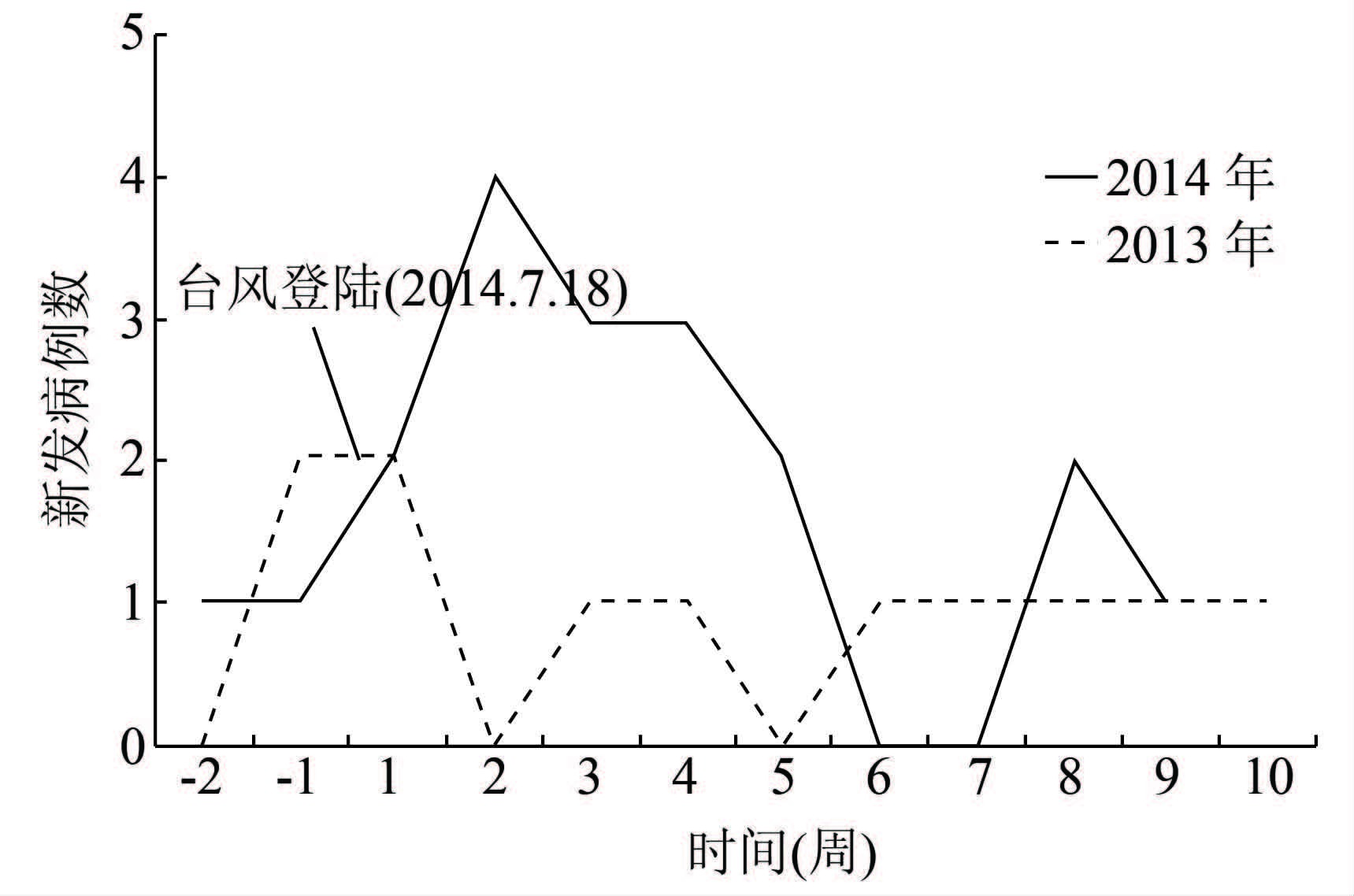
|
| 图 1 台风前后3所医院接收类鼻疽病例的时间分布曲线及与2013年的比较 Figure 1 Time distribution curve of melioidosis cases before and after typhoon attack and comparison with that of 2013 in 3 hospitals |
| |
台风路径及16例类鼻疽患者的分布地图见图 2,所有病例均分布于受台风影响较大的海南北部地区,南部地区未见病例。病例分布呈现聚集性:9例集中分布于台风中心经过的海口-文昌带状区域。以往散发病例较多的东方市也出现3例类鼻疽重症病例。2013年同期病例地理分布:定安、保亭、三亚、陵水、万宁、东方等县(市)各1例(其中1例来源不明),呈散在分布;其中海南北部(定安)1例,南部5例。
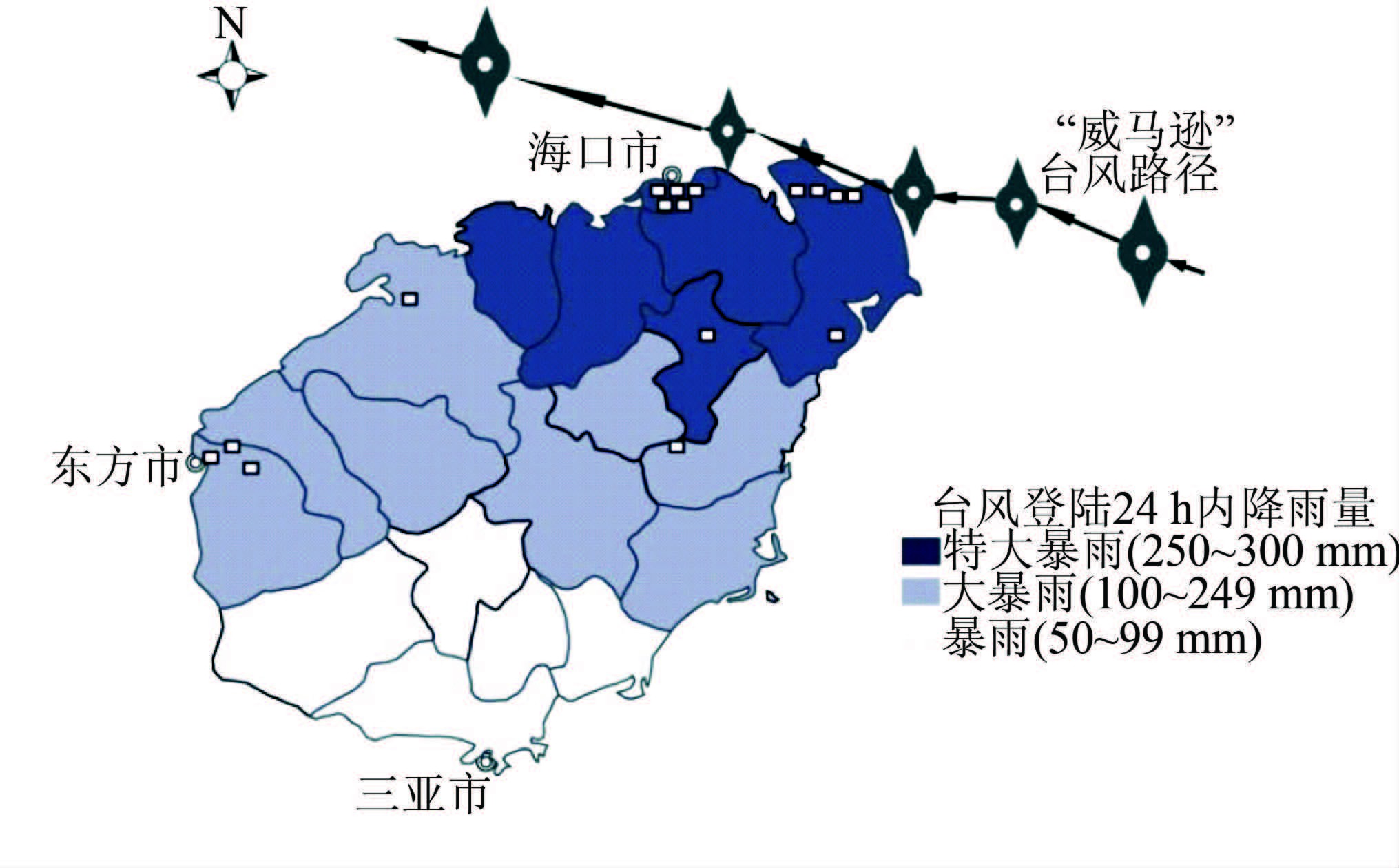
|
| 图 2 威马逊”台风路径及16例类鼻疽患者的地理分布 Figure 2 Typhoon Rammasun path and geographic distribution of melioidosis cases in Hainan |
| |
用于实验的16株类鼻疽伯克菌均分离自类鼻疽病例(表 1)。MLST将16株类鼻疽伯克菌分为12个ST型。其中ST46(4株)、ST1325(2株)为主要序列型;其余10个ST型各包含1株菌。16株类鼻疽伯克菌分为13个PFGE带型;4株ST46型菌株的PFGE带型基本相同(相似度98%~100%),2株ST1325型菌株(HN003、HN005)的PFGE带型完全相同(图 3)。更高分辨率的MLVA-4将16株类鼻疽伯克菌分为15个基因型;2株ST1325型菌株(HN003、HN005)未能区分(图 3)。以上结果提示,16株类鼻疽伯克菌至少对应于15个基因型,呈高度遗传多态性,能够排除生物恐怖犯罪引发聚集性感染的可能性。
| 患者编号 | 年龄(岁) | 性别 | 职业 | 住址所在地 | 临床表现 | 易感因素 | 预后 | 分离菌株 |
| 001 | 62 | 男 | 农民 | 定安县 | 败血症、感染性肺炎、胸膜炎 | 酒精性肝病 | 治愈 | HN001 |
| 002 | 74 | 男 | 农民 | 海口市 | 感染性肺炎 | 肿瘤 | 死亡 | HN002 |
| 003 | 64 | 女 | 农民 | 文昌市 | 败血症、泌尿系感染 | 糖尿病 | 治愈 | HN003 |
| 004 | 53 | 女 | 农民 | 东方市 | 肺部感染、脓毒血症、感染性休克 | 糖尿病 | 死亡 | HN004 |
| 005 | 59 | 男 | 自由职业 | 文昌市 | 败血症、颅内感染、肺部感染、感染性休克 | 糖尿病 | 死亡 | HN005 |
| 006 | 81 | 男 | 农民 | 文昌市 | 肺部感染 | 无 | 治愈 | HN006 |
| 007 | 29 | 女 | 农民 | 海口市 | 败血症、肺部感染、皮肤脓肿 | 糖尿病 | 治愈 | HN007 |
| 008 | 60 | 男 | 农民 | 文昌市 | 感染性肺炎 | 无 | 死亡 | HN008 |
| 009 | 37 | 男 | 工人 | 琼海市 | 败血症 | 肝硬化、糖尿病 | 死亡 | HN009 |
| 010 | 53 | 男 | 农民 | 儋州市 | 败血症 | 无 | 治愈 | HN010 |
| 011 | 41 | 男 | 农民 | 东方市 | 重症肺炎、脓毒血症、腹膜炎、感染性休克 | 肝硬化晚期 | 死亡 | HN011 |
| 012 | 56 | 男 | 职员 | 海口市 | 感染性肺炎 | 糖尿病 | 治愈 | HN012 |
| 013 | 51 | 男 | 自由职业 | 海口市 | 脓毒血症、肺部感染、感染性休克、软组织脓肿 | 糖尿病 | 死亡 | HN013 |
| 014 | 17 | 女 | 自由职业 | 东方市 | 重症肺炎、败血症太紧、泌尿系感染 | 系统性红斑狼疮 | 死亡 | HN014 |
| 015 | 62 | 男 | 农民 | 文昌市 | 睾丸脓肿、附睾炎 | 无 | 治愈 | HN015 |
| 016 | 63 | 男 | 无业 | 海口市 | 败血症、肺部感染 | 糖尿病 | 治愈 | HN016 |

|
| 图 3 16株类鼻疽伯克霍尔德菌临床菌株的分子分型及同源性比较结果 Figure 3 Molecular typing and homologous analysis of 16 clinical isolates of B. pseudomallei |
| |
气候变化已成为类鼻疽发病、流行的重要影响因素,但其原因尚未阐明。2009年的厄尔尼诺现象曾在澳大利亚北部引发强降水,使当地类鼻疽发病数上升了237%[7]。在台湾地区南部类鼻疽流行区,近年台风袭击已引发多起类鼻疽暴发流行[2]。一般认为,台风、暴雨等极端天气带来大量降水,使栖息于深层泥土中的类鼻疽致病菌能够转移至地表并且大面积传播,增加了经接触途径感染的机会。此外,台湾地区相关研究证明,台风期间类鼻疽疫区空气中类鼻疽伯克菌分离阳性率达100%,可大大增加经呼吸道途径感染类鼻疽的机会[2]。
本研究首次对海南地区强台风后的类鼻疽发病情况进行调查及初步流行病学分析。受当地医疗机构类鼻疽诊断能力差异所限,本次调查范围只包含海南3所大型医院。海南省人民医院、海口市第三人民医院位于海南北部的海口市,三亚市人民医院位于海南南端的三亚市。作为具有类鼻疽病原学诊断能力的区域中心医院,3所医院分别辐射全省北部及南部地区,具有一定的代表性,在一定程度上避免了医院地理位置集中对病例分布产生偏性的影响。结果显示,与未发生台风的2013年(同期7例)相比,“威马逊”台风后2个月内3所医院收治的类鼻疽病例数(16例)上升了129%。此外,病例的发病时间、空间分布均呈现聚集性:12例(75.0%)于灾后2~4周发病,高峰期位于灾后第2周(4例),此后逐渐降低;9例来自台风中心经过的带状区域,分布密集。上述现象值得关注。首先,受传播途径、感染方式和人群易感性等因素影响,类鼻疽极少暴发流行。该带形区域在2个月内出现9例类鼻疽病例,在海南地区以往未见报告,世界范围内也很少报道。另一方面,此次类鼻疽疫情的时间、临床特征与台湾地区台风后类鼻疽的诸多特点存在相似之处。以往(2005、2007和2009年)发生于台湾地区的台风相关类鼻疽疫情中,台风后1个月内病例数突然增加,肺炎型类鼻疽比例上升(70%),重症患者比例高,病死率高(27%)[8]。与此相近,除发病时间一致外,本次调查的类鼻疽病例也呈现肺炎型比例高(75%),重症病例比例高(病死率50%)等特点。
由于缺乏当地类鼻疽发病本底资料,调查规模较小等不足,本研究尚不足以明确海南地区台风与类鼻疽发病的联系。尽管如此,结合以往台湾等地区的相关报道,根据此次台风后短期出现大量类鼻疽病例及其时空分布和临床表现等特征,提示一些气候因素,尤其是台风有可能对该地区类鼻疽的发病和流行趋势产生影响。疫区卫生部门对台风后的类鼻疽流行应有所警觉,并加强针对性预警和防控措施。
为探索聚集性病例的原因并提供分子依据,笔者对相关临床菌株进行了分子分型及同源性比对。除两株ST1325型菌株外,相关致病菌的MLVA-4指纹谱各不相同,可排除生物恐怖袭击及人间传染的可能性。基于病例的地域分布特点,将此次台风后的类鼻疽流行区分为3种类型:(1)文昌-海口带状区域为代表的高发区:此区域距台风中心最近并且台风后易出现类鼻疽聚集病例;(2)海南北部散发区:该区域受台风影响较小,台风后有类鼻疽散发病例出现;(3)以东方市为代表的类鼻疽历史高发区:距台风中心较远,但仍出现多名重症病例,可能与当地存在其他类鼻疽易感因素有关。分子分型证实,4株ST46型菌株(HN002、HN011、HN014、HN016)全部分布于海口、东方等类鼻疽高危或高发地区,提示此型菌株可能代表了台风后引发类鼻疽流行的优势克隆,应予以关注。此外,两株ST1325型菌株(HN003、HN005)分子指纹特征完全相同,但病例居住地相隔较远,需要进一步采用基于全基因组序列的同源比对方法以确定二者是否存在流行病学关联。
| [1] | Wiersinga WJ, Currie BJ, Peacock SJ. Melioidosis[J]. N Engl J Med , 2012, 367 (11) : 1035–1044. DOI:10.1056/NEJMra1204699 |
| [2] | Chen YL, Yen YC, Yang CY, et al. The concentrations of ambient Burkholderia pseudomallei during typhoon season in endemic area of melioidosis in Taiwan[J]. PLoS Negl Trop Dis , 2014, 8 (5) : e2877. DOI:10.1371/journal.pntd.0002877 |
| [3] | Fang Y, Chen H, Li YL, et al. Melioidosis in Hainan,China:a restrospective study[J]. Trans R Soc Trop Med Hyg , 2015, 109 (10) : 636–642. DOI:10.1093/trstmh/trv065 |
| [4] | Godoy D, Randle G, Simpson AJ, et al. Multilocus sequence typing and evolutionary relationships among the causative agents of melioidosis and glanders,Burkholderia pseudomallei and Burkholderia mallei[J]. J Clin Microbiol , 2003, 41 (5) : 2068–2079. DOI:10.1128/JCM.41.5.2068-2079.2003 |
| [5] | Chen YL, Lin YC, Chen YS, et al. Characterisation of predominant molecular patterns of Burkholderia pseudomallei in Taiwan[J]. Trans Roy Soc Trop Med Hyg , 2013, 107 (3) : 165–169. DOI:10.1093/trstmh/trs093 |
| [6] | Currie BJ, Haslem A, Pearson T, et al. Identification of melioidosis outbreak by multilocus variable number tandem repeat analysis[J]. Emerg Infect Dis , 2009, 15 (2) : 169–174. DOI:10.3201/eid1502.081036 |
| [7] | Parameswaran U, Baird RW, Ward LM, et al. Melioidosis at Royal Darwin Hospital in the big 2009-2010 wet season:comparison with the preceding 20 years[J]. Med J Aust , 2012, 196 (5) : 345–348. DOI:10.5694/mja11.11170 |
| [8] | Chou DW, Chung KM, Chen CH, et al. Bacteremic melioidosis in southern Taiwan:clinical characteristics and outcome[J]. J Formos Med Assoc , 2007, 106 (12) : 1013–1022. DOI:10.1016/S0929-6646(08)60077-7 |
 2016, Vol. 31
2016, Vol. 31


