扩展功能
文章信息
- 董梅, 邵祝军, 黄芳
- DONG Mei, SHAO Zhu-jun, HUANG Fang
- 我国首例脑膜炎球菌肺炎的病原学研究
- Etiology of the first meningococcal pneumonia case in China
- 疾病监测, 2016, 31(8): 633-637
- Disease Surveillance, 2016, 31(8): 633-637
- 10.3784/j.issn.1003-9961.2016.08.005
-
文章历史
- 收稿日期:2016-05-26
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. State Key Laboratory for Communicable Disease Control and Prevention, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
脑膜炎奈瑟菌(Neisseria meningitidis,Nm)是全球细菌性脑膜炎的主要病因之一,可以引起败血症、肺炎、结膜炎、咽炎、心包炎、化脓性关节炎和尿道炎[1]。脑膜炎球菌肺炎并不常见,大约占所有侵袭性脑膜炎球菌病的5%~10%[2-5],我国至今尚无有关脑膜炎球菌肺炎的文献报道。本研究报道1例肺炎患者支气管吸取物中分离到脑膜炎奈瑟菌株,并对其特征进行分析和研究。
1 材料与方法 1.1 病例、菌株和试剂 1.1.1 病例和菌株资料菌株分离自60岁男性患者。该患者有肿瘤史,于2014年6月就诊于卫生部北京医院,X线结果显示肺部有阴影,诊断为肺炎。采集其支气管吸取物进行细菌的分离培养。
1.1.2 试剂及仪器哥伦比亚血平板、M-H血平板[赛默飞世尔生物化学制品(北京)有限公司];API NH生化鉴定试剂盒(Bio-Merieux 公司,法国);Remel脑膜炎奈瑟菌参考诊断血清(美国);细菌基因组DNA提取试剂盒(QIAGEN公司,德国);脑膜炎奈瑟菌实时荧光定量PCR检测试剂盒(江苏和创生物科技有限公司,中国)。实时荧光定量PCR仪(ABI 7500 Fast RealTime PCR System,美国);7对管家基因及PorA、FetA扩增引物和测序引物参照PubMLST(www.pubmlst.org/neisseria/info),引物合成及PCR产物测序均由生工生物工程(上海)股份有限公司完成。Etest试条购于瑞典AB BIOMERIEUX 公司。所有试剂均在有效期内使用。
1.2 方法 1.2.1 细菌学和血清分群将分离菌株接种于哥伦比亚血平板,置5% CO2培养箱中37 ℃孵育24 h后,挑选单个菌落进行纯培养。观察菌落形态、革兰染色及显微镜检查进行初步判断,革兰染色阴性的双球菌通过氧化酶试验和生化试验进行生物学鉴定;用脑膜炎奈瑟菌参考血清玻片凝集试验进行血清分群。
1.2.2 核酸检测将细菌悬液煮沸作为基因组DNA模板,用多重实时荧光定量聚合酶链反应(PCR)方法检测分离菌株的脑膜炎奈瑟菌种特异基因ctrA和群特异基因siaD和sacB,通过核酸检测确定细菌所携带的荚膜基因。
1.2.3 多位点序列分型(MLST)提取经过鉴定菌株的基因组DNA,根据PubMLST网站(http://pubmlst.org/neisseria)提供的引物序列和扩增条件分别扩增脑膜炎奈瑟菌7个管家基因abcZ、adk、aroE、fumC、gdh、pdhC、pgm和porA、fetA,并将扩增片段进行测序。测序结果在PubMLST网站数据库中进行比对,确定其基因序列类型和相应所属克隆群。
1.2.4 药物敏感性试验用Etest试条体外检测该分离菌株对12种抗菌药物敏感性。严格按照说明书操作。测定其对青霉素、氨苄西林、美罗培南、头孢曲松、头孢噻肟、氯霉素、四环素、阿奇霉素、利福平、环丙沙星、左氧氟沙星、复方新诺明12种抗菌药物最小抑菌浓度(MIC)。同时用链球菌ATCC49619和大肠埃希菌ATCC25922作为质控对照,操作与待检菌株一致,只有当质控菌MIC值位于质控范围内时,待检菌株的MIC值为有效。
2 结果 2.1 菌株分离培养和鉴定结果分离菌株在哥伦比亚血平板生长24 h的菌落形态呈灰白色、半透明、圆形、露滴状、不溶血;显微镜下菌体呈革兰染色阴性双球状。氧化酶试验阳性、NH生化鉴定结果为分解葡萄糖和麦芽糖,不分解乳糖和蔗糖。菌落形态、菌体形态和生化结果均与脑膜炎奈瑟菌特征符合,鉴定该菌株为脑膜炎奈瑟菌。
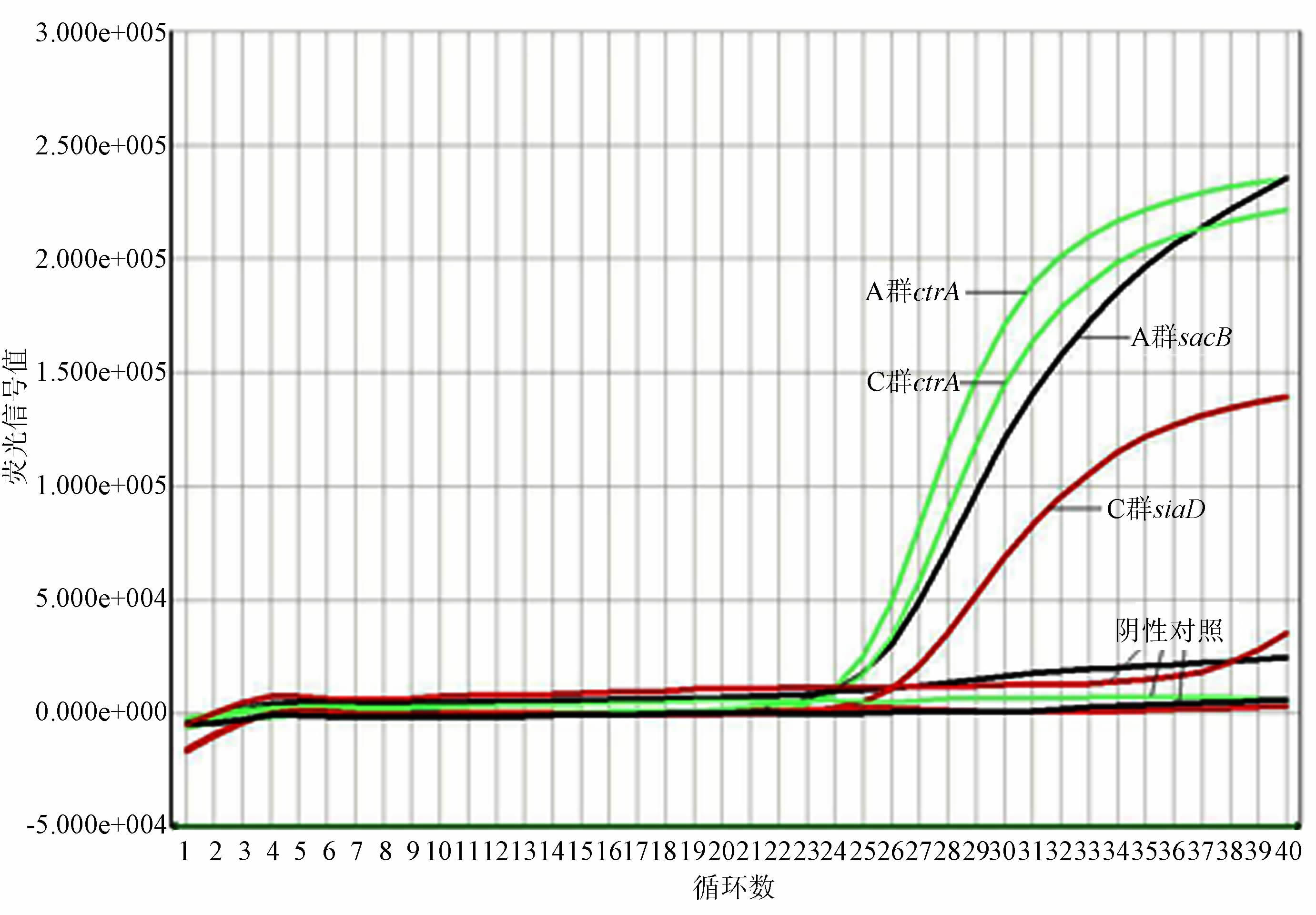
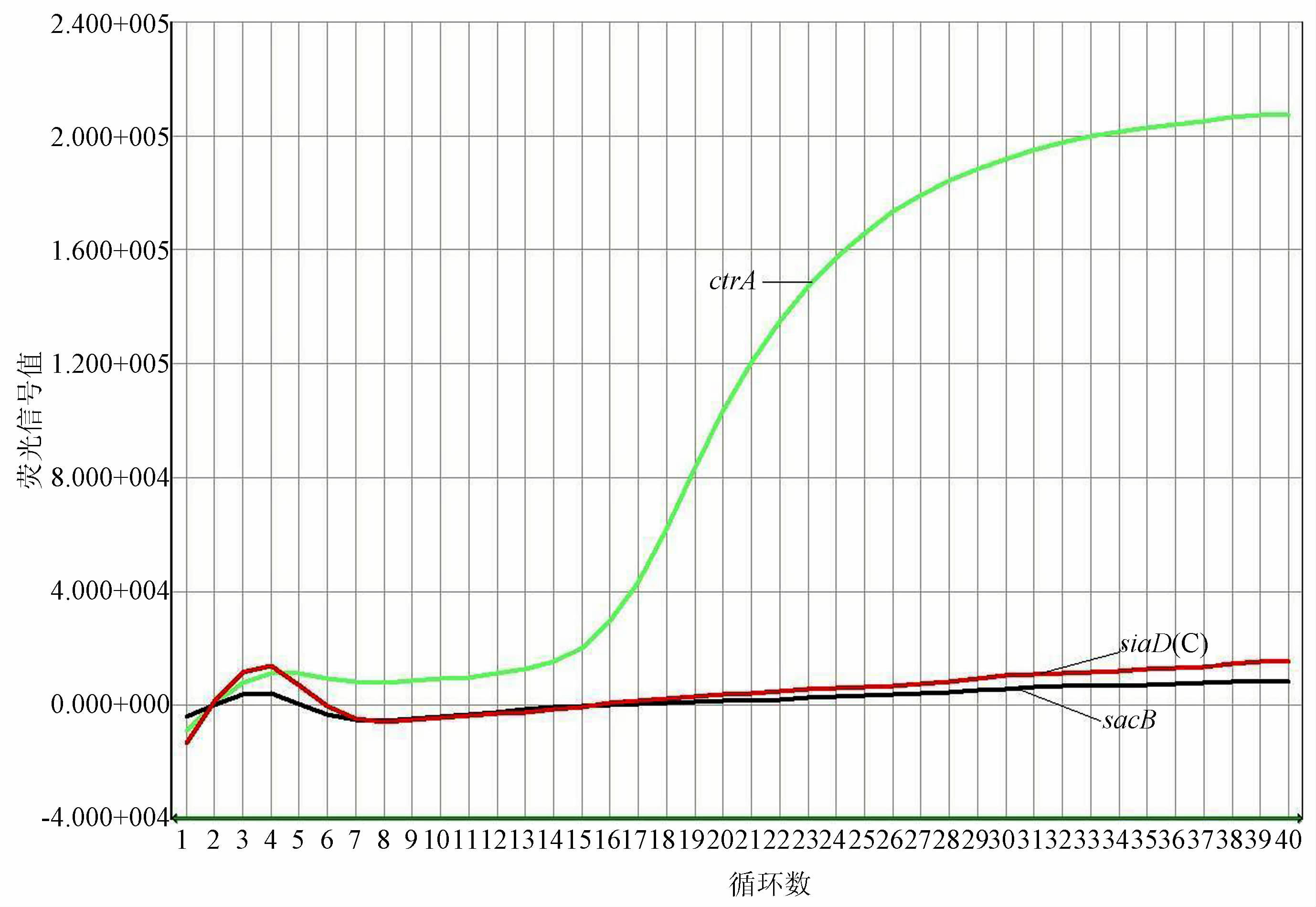
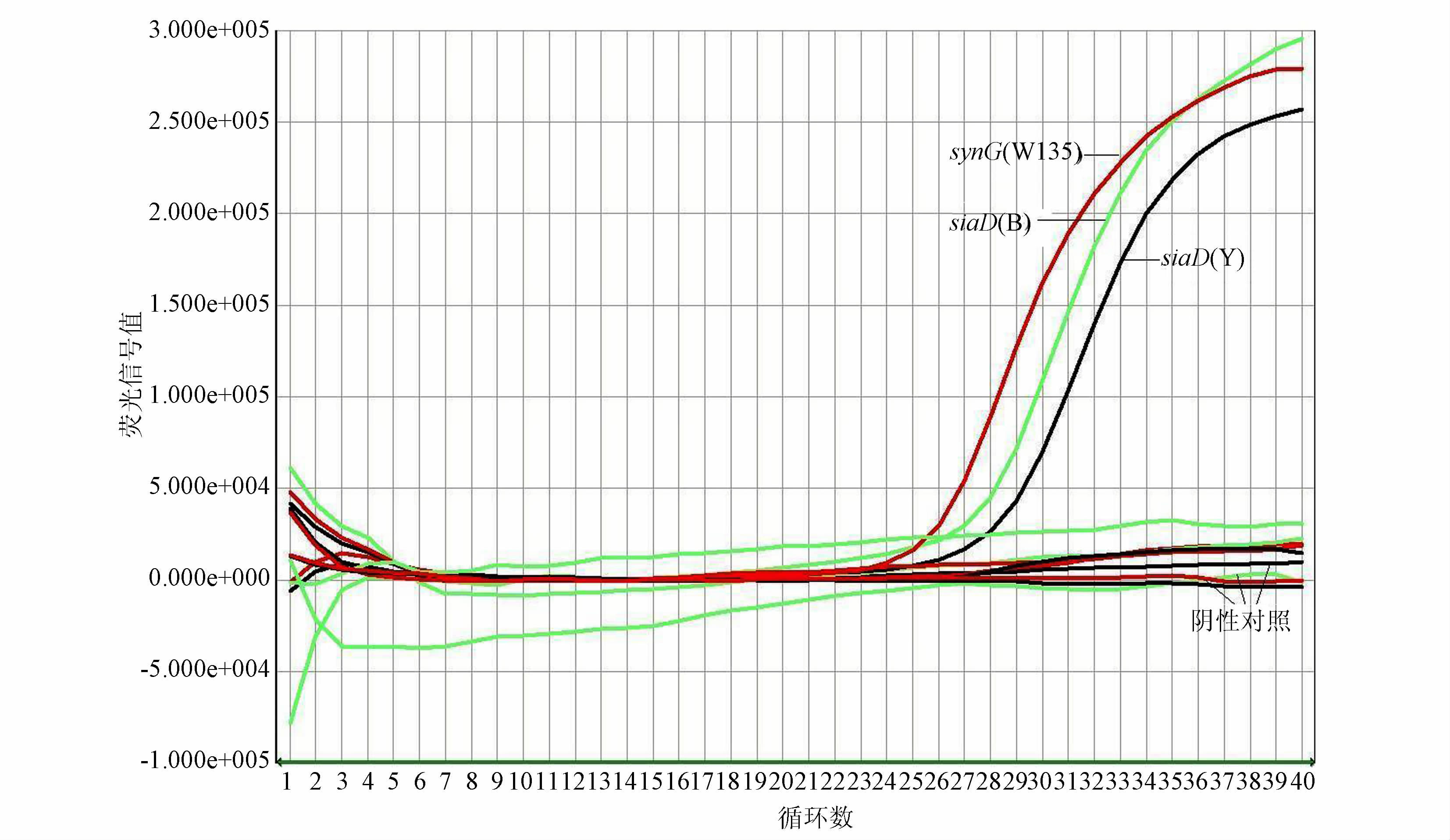
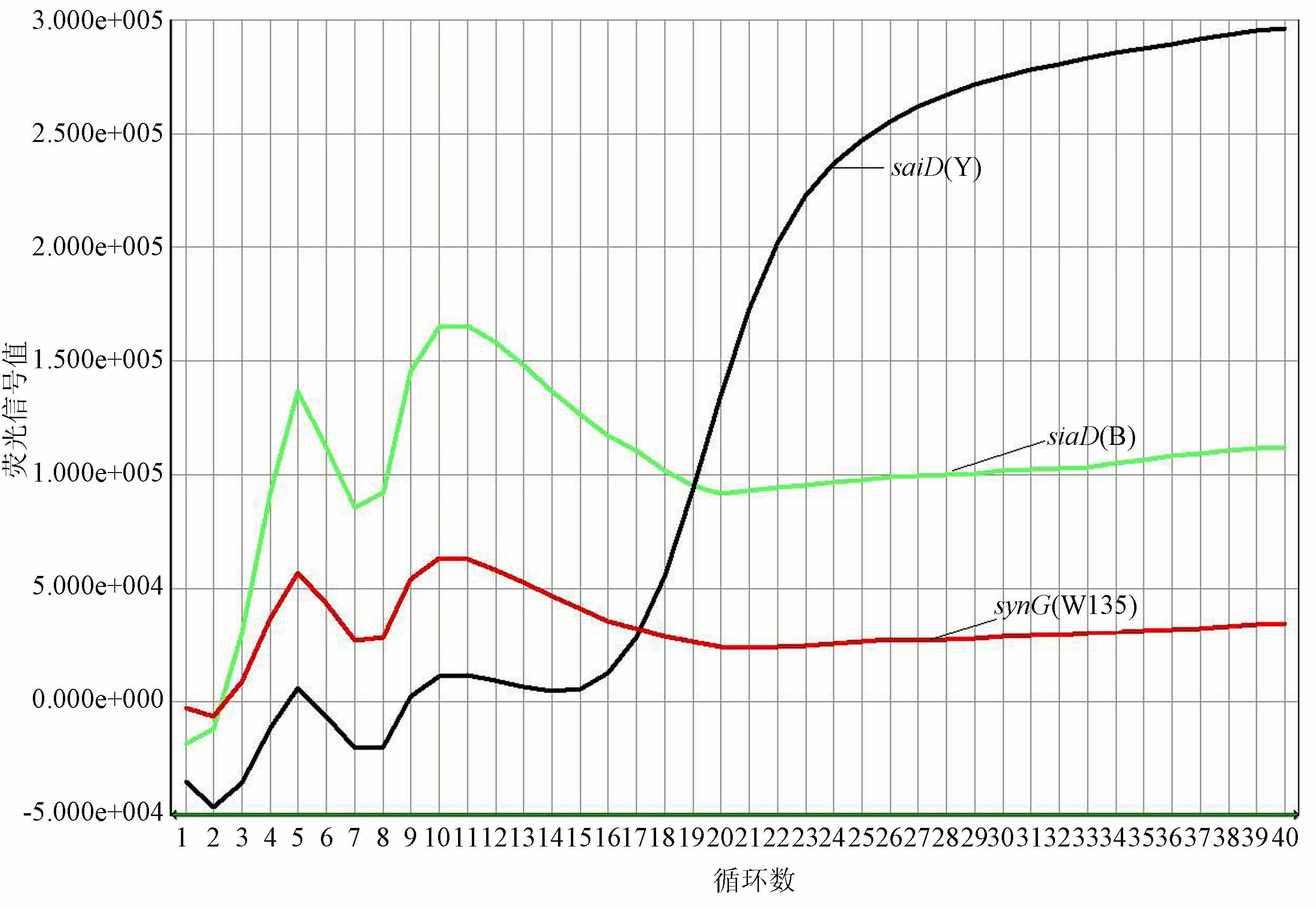
2.2 血清分群结果细菌悬液与生理盐水发生凝集,结果见表 1。鉴定为血清不可分群。基因检测结果见图 1~4。图 1和3为试验阳性及阴性质控结果,图 2和4为分离菌株检测结果。用多重实时荧光定量PCR从细菌基因组DNA中检测到脑膜炎奈瑟菌种特异性基因ctrA和Y群siaD群特异性荚膜基因,鉴定该菌株为携带Y群荚膜基因的不可分群脑膜炎奈瑟菌。
| 菌株 | 生理盐水 | 抗体 | |||||||||
| I多价 | A | B | C | D | II多价 | X | Y | W135 | Z | ||
| 分离菌株 | ++ | ++ | ++ | ++ | ++ | ++ | +++ | ++ | +++ | ++ | ++ |
| ATCC29019 | - | ++++ | ++++ | - | - | - | - | - | - | - | - |
| Nm M5178 | - | ++++ | - | ++++ | - | - | - | - | - | - | - |
|
| 图 1 crgA、sacB(A)及siaD(C)基因阳性对照和阴性对照结果 Figure 1 Detection results of positive and negative control of ctrA,sacB(A) and siaD(C) genes |
| |
|
| 图 2 分离菌株检测结果 Figure 2 Detection results of isaolate |
| |
|
| 图 3 siaD(B)、siaD(Y)及synG(W135)基因的阳性对照和阴性对照结果 Figure 3 Detection results of positive and negtive control of siaD(B)、siaD(Y) and synG(W135)genes |
| |
|
| 图 4 分离菌株检测结果 Figure 4 Detction results of isolate |
| |
将7个看家基因扩增产物测序结果与国际MLST网络数据库中N. meningitidis 菌株序列比对后,得到的等位基因值分别为abcZ 3; adk 7; aroE 53; FumC 37;gdh 8; pdhC 18; pgm 21。经比对,在数据库中没有查询到任何与所获得的等位基因数值组合完全一致的基因序列类型,将该组数据上传后,数据库赋予其新ST编号11039,属于cc92克隆群,porA为VR1.1-5,VR2.P10-4,fetA为F1-5。因此,该菌株鉴定结果为:NG: P1.5-1,10-4: F5-1: ST-11039 (cc92)。
2.4 药物敏感性试验结果该菌株对12种药物的MIC值(μg/ml)分别是青霉素G 0.047;氨苄西林 0.064;头孢噻肟和头孢曲松均小于0.016; 美罗培南 0.023; 四环素 0.125; 氯霉素 0.75; 利福平 0.047; 阿奇霉素 3; 环丙沙星 0.25;左氧氟沙星 0.19; 复方新诺明 0.75。根据2011年美国CLSI抗微生物药物敏感性试验的脑膜炎奈瑟菌MIC解释标准进行判断,该菌株对复方新诺明、阿奇霉素、环丙沙星及左氧氟沙星耐药外,对其他8种等药物均敏感。
3 讨论流行性脑脊髓膜炎(流脑)传染性强,病死率高,对人类危害严重,该病疾病负担对全球公共卫生系统造成巨大压力。中国与其他大部分国家一样,通过采集血液、脑脊液、疱疹液等标本进行PCR核酸检测和细菌培养,对临床上有流脑症状的患者实施监测[3]。其他脑膜炎球菌病,如脑膜炎球菌性肺炎等并未在常规监测范围内。脑膜炎奈瑟菌是引起脑膜炎球菌性肺炎的主要病原体,许多国家和地区有脑膜炎球菌肺炎的报道[2-5],我国除流脑、脑膜炎球菌血症外,至今未报道过任何其他脑膜炎球菌病,可能与监测的目的、症状、范围和重点有关。
研究表明,从肺炎病例血液、胸水或下呼吸道标本中分离到脑膜炎奈瑟菌是脑膜炎球菌肺炎病原确诊的直接证据,痰和气管吸取物的革兰染色结果也是支持其病原学诊断的有力证据[2]。因此,确诊脑膜炎球菌肺炎不仅需要根据临床症状,还需要血培养或呼吸道标本病原检测等实验室检测结果的支持。本研究利用北京市呼吸道传染病病原学监测网络,从1例肺炎患者支气管吸取物中分离到脑膜炎奈瑟菌,最终诊断为脑膜炎球菌肺炎,是国内首次关于脑膜炎球菌肺炎的报道,同时证实在我国也有脑膜炎奈瑟菌引起的肺炎病例存在,既往可能低估了脑膜炎奈瑟菌感染造成的疾病负担。提示在做好常规流脑监测的同时,也要关注脑膜炎奈瑟菌感染在急性呼吸道感染中的作用,从而全面、科学评估脑膜炎奈瑟菌感染在我国造成的疾病负担。
脑膜炎奈瑟菌根据荚膜多糖的结构和抗原特征分为12个血清群,其中6个(A、B、C、W135、Y、X)血清群几乎引起全球所有脑膜炎球菌病[3]。另外还有一部分脑膜炎奈瑟菌用血清分群时出现盐水自凝、各种血清均不凝胶或者多种血清凝集的现象,这部分菌株被判定为不可分群[6]。据文献报道,引起肺炎的脑膜炎奈瑟菌仅限于5个(Y、W135、B、C、Z)血清群[2, 4-5],尚未见到有不可分群脑膜炎奈瑟菌致病的报道。不可分群菌株是脑膜炎奈瑟菌正常携带菌株的重要组成部分,占健康携带菌株总数的三分之一,甚至更多[7]。2015年Harrison等[8]研究结果显示,脑膜炎奈瑟菌在高中学生中的携带率为3.2%~4.0%,远低于预期,其中鉴定为血清不可分群菌株数占总携带菌株数的88%。20122014年北京市脑膜炎奈瑟菌健康人群携带率调查结果显示,不可分群菌株占健康人群所有脑膜炎奈瑟菌携带菌株的64.8%,其中,50%不可分群菌株携带B群荚膜基因,携带Y群荚膜基因的占比为1.4%。
2000年,Winstead 等[2]综述了58例脑膜炎球菌肺炎病例,结果显示患者年龄中位值为57.5岁,优势血清群是Y群。监测记录显示,1990年美国几个区域脑膜炎球菌病病例增加主要由Y群引起。19921995年4个主动监测区域,诊断为Y群脑膜炎球菌肺炎的病例数是其他血清群引起肺炎病例数的4倍[2]。2003年Vienne 等[9]综述了法国33例脑膜炎球菌肺炎病例,结果显示法国脑膜炎球菌肺炎发病主要是70岁以上人群,且优势血清群是W135群,占比为54.5%,而Y血清群菌株仅占16.7%。目前尚不清楚这些血清群菌株更容易引起肺炎的原因。上述研究均报道脑膜炎球菌肺炎患者伴有其他基础疾病,包括肿瘤,与本文报道的病例情况一致。目前,我国尚无相关数据可供参考,因此,应该尽快了解我国脑膜炎球菌肺炎流行病学及病原学特征,更好地服务于脑膜炎球菌病的预防和控制。
本文报道从1例肺炎患者支气管吸取物中分离到1株不可分群、对阿奇霉素、磺胺类和喹诺酮类药物耐受的脑膜炎奈瑟菌,是我国脑膜炎球菌肺炎的首次报道。提示在监测流脑的同时,也要关注其他侵袭性脑膜炎球菌病以及其他血清群和不可分群脑膜炎奈瑟菌株。
| [1] | Abio A, Neal KR, Beck CR. An epidemiological review of changes in meningococcal biology during the last 100 years[J]. Pathog Glob Health , 2013, 107 (7) : 373–380. DOI:10.1179/2047773213Y.0000000119 |
| [2] | Winstead JM, McKinsey DS, Tasker S, et al. Meningococcal pneumonia:characterization and review of cases seen over the past 25 years[J]. Clin Infect Dis , 2000, 30 (1) : 87–94. DOI:10.1086/313617 |
| [3] | Jafri RZ, Ali A, Messonnier NE, et al. Global epidemiology of invasive meningococcal disease[J]. Popul Health Metr , 2013, 11 (1) : 17. DOI:10.1186/1478-7954-11-17 |
| [4] | Romero-Gomez MP, Rentero Z, Paño JR, et al. Bacteraemic pneumonia caused by Neisseria meningitidis serogroup Y[J]. Respir Med Case Rep , 2012, 5 : 23–24. |
| [5] | Borba MGS, Oliveira MC, João GAP, et al. Invasive meningococcal disease with pericarditis and pneumonia:a rare presentation in childhood[J]. IDCases , 2016, 4 : 41–42. DOI:10.1016/j.idcr.2016.01.005 |
| [6] | WHO.Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis,Streptococcus pneumoniae,and Haemophilus influenzae[M].2nd ed.Geneva:WHO,2011:67. |
| [7] | Dolan-Livengood JM, Miller YK, Martin LE, et al. Genetic basis for nongroupable Neisseria meningitidis[J]. J Infect Dis , 2003, 187 (10) : 1616–1628. DOI:10.1086/jid.2003.187.issue-10 |
| [8] | Harrison LH, Shutt KA, Arnold KE, et al. Meningococcal carriage among Georgia and Maryland high school students[J]. J Infect Dis , 2015, 211 (11) : 1761–1768. DOI:10.1093/infdis/jiu679 |
| [9] | Vienne P, Ducos-Galand M, Gulyoule A, et al. The role of particular strains of Neisseria meningitidis in meningococcal arthritis,pericarditis,and pneumonia[J]. Clin Infect Dis , 2003, 37 (12) : 1639–1642. DOI:10.1086/379719 |
 2016, Vol. 31
2016, Vol. 31


