扩展功能
文章信息
- 汪慧, 王大虎, 陈纯, 张周斌, 李铁钢, 王鸣
- WANG Hui, WANG Da-hu, CHEN Chun, ZHANG Zhou-bin, LI Tie-gang, WANG Ming
- 广州市腹泻监测病例诺如病毒分子流行病学特征
- Molecular epidemiological characteristics of norovirus in diarrhea cases in Guangzhou
- 疾病监测, 2016, 31(10): 838-842
- Disease Surveillance, 2016, 31(10): 838-842
- 10.3784/j.issn.1003-9961.2016.10.009
-
文章历史
- 收稿日期:2016-04-30
诺如病毒是目前引起人类病毒性腹泻的重要病原体之一。根据基因特征可分为6个基因组(GⅠ~GⅥ),其中GⅠ和GⅡ是感染人类两个最主要的基因组[1]。由于该病毒传播途径广泛、传染性强,在全世界范围内广泛流行,已成为严重的公共卫生问题。本研究对2014-2015年广州市感染性腹泻医院哨点监测及暴发疫情数据进行分析,了解广州市诺如病毒分子流行病学状况,为开展诺如病毒疾病负担研究提供科学依据。
1 对象与方法 1.1 诺如病毒哨点监测 1.1.1 监测哨点设置根据广州市人口流动性及感染性腹泻发病情况,于2014-2015年选取广州市两家医院的4个科室(消化内科、肠道门诊、儿科和急诊科)作为感染性腹泻监测哨点。每家哨点医院每周采集≥5岁和 < 5岁腹泻病例粪便样本各3份,同时登记每例腹泻患者的姓名、性别和年龄等信息。腹泻病例定义:排便≥3次/24 h或以上且伴有性状改变(如稀水便、水样便等)者[2]。
1.1.2 标本采集与运送现场采集患者粪便,其中成型便3~5 g、水样便3~5 ml。所有标本-40 ℃冷冻保存,并于每月10日前送至广州市疾病预防控制中心进行诺如病毒核酸检测。其中的阳性标本进行核酸扩增后测序验证。
1.1.3 实验室检测(1)病毒RNA提取及核酸检测:选用QIAGEN Viral RNA Mini Kit试剂盒提取病毒核酸;使用达安生物科技有限公司的诺如病毒(GⅠ和GⅡ组)PCR核酸检测试剂盒,采用实时荧光聚合酶链反应(PCR)检测病毒核酸[3]。以上操作均按说明书进行。
(2)基因序列扩增和测定分析:荧光PCR检测诺如病毒阳性标本,采用引物CoG2F(CAR GAR BCN ATG TTY AGR TGG ATG AG)、G2-SKR(CCR CCN GCA TRH CCR TTR TAC AT)用于反转录和PCR。诺如病毒的PCR扩增产物为387 bp[4]。选用Invitrogen Super Script Ⅲ One-Step RT-PCR with Platinum Taq试剂盒进行基因扩增。反应体系及反应条件:2×Reaction Mix 25 μl,SS Ⅲ/Platinum Taq 2 μl,上下游引物(20 μmol/L)各1 μl,RNA 5 μl,加去离子水至50 μl。50 ℃反转录30 min,再94 ℃预变性2 min后,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,扩增30个循环,72 ℃延伸7 min[4]。测序由上海英潍捷基公司完成。核苷酸序列同源性分析用及进化树构建均使用Mega 5.0软件,Kimura双校正模型和邻接法(neighbor-joining,NJ),bootstrap值为1000。用于系统发生树分析的诺如病毒参考株均来自于GenBank数据库。
1.2 诺如病毒感染性腹泻暴发疫情监测广州市12个区通过中国传染病疫情和突发公共卫生事件网络直报系统,报告每起≥20例诺如病毒感染腹泻病例的疫情。其中疑似病例定义为24 h内出现排便≥3次且有性状改变(呈稀水样便),和/或24 h内出现呕吐。实验室诊断病例定义为疑似病例中,粪便、肛拭子或呕吐物标本经诺如病毒核酸检测阳性。收集信息包括疫情发生时间、病原体、发生场所及原因。
1.3 统计学分析使用SPSS 18.0软件进行数据整理和统计分析。以例数(百分比)的形式进行统计描述,χ2检验用于统计推断,P < 0.05为差异有统计学意义。
2 结果 2.1 门诊腹泻病例监测 2.1.1 诺如病毒检出情况2014-2015年两家哨点监测医院共收集合格标本732份,其中2014年540份,2015年192份。共检出阳性标本136份,阳性率为18.58%。其中2014年检出71份,阳性率为13.15%,2015年检出65份,阳性率为33.85%。
2.1.2 时间分布2014-2015年间各月均有诺如病毒检出,冬春季节检出率较高,其中2014年10月至2015年3月累计37份标本检出诺如病毒,占总阳性标本的27.21%,2015年10-12月共检出诺如病毒19份,占总阳性标本13.97%,见图 1。
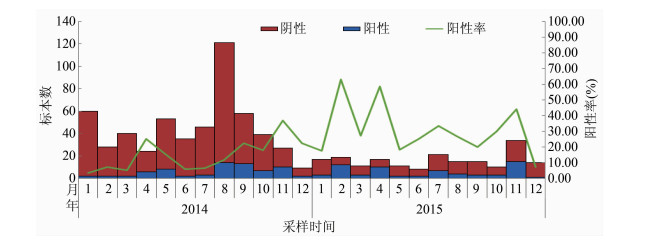
|
| 图 1 2014-2015年广州市诺如病毒检出情况按月时间分布 Figure 1 Monthly distribution of norovirus infection in Guangzhou, 2014-2015 |
| |
阳性率最高的年龄组为 < 5岁年龄组,阳性率为24.21%;其次为15~岁年龄组,阳性率为14.71%;最低为30~岁年龄组,阳性率为9.30%。各年龄组诺如病毒阳性率差异有统计学意义(χ2=20.39,P=0.001),详见表 1。
| 人口学特征 | 采样数 | 阳性数(%) | χ2值 | P值 |
| 年龄(岁) | 20.39 | 0.001 | ||
| <5 | 413 | 100(24.21) | ||
| 5~ | 30 | 4(13.33) | ||
| 15~ | 34 | 5(14.71) | ||
| 30~ | 43 | 4(9.30) | ||
| 45~ | 77 | 8(10.39) | ||
| ≥60 | 135 | 15(11.11) | ||
| 性别 | 1.44 | 0.23 | ||
| 男 | 479 | 95(19.83) | ||
| 女 | 253 | 41(16.21) |
732例腹泻病例中男性479人,检出诺如病毒阳性95份(19.83%);女性253人,检出诺如病毒阳性41份(16.21%),男女性别间差异无统计学意义(χ2=1.44,P=0.23),详见表 1。
2.1.4 基因型分布对136份阳性标本进行基因分型,其中GⅡ组133份,占97.79%;GⅠ组3份,占2.21%。对2014年(4株)及2015年(9株)GⅡ组阳性标本进一步测序发现,2014年3份毒株分型结果均为GⅡ.4 Sydney_2012变异株检出。2015年检出GⅡ.17变异株5株,GⅡ.4 Sydney变异株3株,1株GⅡ.3,详见表 2。
| 毒株 | 测序标本数 | 构成比(%) |
| 2014年(n=4) | ||
| GⅡ.4 Sydeny_2012 | 3 | 75.00 |
| GⅡ.17变异株 | 1 | 25.00 |
| 2015年(n=9) | ||
| GⅡ.17变异株 | 5 | 55.60 |
| GⅡ.4 Sydeny_2012 | 3 | 33.30 |
| GⅡ.3 | 1 | 11.10 |
对哨点医院院监测到的GⅡ.17变异株进行系统进化树分析,在GenBank数据库中选取32株参考株进行比较分析,广州市GⅡ.17变异株与KR270444/JSCZ/2015/CHN,KP998539/HKG/2014株的核苷酸100.00%同源,与KR154230/Hu/GⅡ.17/CUHK-NS-463,LCO37415/Hu/GⅡ.JP/2015株的核苷酸的同源性分别为99.60%和99.30%,详见图 2。
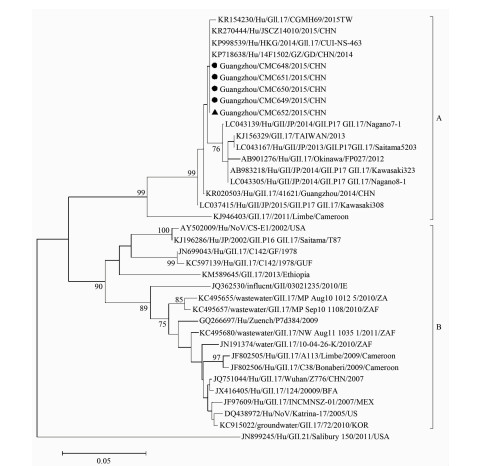
|
| 图 2 诺如病毒GⅡ.17变异株衣壳蛋白区部分核苷酸序列种系发生树 Figure 2 Phylogenetic tree of norovirus based on part of the capsid N terminus/shell gene 注:●为病例样本;▲为厨工样本。 |
| |
2014-2015年广州市共报告感染性暴发疫情23起,其中2014年报告6起,2015年报告17起。冬春季节(2014年11月至2015年3月)为诺如病毒感染性腹泻疫情流行高峰,期间共报告疫情12起,占2014-2015年累计报告疫情的52.17%;其中15起疫情分型结果显示,14起为GⅡ组,1起为GⅡ组和GⅠ组混合感染。发生在学校的疫情为20起,工厂2起,医院1起。食源性传播的疫情14起,接触传播疫情5起,传播途径不详4起,见图 3。
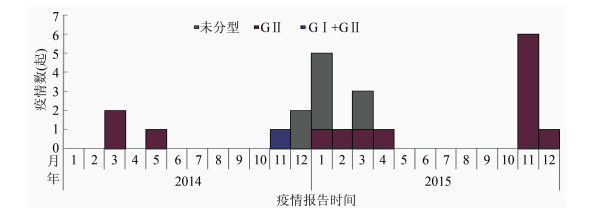
|
| 图 3 2014-2015年广州市诺如病毒感染性腹泻暴发疫情按月分布 Figure 3 Monthly distribution of norovirus outbreak in Guangzhou, 2014-2015 |
| |
诺如病毒不仅是造成病毒性胃肠炎暴发疫情最重要的病原体,也是导致成年人及儿童社区感染病例中最常见的病原体[5]。广州市哨点医院监测结果显示,腹泻病例中诺如病毒阳性率为18.58%,其中5岁以下儿童阳性率为24.21%,暴发疫情中发生在学校的疫情占86.96%,与既往研究结果一致[6-7]。姚玮蕾等[6]对上海地区5岁以下儿童腹泻病例研究显示,诺如病毒感染率为23.21%。深圳地区一项诺如病毒分子流行病学调查显示,全人群诺如病毒阳性率为23.45%,其中0~4岁组阳性率为25.07%,5岁以下阳性率显著高于其他年龄组[7]。目前有关年龄对诺如病毒易感性影响的结论尚不统一。部分研究显示低年龄组及高年龄组是感染诺如病毒的高危人群。但有学者认为年龄与诺如病毒易感性无关,肠黏膜上的组织血型抗原(histoblood group antigen,HBGA)是影响人体诺如病毒易感性的关键因素[8-9]。有关诺如病毒易感因素的问题仍有待进一步的研究。
既往分子流行病学研究发现诺如病毒GⅡ组是各基因组中引起暴发疫情和社区散发病例最常见的基因组。Xue等[10]开展一项为期2年针对门诊腹泻病例的监测结果显示,44 595名门诊病例中,22.91%为诺如病毒感染者,其中GⅡ组占85.16%。de Andrade等[11]对2004-2011年巴西南里奥格兰德州发生的112起诺如暴发疫情分析研究发现,110(98.20%)起疫情由GⅡ基因组所致。本次研究结果显示136份阳性标本中,97.79%为诺如病毒GⅡ组阳性,23起疫情中14(60.87%)起疫情由GⅡ组引起,与既往报道一致。
研究显示,广州地区诺如病毒感染性腹泻散发及暴发疫情流行期为每年10月至次年3月。但值得注意的是,不同地区时间分布仍存在差异。有研究报道欧洲和印度等地区夏季为诺如病毒流行的高峰[12-13]。国内一项针对4个城市(杭州、上海、天津及重庆)的诺如病毒分子流行病学研究显示,仅天津呈现出寒冷季节高发的趋势[3]。
基因测序结果显示,2014年广州市仍以GⅡ.4 Sydney变异株为优势流行株。诺如病毒可通过基因重组和突变等机制形成新的毒株[14-15]。其中GⅡ.4基因组每2~3年发生变异形成新毒株,新毒株的出现往往伴随全球的大流行。其中Sydney变异株于2013年1月登陆广州后迅速取代GⅡ.4 2006b成为广州地区成年人及儿童中优势的流行株[16]。但值得关注的是,2014年11月广州市通过暴发疫情首次监测到GⅡ.17变异株后,新毒株逐渐成为影响广州市诺如病毒流行的优势毒株。中国江苏省、美国及日本也先后在暴发疫情、社区感染散发病例及环境中检出诺如病毒GⅡ.17变异株[17-18]。系统发生树显示,GⅡ.17可分为2大群(A和B),广州市目前流行的GⅡ.17变异株属于群A,与2014-2015年间中国江苏、日本、中国台湾和中国香港等地区报道的毒株高度同源。
本研究存在不足:①粪便标本均来自两家哨点医院,部分腹泻症状较轻或以呕吐为主要临床表现的病例,存在不就诊或者未进入监测系统的情况,因而本研究中诺如病毒阳性率等数据可能低估其实际感染水平。②数据收集的时间段为2014-2015年,未对之前的GⅡ.4毒株的流行强度及特征进行分析比较。③诺如病毒检测阳性标本测序量较少,尚无法全面反映广州市流行毒株情况。但本研究首次对广州市诺如病毒流行状况进行评估,对今后的研究方向具有一定的提示及指导作用。
本研究通过2年连续的监测数据发现,广州市诺如病毒感染性腹泻流行株仍以GⅡ组为主,其中2014年优势毒株为GⅡ.4 Sydney_2012变异株,2015优势毒株为GⅡ.17变异株。诺如病毒虽属自限性疾病,但仍可导致儿童、老年人和免疫力低下患者死亡,因此开展诺如病毒连续监测,可以及时发现新的变异株,对于进一步认识诺如病毒,及时有效控制诺如病毒感染性腹泻疫情具有十分重要的意义。
作者贡献:汪慧:负责质量控制、论文撰写及数据分析
王大虎:负责数据收集整理工作
陈纯:负责数据收集整理工作
张周斌:负责现场协调沟通工作
李铁刚:负责研究设计、论文指导及修改工作
王鸣:负责研究设计、论文指导及修改工作
| [1] | Parra GI, Green KY. Genome of emerging norovirus GⅡ.17, United States, 2014[J]. Emerg Infect Dis , 2015, 21 (8) : 1477–1479. DOI:10.3201/eid2108.150652 |
| [2] | Liao QH, Ran L, Jin M, et al. Guidelines on outbreak investigation, prevention and control of norovirus infection (2015)[J]. Chinese Journal of Preventive Medicine , 2016, 50 (1) : 7–16. (in Chinese) 廖巧红, 冉陆, 靳淼, 等. 诺如病毒感染暴发调查和预防控制技术指南(2015版)[J]. 中华预防医学杂志 , 2016, 50 (1) : 7–16. |
| [3] | Zeng M, Xu XH, Zhu CM, et al. Clinical and molecular epidemiology of norovirus infection in childhood diarrhea in China[J]. J Med Virol , 2012, 84 (1) : 145–151. DOI:10.1002/jmv.v84.1 |
| [4] | Kojima S, Kageyama T, Fukushi S, et al. Genogroup-specific PCR primers for detection of Norwalk-like viruses[J]. J Virol Methods , 2002, 100 (1/2) : 107–114. |
| [5] | Glass RI, Parashar UD, Estes MK. Norovirus gastroenteritis[J]. N Engl J Med , 2009, 361 (18) : 1776–1785. DOI:10.1056/NEJMra0804575 |
| [6] | Yao WL, Cai JH, Wang XS, et al. Surveillance of norovirus-associated diarrhea in children in Shanghai, 2009-2011[J]. Chinese Journal of Pediatrics , 2014, 52 (5) : 339–344. (in Chinese) 姚玮蕾, 蔡洁皓, 王相诗, 等. 上海地区2009-2011年儿童诺如病毒腹泻病的监测研究[J]. 中华儿科杂志 , 2014, 52 (5) : 339–344. |
| [7] | Zhang HL, Li Y, Yao XJ, et al. The molecular characteristics of norovirus gastroenteritis in Baoan district, Shenzhen, 2010-2011[J]. International Journal of Virology , 2013, 20 (3) : 118–122. (in Chinese) 张海龙, 李苑, 姚相杰, 等. 2010-2011年深圳市宝安区诺如病毒的分子特征分析[J]. 国际病毒学杂志 , 2013, 20 (3) : 118–122. |
| [8] | Sang SW, Zhao ZT, Suo JJ, et al. Study on the molecular epidemiological characteristics of norovirus in acute gastroenteritis of Beijing[J]. Chinese Journal of Epidemiology , 2013, 34 (3) : 263–266. (in Chinese) 桑少伟, 赵仲堂, 索继江, 等. 北京地区急性胃肠炎患者诺如病毒分子流行病学调查[J]. 中华流行病学杂志 , 2013, 34 (3) : 263–266. |
| [9] | Zhang XF, Huang Q, Long Y, et al. An outbreak caused by GⅡ.17 norovirus with a wide spectrum of HBGA-associated susceptibility[J]. Sci Rep , 2015, 5 : 17687. DOI:10.1038/srep17687 |
| [10] | Xue Y, Pan H, Hu JY, et al. Epidemiology of norovirus infections among diarrhea outpatients in a diarrhea surveillance system in Shanghai, China:a cross-sectional study[J]. BMC Infect Dis , 2015, 15 : 183. DOI:10.1186/s12879-015-0922-z |
| [11] | de Andrade JDSR, Rocha MS, Carvalho Costa FA, et al. Noroviruses associated with outbreaks of acute gastroenteritis in the State of Rio Grande do Sul, Brazil, 2004-2011[J]. J Clin Virol , 2014, 61 (3) : 345–352. DOI:10.1016/j.jcv.2014.08.024 |
| [12] | Chhabra P, Dhongade RK, Kalrao VR, et al. Epidemiological, clinical, and molecular features of norovirus infections in western India[J]. J Med Virol , 2009, 81 (5) : 922–932. DOI:10.1002/jmv.v81:5 |
| [13] | Kroneman A, Vennema H, Harris J, et al. Increase in norovirus activity reported in Europe[J]. Euro Surveill , 2006, 11 (12) : E061214.1. |
| [14] | Bull RA, Tanaka MM, White PA. Norovirus recombination[J]. J Gen Virol , 2007, 88 (Pt 12) : 3347–3359. |
| [15] | Siebenga JJ, Lemey P, Pond SLK, et al. Phylodynamic reconstruction reveals norovirus GⅡ.4 epidemic expansions and their molecular determinants[J]. PLoS Pathog , 2010, 6 (5) : e1000884. DOI:10.1371/journal.ppat.1000884 |
| [16] | Cai WF, Xie HP, Liu YF, et al. An epidemiological investigation on a food-born outbreak of noroviru caused by Sydney 2012 GⅡ.4 strain[J]. Chinese Journal of Epidemiology , 2013, 34 (8) : 804–807. (in Chinese) 蔡文锋, 谢华萍, 刘于飞, 等. 一起食源性诺如病毒GⅡ.4/Sydney_2012变异株感染暴发的调查[J]. 中华流行病学杂志 , 2013, 34 (8) : 804–807. |
| [17] | Fu J, Ai J, Jin M, et al. Emergence of a new GⅡ.17 norovirus variant in patients with acute gastroenteritis in Jiangsu, China, September 2014 to March 2015[J]. Euro Surveill , 2015, 20 (24) : 21157. DOI:10.2807/1560-7917.ES2015.20.24.21157 |
| [18] | Matsushima Y, Ishikawa M, Shimizu T, et al. Genetic analyses of GⅡ.17 norovirus strains in diarrheal disease outbreaks from December 2014 to March 2015 in Japan reveal a novel polymerase sequence and amino acid substitutions in the capsid region[J]. Euro Surveill , 2015, 20 (26) : 21173. DOI:10.2807/1560-7917.ES2015.20.26.21173 |
 2016, Vol. 31
2016, Vol. 31


