扩展功能
文章信息
- 石伟先, 张靖, 孙瑛, 刘医萌, 潘阳, 赵佳琛, 张代涛, 崔淑娟, 彭晓旻, 卢桂兰, 陈丽娟, 王全意, 杨鹏
- SHI Wei-xian, ZHANG Jing, SUN Ying, LIU Yi-meng, PAN Yang, ZHAO Jia-chen, ZHANG Dai-tao, CUI Shu-juan, PENG Xiao-min, LU Gui-lan, CHEN Li-juan, WANG Quan-yi, YANG Peng
- 一种快速核酸提取试剂在流感病毒检测中的应用评价
- Application of a rapid nucleic acid extraction kit in detection of influenza virus nucleic acid
- 疾病监测, 2016, 31(11): 915-919
- Disease Surveillance, 2016, 31(11): 915-919
- 10.3784/j.issn.1003-9961.2016.11.007
-
文章历史
- 收稿日期:2016-05-19
2. 中国疾病预防控制中心病毒病预防控制所, 北京 102206
2. National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
流行性感冒(流感)病毒是一种负链RNA病毒,具有易变性,其导致的流感传播快,发病急,易引起暴发流行。快速、准确获得病原学结果并对病毒变异、耐药情况等进行监测是流感防控和临床治疗的关键[1-4]。因此,核酸检测和基因特性分析等分子生物学检测技术在流感病毒监测中应用极其广泛。核酸提取作为分子生物学检测的首要步骤,提取质量、效率及简便性等常为实验人员考量的要素。本研究通过对一种快速核酸提取试剂在流感病毒检测中的应用开展评价,旨在探讨该法适用性及有效性。
1 材料与方法 1.1 样本来源MDCK细胞株A/北京朝阳/1211/2015(H3)、B/北京朝阳/1287/2015(乙型Yamagata系)、鸡胚分离株A/北京西城/SWL1642/2014(H1)为本室留存,其血凝滴度分别为1∶8、1∶16和1∶8,毒株均经PBS 10倍倍比稀释,获得不同浓度的流感病毒;同时选取2015年北京市流感病原学监测阳性咽拭子67份。所有毒株及样本均分装后于-80 ℃冻存。
1.2 核酸提取分别使用QIAmp viral RNA mini kit试剂盒(QIAGEN公司)、MOKOGENETM拭子病毒RNA快速提取试剂盒(南京美宁康诚生物有限公司)。提取方法按试剂盒说明书进行,QIAGEN离心柱法加入样本140 μl,洗脱液使用140 μl。快速提取法使用样本50μl,加入5 μl FastLyse L4,振荡混匀,95 ℃ 2 min,12 000 r/min离心2 min,吸上清用于实时荧光RT-PCR检测。提取的核酸即时检测后于-80 ℃保存。
1.3 定量标准品的制备提取毒株A/北京西城/157/2011(H3)(本实验室分离留存)RNA,使用QIAGEN OneStep RT-PCR kit(QIAGEN公司),用甲型流感病毒基质蛋白(influenza A matrix protein,Am)基因特异性引物进行PCR反应。反应体系配制参照试剂盒说明书,反应程序为50 ℃ 30 min,95 ℃ 15 min,(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s)共40个循环,72 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳后,Am基因片段经QIAGEN Gel extraction kit(QIAGEN公司)纯化回收后连接于pMD18-T质粒载体(Promega公司产),经转化、增菌后提取重组质粒,经PCR及测序,鉴定重组质粒中目标片段为正确的Am基因片段。依照公式拷贝数=(质量÷分子量)×6.02×1023,由纯化后的重组质粒质量浓度(g/μl)换算为拷贝浓度(拷贝/μl)后,稀释制备100~106 拷贝/ml,7个浓度梯度定量标准品。
1.4 实时荧光RT-PCR检测Am基因和乙型流感病毒非结构蛋白NS(influenza B non structure protein)基因的引物、探针序列参考国家流感中心下发全国流感监测方案(2010年版)附件《流感监测实验技术操作规范》,由上海生工生物工程有限公司合成。按照Ag-path ID one-step RT-PCR kit(Life Technologies公司)试剂盒说明书配制反应体系,反应程序为45 ℃ 10 min,95 ℃ 10 min,(95 ℃ 15 s,60 ℃ 45 s)共45个循环,60 ℃ 45 s阶段收集荧光信号,通过使用Am基因的定量标准品获得检测样本拷贝数(拷贝/ml),所有检测重复3次,取其平均值作为最终检测结果。
1.5 统计分析采用Excel 2003软件建立数据库,应用SPSS 19.0统计软件进行分析。对两种方法提取不同类型样本中病毒RNA扩增后靶基因拷贝数结果比较及-80 ℃保存对核酸的影响结果的比较采用配对t检验,变异系数的比较采用u检验,P<0.05为差异有统计学意义。
2 结果 2.1 不同类型样本的检测灵敏度对不同类型样本10倍系列稀释物提取核酸后的定性检测结果显示,细胞株A/北京朝阳/1211/2015(H3)、B/北京朝阳/1287/2015(乙型Yamagata系),鸡胚分离株A/北京西城/SWL1642/2014(H1),快速提取法提取核酸的最低检测限均高于离心柱法10倍,咽拭子样本快速提取法的最低检测限高于离心柱法100倍,详见表 1。
| 样本类型提取方法 | 细胞培养液1(1) | 细胞培养液2(2) | 鸡胚分离液 | 咽拭子 | ||||
| M(3) | Q(4) | M | Q | M | Q | M | Q | |
| 最低检测限(5) | 10-11 | 10-12 | 10-10 | 10-11 | 10-6 | 10-7 | 10-3 | 10-5 |
| 最低检测限的定量检测结果(拷贝/ml) | 1.16 | 1.61 | 1.15 | 0.73 | 1.38 | 1.15 | 0.95 | 1.22 |
| 注:(1) 细胞培养液1:毒株A/北京朝阳/1211/2015(H3)细胞培养液;(2) 细胞培养液2:毒株B/北京朝阳/1287/2015(乙型Yamagata系)细胞培养液;(3) M: MOKOGENE快速提取法;(4) Q:QIAGEN 离心柱法;(5) :可检测到的最高稀释倍数。 | ||||||||
定量检测结果以拷贝/ml为单位,取其3次平行检测的对数平均值,作为该方法检测该稀释度样本的结果,分析显示,对不同类型不同稀释度样本,快速提取法提取核酸后检测到的病毒载量均低于离心柱法。计算两种方法定量检测结果所得的log(拷贝/ml)值之差,结果显示,细胞株A/北京朝阳/1211/2015(H3)差值的中位数为1.04 (0.59~1.40),细胞株B/北京朝阳/1287/2015(乙型Yamagata系)差值的中位数为0.945(0.57~1.54),鸡胚分离株A/北京西城/SWL1642/2014(H1)差值的中位数为0.96(0.71~1.21),咽拭子差值的中位数最高,为1.90(1.01~2.36)。使用配对t检验对两种提取方法检测不同类型样本的定量检测结果进行统计学检验,结果显示快速提取法与离心柱提取法相比,快速提取法提取的核酸量低于离心柱法,具有统计学意义(t=15.20,P=0.000),其中以对咽拭子样本的提取量差异最大。见图 1。
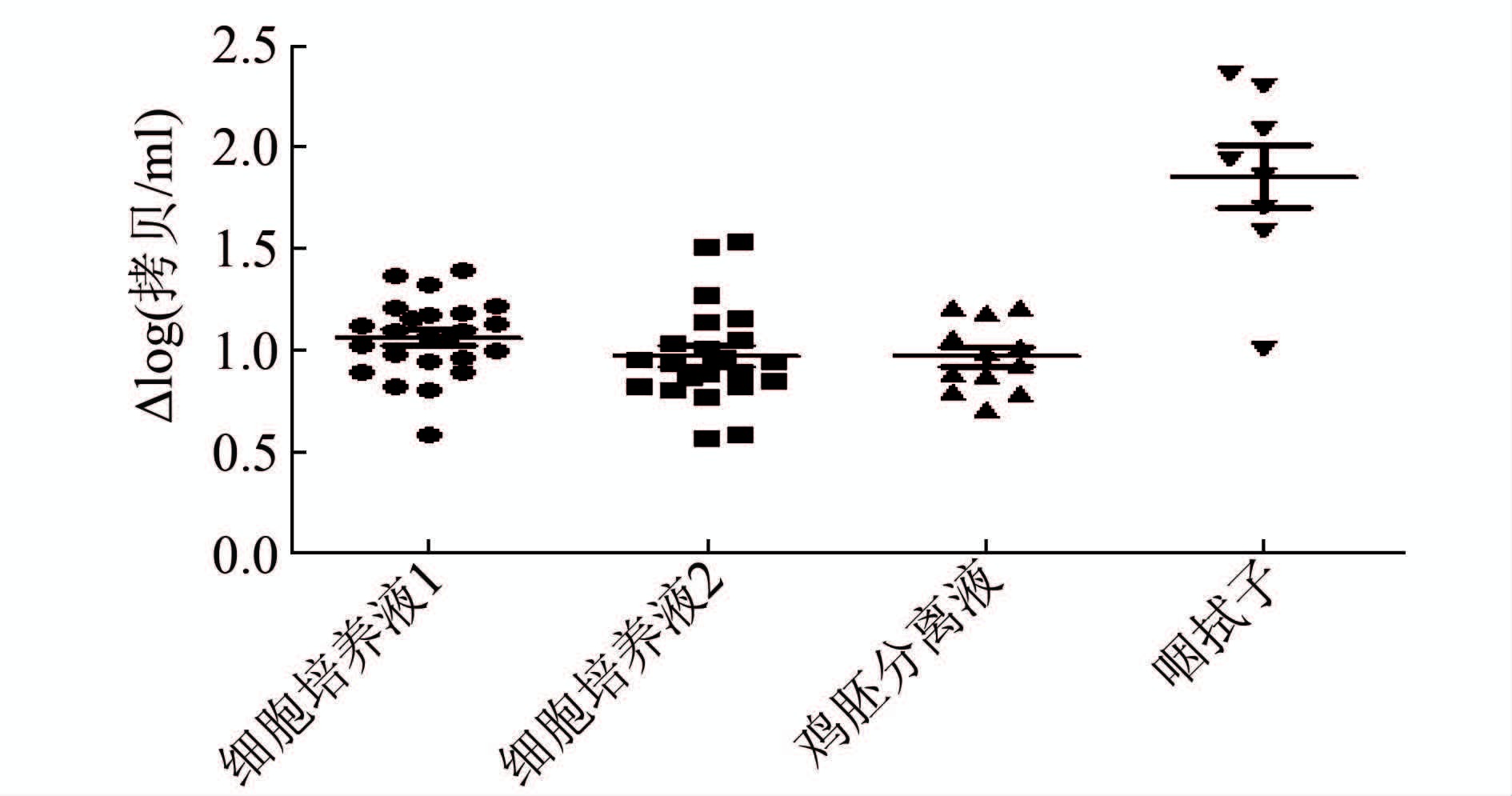
|
| 图 1 快速提取法与离心柱法对不同类型样本检测结果的差异比较 Figure 1 Difference in detection of different samples between rapid extraction and spin column extraction 注:Δlog(拷贝/ml)=快速提取法3次平行检测样本中拷贝/ml的对数平均值-离心柱法3次平行检测样本中拷贝/ml的对数平均值;细胞培养液1:毒株A/北京朝阳/1211/2015(H3)细胞培养液;细胞培养液2:毒株B/北京朝阳/1287/2015(乙型Yamagata系)细胞培养液。 |
| |
选取细胞株A/北京朝阳/1211/2015(H3)培养液,分别稀释10倍、103倍及105倍作为高浓度、中浓度及低浓度样本,使用快速提取法及离心柱法对每样本均进行6次平行核酸提取及扩增检测,依据其定量结果对数值,计算不同方法的变异系数(coefficient of variation,CV)值,结果可见,两种方法CV均随样本稀释倍数的增加而增加,快速提取法的CV均小于离心柱法,见表 2。
| 病毒稀释倍数 | 提取有效次数 | 快速提取法(1) | 离心柱法(1) | 统计检验 | ||||
| x | s | CV(%) | x | s | CV(%) | |||
| 10 | 6 | 5.21 | 0.04 | 0.77 | 6.35 | 0.19 | 2.99 | u=0.509,P<0.05 |
| 103 | 6 | 3.30 | 0.11 | 3.33 | 4.48 | 0.35 | 7.81 | u=0.180,P<0.05 |
| 105 | 6 | 1.12 | 0.09 | 8.04 | 2.04 | 0.31 | 15.20 | u=0.070,P<0.05 |
| 注:(1) 以定量检测结果的对数值log(拷贝/ml)计算。 | ||||||||
对细胞株A/北京朝阳/1211/2015(H3)10~1013倍系列稀释后分别使用快速提取法及离心柱法提取核酸,比较提取后立即检测及提取后-80 ℃保存10 d后复测的病毒载量,结果可见两种方法-80 ℃保存后再次检测时,较立即检测所得病毒载量均有所损失,离心柱法最低检测限由10-13升至10-11,快速提取法最低检测限由10-11升至10-6。对3次平行检测的对数平均值进行分析,结果显示,快速提取法核酸损失为29.84%~97.85%,中位值为86.91%,离心柱法核酸损失量则仅为1.92%~54.15%,中位值为7.56%,快速提取法核酸损失量是离心柱法的1.5~92倍,明显大于离心柱法;且呈样本中病毒载量越低,冻融后核酸损失越大的趋势。经配对t检验,差异有统计学意义(t=-4.13,P=0.002)。见图 2。

|
| 图 2 不同浓度样本使用不同提取方法提取的核酸-80 ℃存放10 d后的影响 Figure 2 Effects of different isolation methods for different concentrations samples on RNA storage at -80 ℃ for 10 days |
| |
依据离心柱法对67份咽拭子样本的定量检测结果将样本分为不同病毒载量组,使用快速提取法提取核酸,实时荧光RT-PCR进行定性检测,结果见表 3。表明使用实时荧光RT-PCR进行定性检测咽拭子中病毒核酸时,快速提取法与离心柱法相比,阳性符合率随样本中病毒量增加而升高。当咽拭子样本中病毒量>103拷贝/ml时,阳性符合率达100%。
| 离心柱法检测(拷贝/ml) | 快速提取法 | 离心柱法 | ||
| 阳性数 | 阳性率(%) | 阳性数 | 阳性率(%) | |
| 10~102 | 10 | 76.92 | 13 | 100.00 |
| 102~103 | 25 | 92.59 | 27 | 100.00 |
| >103 | 27 | 100.00 | 27 | 100.00 |
| 合计 | 62 | 92.54 | 67 | 100.00 |
病毒的核酸提取方法目前主要为离心柱法及磁珠法[5-8],其主要操作步骤均为三步:首先利用裂解液促使细胞破碎,使细胞中的核酸释放出来,然后将释放的核酸特异地吸附在特定的载体上,最后将吸附在特定载体上的核酸洗脱下来,得到纯化的核酸。离心柱法采用特殊的硅基质吸附材料吸附核酸,具有核酸纯度高、易于标准化操作、单份样本可在20 min内完成的优势,但同时存在耗费样品量较多、操作中需要反复离心,不便于高通量操作等缺陷。磁珠法则利用表面连接了可特异地可逆吸附核酸的功能基团的复合磁性微球,并利用磁珠自身的磁性,在外加磁场的作用下实现定向移动与富集来实现核酸的分离纯化,具有操作简便,高通量和自动化优势,96份样本的核酸提取在40 min内即可完成,且有研究表明其灵敏度与离心柱法相当[9]。本研究探讨的快速提取试剂采用方法的主要操作步骤仅为裂解,即通过裂解液中的去污剂破坏病毒外壳,释放病毒核酸,并通过95 ℃加热来加速裂解过程,高效释放核酸,同时裂解液中加入核酸稳定剂,防止病毒RNA在高温和蛋白质存在的环境下被降解,从而达到提取和保存核酸的作用。全部操作仅为95 ℃加热2 min及离心2 min两个步骤,全程无需开盖,最大限度地避免了因开关样本管盖而导致交叉污染的可能,同时该方法直接裂解样本,更适用于珍贵样本的核酸提取,因此该方法具有更加简单快速、安全可靠、成本更低、效率更高的优势。与以QIAGEN公司的QIAmp viral RNA mini kit试剂盒为代表的离心柱法相比,快速提取试剂的灵敏度逊于离心柱法。对于细胞培养液、鸡胚培养液等含有纯度较高的病毒RNA样本,快速提取法检测到的病毒载量低于离心柱法10倍,而对病毒量较少的咽拭子样本,则低100倍。对于病毒载量较高的咽拭子样本,快速提取法与离心柱法虽存在定量检测差异,但定性检测结果则完全一致。当样本中病毒含量较少时,快速提取法提取的核酸会出现实时荧光PCR检测假阴性结果,这在对临床样本的检测中也得到了进一步验证。考虑其原因可能是由于快速提取法没有对样本中干扰核酸扩增检测的抑制物如脂类、蛋白等成分进行有效去除而导致。但该方法仍然不失为检测样本量大、人手不足、设备欠缺的基层实验室的一种技术选择。
对提取的核酸经-80 ℃保存10 d后复测,结果显示快速提取试剂提取的核酸最低检测限较之提取后立即检测提高了105倍,而离心柱法仅提高了102倍,其原因可能在于快速提取法提取的核酸纯度不佳,经反复冻融后,核酸降解严重所导致,因此使用快速提取法提取核酸时,及时使用效果最佳。
CV值是考查检测方法的重复性指标,本研究结果表明,当样本中病毒载量较低时,快速提取法与离心柱法提取病毒核酸的重复性均较病毒载量高时差,但快速提取法在方法的重复性上具有明显优势,表明快速提取法稳定性优于离心柱法,这可能与其操作步骤少,无需换管有关。
综上所述,快速提取试剂对含有大量分离培养后的流感病毒RNA的提取上具有较大优势,可用于流感毒株基因特性分析中的核酸提取。在应对检测流感病毒导致的暴发疫情所采集的咽拭子样本时,快速提取法具有操作简便、快速的绝对优势,但同时会有漏检风险存在,需评估后使用。
作者贡献:
石伟先:实验设计与实施,数据整理及论文撰写
张靖:文献检索与实验实施
孙瑛:数据整理与统计分析
刘医萌、潘阳、赵佳琛:实验操作
张代涛:试剂耗材订购
崔淑娟:数据库建立
彭晓旻:实验室质量控制
卢桂兰:实验操作质量控制
陈丽娟:结果分析
王全意、杨鹏:实验设计与指导
| [1] | Duan W, Sun Y, Yang P, et al. Analysis on the influenza surveillance in Beijing during 2012-2015[J]. Capital Journal of Public Health , 2016, 10 (2) : 54–57. (in Chinese) 段玮, 孙瑛, 杨鹏, 等. 2012-2015年北京市流感监测分析[J]. 首都公共卫生 , 2016, 10 (2) : 54–57. |
| [2] | Wu CL, Yang F, Huang DN. Phyletic evolution and molecular variation of pandemic influenza A(H1N1)2009 virus in Shenzhen from 2009 to 2014[J]. International Journal of Virology , 2015, 22 (6) : 389–393. (in Chinese) 吴春利, 阳帆, 黄达娜. 2009-2014年深圳市甲型H1N1流感病毒系统进化及分子变异研究[J]. 国际病毒学杂志 , 2015, 22 (6) : 389–393. |
| [3] | Jing HB, Zhang S, Wang P, et al. Epidemiological analysis of nine respiratory viruses among respiratory infections in Shunyi district, Beijing[J]. International Journal of Virology , 2015, 22 (4) : 240–244. (in Chinese) 荆红波, 张爽, 王鹏, 等. 九种呼吸道病毒在北京市顺义地区人群中的流行特征分析[J]. 国际病毒学杂志 , 2015, 22 (4) : 240–244. |
| [4] | Li Y, Han GY, Liu YF, et al. Epidemiological characteristics of influenza outbreaks in Hebei province during 2012-2014[J]. International Journal of Virology , 2016, 23 (1) : 4–7. (in Chinese) 李岩, 韩光跃, 刘艳芳, 等. 2012-2014年河北省流感暴发疫情流行病学特征分析[J]. 国际病毒学杂志 , 2016, 23 (1) : 4–7. |
| [5] | Zhao D, Chai Q, Yu P, et al. Phylogenetic analysis of influenza A (H3N2)virus in Qingdao from 2011 to 2014[J]. International Journal of Virology , 2015, 22 (2) : 99–105. (in Chinese) 赵丹, 柴青, 于萍, 等. 2011-2014年青岛地区甲型H3N2流感病毒基因进化分析[J]. 国际病毒学杂志 , 2015, 22 (2) : 99–105. |
| [6] | Wang M, Ma XJ. The research progress of nucleic acid extraction method[J]. Chinese Journal of Experimental and Clinical Virology , 2014, 28 (6) : 503–505. (in Chinese) 王淼, 马学军. 核酸提取方法的研究进展[J]. 中华实验和临床病毒学杂志 , 2014, 28 (6) : 503–505. |
| [7] | Gong LM, Ge Q, Lu YY, et al. Comparison of four RNA extraction methods for detection of influenza viruses nucleic acids[J]. Chinese Journal of Health Laboratory Technology , 2007, 17 (1) : 53–54,90. (in Chinese) 龚黎明, 葛琼, 卢亦愚, 等. 4种核酸提取方法在流行性感冒病毒核酸检测中的比较[J]. 中国卫生检验杂志 , 2007, 17 (1) : 53–54,90. |
| [8] | Wang P, Jing HB, Zhang YC, et al. Analysis on the influenza surveillance data in Shunyi, Beijing from 2012 to 2015[J]. International Journal of Virology , 2016, 23 (2) : 114–116. (in Chinese) 王鹏, 荆红波, 张彦春, 等. 2012-2015年北京市顺义区流感监测结果分析[J]. 国际病毒学杂志 , 2016, 23 (2) : 114–116. |
| [9] | Yan Y, Tian KC, Zhuang L, et al. Comparison the influence of different nucleic acid extraction methods through magnetic beads and filter membranes by using quantitative fluorescence-PCR on Hand-foot-and-mouth disease detection[J]. Guizhou Medical Journal , 2012, 36 (5) : 402–404. (in Chinese) 阎岩, 田克诚, 庄丽, 等. 磁珠法和滤膜法提取核酸在手足口病荧光定量检测中的比较[J]. 贵州医药 , 2012, 36 (5) : 402–404. |
 2016, Vol. 31
2016, Vol. 31


