扩展功能
文章信息
- 沈月华, 纪蕾, 陈莉萍, 朱晓娟, 查赟峰, 徐德顺, 吴晓芳
- SHEN Yue-hua, JI Lei, CHEN Li-ping, ZHU Xiao-juan, ZHA Yun-feng, XU De-shun, WU Xiao-fang
- 2014年浙江省湖州市急性腹泻患者诺如病毒感染及基因特征研究
- Infection status and genetic diversity of noroviruses in patients with acute gastroenteritis in Huzhou, Zhejiang, 2014
- 疾病监测, 2016, 31(11): 941-944
- Disease Surveillance, 2016, 31(11): 941-944
- 10.3784/j.issn.1003-9961.2016.11.012
-
文章历史
- 收稿日期:2016-01-29
诺如病毒(Norovirus,NV)1968年在美国一起腹泻暴发标本中被确认,是引起儿童及成年人急性胃肠炎的主要病原,在世界范围内所引起的急性胃肠炎占所有病例的50%[1]。诺如病毒感染性腹泻以起病急、传播快、暴发多、呕吐多见为特征,病死率不高,但发病率高,在全球感染性疾病中位居第3位。为进一步了解诺如病毒感染情况,本研究对2014年急性腹泻患者诺如病毒感染状况及基因特征进行分析,现将结果报告如下。
1 材料与方法 1.1 标本来源浙江省湖州市综合性三级乙等和二级甲等各一家医院的急性腹泻患者粪便标本。患者以腹泻症状为主诉,每日排便3 次以上,且粪便性状改变(有稀便、水样便、黏液便或脓血便) ,可伴有恶心、呕吐、食欲不振、发热、腹痛及全身不适等情况的门诊就诊患者,将患者的新鲜粪便或肛拭子样本置于无菌容器内,送实验室检测。
1.2 标本运送标本采集后在4~8℃条件保存,不能及时检测的标本放-80 ℃保存。
1.3 方法 1.3.1 主要试剂和仪器ABI7500实时荧光RT-PCR仪,RNA 提取试剂:RNeasy Mini Kit为德国Qiagen公司产品,TaKaRa One Step RNA PCR Kit 为宝生物工程(大连)有限公司产品。引物和探针均委托宝生物工程(大连)有限公司合成。
1.3.2 诺如病毒核酸RT-PCR检测 取处理后粪便标本200 μl,采用德国 Qiagen 公司 Rneasy Mini Kit 中的Rneasy Mini Kit Handbook 所提供的方法提取病毒 RNA,利用荧光定量反转录聚合酶链反应(RT-PCR)方法对粪便标本进行GⅠ型和GⅡ型诺如病毒核酸检测,RT-PCR体系参照TaKaRa公司One Step RT-PCR Kit试剂盒说明书,试剂盒均在有效期内使用,诺如病毒核酸扩增条件为42 ℃反转录30 min; 95 ℃预变性2 min; 95 ℃ 5 s、55 ℃ 35 s、读板,共40 个循环,引物及TaqMan 探针的序列见文献[2]。
1.3.3 诺如病毒基因分型选取诺如病毒核酸检测阳性的标本进行病毒部分衣壳蛋白区的序列扩增和测定。参照文献选取引物G1SKF/G1SKR和G2SKF/G2SKR分别用来扩增GⅠ型和GⅡ型诺如病毒部分衣壳蛋白,阳性产物大小分别为330 bp 和 344 bp[3]。试剂采用TaKaRa公司One Step RNA PCR Kit(货号DRR024A),反应条件为:42 ℃反转录30 min;94 ℃预变性2 min; 94 ℃ 30 s、51 ℃ 30 s、72 ℃ 1 min,循环35次;72 ℃延伸10 min。将有阳性条带的PCR扩增产物送宝生物工程(大连)有限公司测序。应用Clustal W 2.0软件对测序结果和诺如病毒各型别参考序列进行多序列比对和分析,使用Mega 4.0软件绘制系统进化树,以明确诺如病毒的基因型别。
2 结果 2.1 诺如病毒核酸检测采集急性腹泻的粪便标本797份。检出诺如病毒149份,阳性率18.7%,其中GⅠ型16份,阳性率2.0%,GⅡ型133份,阳性率16.7%,以GⅡ基因型为主,占89.26%(133/149)。夏季感染率较低,秋冬季较高,见表 1。
| 月份 | 检测数 | 诺如病毒核酸阳性 | |||||
| GⅠ+GⅡ | 阳性率(%) | GⅠ型 | 阳性率(%) | GⅡ型 | 阳性率(%) | ||
| 1 | 82 | 14 | 17.1 | 0 | 0.0 | 14 | 17.1 |
| 2 | 83 | 23 | 27.7 | 4 | 4.8 | 19 | 22.9 |
| 3 | 32 | 8 | 25.0 | 1 | 3.1 | 7 | 21.9 |
| 4 | 56 | 9 | 16.1 | 4 | 7.1 | 5 | 9.0 |
| 5 | 67 | 7 | 10.4 | 5 | 7.5 | 2 | 3.0 |
| 6 | 65 | 6 | 9.2 | 2 | 3.1 | 4 | 6.2 |
| 7 | 73 | 3 | 4.1 | 0 | 0.0 | 3 | 4.1 |
| 8 | 80 | 6 | 7.5 | 0 | 0.0 | 6 | 7.5 |
| 9 | 85 | 11 | 12.9 | 0 | 0.0 | 11 | 12.9 |
| 10 | 59 | 14 | 23.7 | 0 | 0.0 | 14 | 23.7 |
| 11 | 40 | 13 | 32.5 | 0 | 0.0 | 13 | 32.5 |
| 12 | 75 | 35 | 46.7 | 0 | 0.0 | 35 | 46.7 |
| 合计 | 797 | 149 | 18.7 | 16 | 2.0 | 133 | 16.7 |
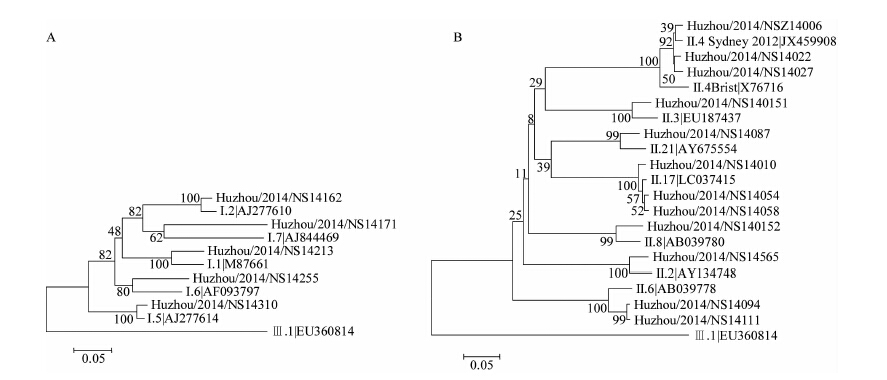
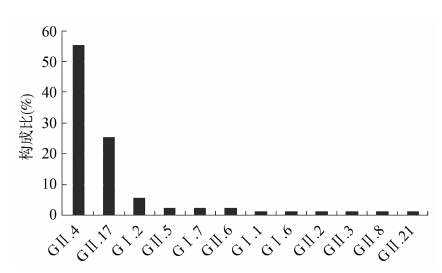
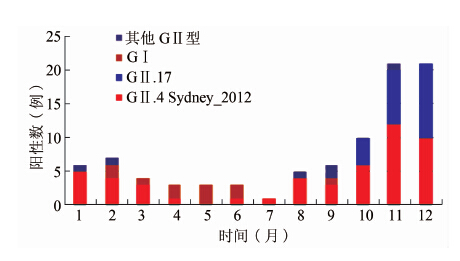
149份诺如病毒核酸阳性的标本中90份完成序列测定,衣壳蛋白区的系统进化分析显示共有12个基因亚型。 GⅠ型有5个亚型,分别为GⅠ.1、GⅠ.2、GⅠ.5、GⅠ.6和GⅠ.7;GⅡ型有7个亚型,分别为GⅡ.2、GⅡ.3、GⅡ.4、GⅡ.6 、GⅡ.8、GⅡ.17和GⅡ.21,见图 1。GⅡ.4 Sydney_2012检出最多,占55.5%(50/90),其次为 GⅡ.17(25.5%,23/90),见图 2。各基因型别的时间分布表明GⅡ.4 Sydney_2012是2014年急性腹泻病例中流行的主要基因型别,除5月外均有检出,而GⅡ.17型诺如病毒主要在10月以后检出,见图 3。
|
| 图 1 GⅠ型(A)和GⅡ型(B)诺如病毒衣壳蛋白区序列的系统进化分析 Figure 1 Phylogenetic analysis on partial capsid gene sequences of norovirus GⅠ (A) and norovirus GⅡ (B) |
| |
|
| 图 2 诺如病毒GⅠ型和GⅡ型亚型分布情况 Figure 2 Sub genotype distribution of norovirus GⅠ and GⅡ |
| |
|
| 图 3 2014年浙江省湖州市各基因型别诺如病毒的时间分布 Figure 3 Monthly detection of different sub genotype norovirus in Huzhou,2014 |
| |
诺如病毒属于杯状病毒科,为单股正链核糖核酸病毒,基因组全长7400~7700 个核苷酸,包括3 个开放读码框(ORF)。ORF1 编码具有RNA多聚酶性质的非结构蛋白前体,ORF2 和ORF3 分别编码主要衣壳蛋白VP1 和次要衣壳蛋白VP2[4]。根据其RNA 聚合酶和衣壳蛋白编码区的核苷酸序列,可分为5 个遗传组(GⅠ、GⅡ、GⅢ、GⅣ、GⅤ)其中GⅠ和GⅡ是感染人的主要遗传组,每个遗传组又可进一步分为若干个基因型[5]。虽然诺如病毒分类复杂,但是在引起胃肠炎暴发和散发的诺如病毒 中,GⅡ一直处于优势地位,其中GⅡ.4 型更是全球诺如病毒流行的优势株。
诺如病毒是本地区急性腹泻病的重要病原体,检测阳性率为18.7%。其中GⅡ型阳性率为16.7%,远高于GⅠ型(2.0%),与国内外流行趋势基本一致[6-8]。诺如病毒全年均有流行,秋冬季检出率较高(>20%),呈现高流行;夏季尤其是68月检出率较低(<10%),呈现低流行。进一步的序列分析表明本地区急性腹泻病例中检出的诺如病毒基因型别共12种。GⅡ.4型为主要基因型,占50.5%,基本全年均有检出。
近20年来,大部分的诺如病毒胃肠炎暴发和流行都与出现新的GⅡ.4变异株有关[9-10]。自1995年以来,新GⅡ.4变异株的出现已经引起6次全球范围诺如病毒胃肠炎的流行,包括近年来出现的 Sydney_2012 变异株。Sydney_2012 变异株最早于2012年3月在澳大利亚检出,随后全球范围内出现了由变异株引起的诺如病毒胃肠炎暴发疫情和散发病例的增加,Sydney_2012 变异株进而成为新的流行优势型别[11]。本地区2014年检出的GⅡ.4型诺如病毒衣壳蛋白区的核苷酸序列与Sydney_2012 变异株(Sydney/NSW0514/2012/AU)的同源性高达99.0%~99.5%,系统进化树上聚为一簇,表明本地区2014年流行的GⅡ.4型诺如病毒仍属于GⅡ.4 Sydney_2012。
除了流行优势株GⅡ.4、GⅡ.17型诺如病毒在2014年度检出率也较高(25.5%)。从2014年10月开始GⅡ.P3/GⅡ.17被持续检出,12月超过GⅡ.4,同时诺如病毒的检测阳性率也从23.7%上升至46.7%。文献表明,以往GⅡ.17在急性腹泻患者中呈散发状态,检出率较低,从2014年底开始中国广东省、江苏省以及日本等亚洲地区出现了由GⅡ.17型引起的诺如病毒暴发及散发病例的增加,同时GⅡ.17取代GⅡ.4成为流行优势型别[12-14]。本地区2014年10月以后诺如病毒检测阳性率上升可能与GⅡ.17的流行有关,应进一步加强GⅡ.17在本地区流行范围和流行强度的监测,及时控制新的诺如病毒流行优势型别引发的急性胃肠炎流行。
| [1] | Kapikian AZ, Wyatt RG, Dolin R, et al. Visualization by immune electron microscopy of a 27-NM particle associated with acute infectious nonbacterial gastroenteritis[J]. J Virol , 1972, 10 (5) : 1075–1081. |
| [2] | Jothikumar N, Lowther JA, Henshilwood K, et al. Rapid and sensitive detection of Noroviruses by using TaqMan-based one-step reverse transcription-PCR assays and application to naturally contaminated shellfish samples[J]. Appl Environ Microbiol , 2005, 71 (4) : 1870–1875. DOI:10.1128/AEM.71.4.1870-1875.2005 |
| [3] | Kojima S, Kageyama T, Fukushi S, et al. Genogroup-specific PCR primers for detection of Norwalk-like viruses[J]. J Virol Methods , 2002, 100 (1/2) : 107–114. |
| [4] | Green KY, Ando T, Balayan MS, et al. Taxonomy of the caliciviruses[J]. J Infect Dis , 2000, 181 (Suppl 2) : S322–330. |
| [5] | Zheng DP, Ando T, Fankhauser RL, et al. Norovirus classification and proposed strain nomenclature[J]. Virology , 2006, 346 (2) : 312–323. DOI:10.1016/j.virol.2005.11.015 |
| [6] | Patel MM, Widdowson MA, Glass RI, et al. Systematic literature review of role of noroviruses in sporadic gastroenteritis[J]. Emerg Infect Dis , 2008, 14 (8) : 1224–1231. DOI:10.3201/eid1408.071114 |
| [7] | Gao Y, Jin M, Cong X, et al. Clinical and molecular epidemiologic analyses of norovirus-associated sporadic gastroenteritis in adults from Beijing, China[J]. J Med Virol , 2011, 83 (6) : 1078–1085. DOI:10.1002/jmv.v83.6 |
| [8] | Sai LT, Wang G, Shao LH, et al. Clinical and molecular epidemiology of norovirus infection in adults with acute gastroenteritis in Ji'nan, China[J]. Arch Virol , 2013, 158 (11) : 2315–2322. DOI:10.1007/s00705-013-1753-0 |
| [9] | Hoa Tran TN, Trainor E, Nakagomi T, et al. Molecular epidemiology of noroviruses associated with acute sporadic gastroenteritis in children:global distribution of genogroups, genotypes and GⅡ. 4 variants[J]. J Clin Virol , 2013, 56 (3) : 269–277. DOI:10.1016/j.jcv.2012.11.011 |
| [10] | Trang NV, Luan LT, Kim-Anh LT, et al. Detection and molecular characterization of noroviruses and sapoviruses in children admitted to hospital with acute gastroenteritis in Vietnam[J]. J Med Virol , 2012, 84 (2) : 290–297. DOI:10.1002/jmv.v84.2 |
| [11] | van Beek J, Ambert-Balay K, Botteldoorn N, et al. Botteldoorn N, et al. Indications for worldwide increased norovirus activity associated with emergence of a new variant of genotypeⅡ. 4, late 2012[J]. Euro Surveill , 2013, 18 (1) : 8–9. |
| [12] | Matsushima Y, Ishikawa M, Shimizu T, et al. Genetic analyses of GⅡ. 17 norovirus strains in diarrheal disease outbreaks from December 2014 to March 2015 in Japan reveal a novel polymerase sequence and amino acid substitutions in the capsid region[J]. Euro Surveill , 2015, 20 (26) : 21173. DOI:10.2807/1560-7917.ES2015.20.26.21173 |
| [13] | Fu J, Ai J, Jin M, et al. Emergence of a new GⅡ. 17 norovirus variant in patients with acute gastroenteritis in Jiangsu, China, September 2014 to March 2015[J]. Euro Surveill , 2015, 20 (24) : 21157. DOI:10.2807/1560-7917.ES2015.20.24.21157 |
| [14] | Lu J, Sun LM, Fang L, et al. Gastroenteritis outbreaks caused by norovirus GⅡ. 17, Guangdong Province, China, 2014-2015[J]. Emerg Infect Dis , 2015, 21 (7) : 1240–1242. DOI:10.3201/eid2107.150226 |
 2016, Vol. 31
2016, Vol. 31


