扩展功能
文章信息
- 杨元斌, 宋启发, 闫鹏, 高红, 叶硕
- YANG Yuan-bin, SONG Qi-fa, YAN Peng, GAO Hong, YE Shuo
- 2003-2014年浙江省宁波市肠炎沙门菌分子分型及耐药特征研究
- PFGE subtype and antimicrobial resistance of Salmonella enteritidis isolated in Ningbo, 2003-2014
- 疾病监测, 2016, 31(12): 1007-1011
- Disease Surveillance, 2016, 31(12): 1007-1011
- 10.3784/j.issn.1003-9961.2016.12.008
-
文章历史
- 收稿日期:2016-05-04
非伤寒沙门菌是常见的食源性病原菌,主要引起人类胃肠炎(食物中毒),临床表现有发热、腹泻、腹痛、呕吐甚至败血症等。据报道全球每年约有15万人死于非伤寒沙门菌感染[1]。沙门菌容易污染蛋类、奶类和肉类食物,经口摄入是非伤寒沙门菌的主要感染途径。作为引起胃肠炎的常见沙门菌,肠炎血清型引起的食源性疾病在国内外多有报道[2-3],在世界各地区受到高度重视。为了解宁波市肠炎沙门菌的分子分型特点和耐药特征,为预防和控制肠炎沙门菌引起的食源性疾病提供科学的实验室支持,本研究对2003-2014年所有肠炎沙门菌分离株进行了PFGE分型和耐药性分析。
1 材料与方法 1.1 材料 1.1.1 菌株来源肠炎沙门菌共68株,分别来自2003-2014年食物中毒可疑食品(7株)、散发和暴发的腹泻者粪便(58株)、胸水(1株)、河水(1株)和职业体检者粪便(1株)。
1.1.2 主要仪器与试剂脉冲场凝胶电泳仪CHEFMapper和凝胶成像仪Gel Doc XR (Bio-Rad,美国);沙门菌显色平板(CHROMagar®,法国);生化鉴定条API 20E和细菌鉴定仪Vitek 2 Compact (生物梅里埃,法国);沙门菌诊断血清(SSI,丹麦);蛋白酶K、限制性内切酶XbaⅠ/BlnⅠ(Promega,美国);低熔点琼脂糖(LONZA,美国)。
1.2 方法 1.2.1 沙门菌分离、生化鉴定及血清学分型细菌分离及生化鉴定按照GB 4789.4-2010《食品微生物学检验沙门菌检验》及WS/T 13-1996《沙门菌食物中毒诊断标准及处理原则》操作,血清学分型依据GB 4789.4-2010《食品微生物学检验沙门菌检验》和《沙门菌属血清型诊断》[4]。生化鉴定为沙门菌者,血清凝集结果为9,12 :g,m:-判断为肠炎沙门菌。
1.2.2 抗生素敏感性实验参照2016年CLSI的操作规程采用纸片扩散法对10种抗生素进行药物敏感试验。根据对标准纸片的抑菌圈直径判断敏感(S)、中介(I)、耐药(R),参考M100-S26抗生素敏感性试验的判断标准进行折点判断[5]。质控菌株为大肠埃希菌ATCC25922。
1.2.3 分子分型参照PulseNet China沙门菌脉冲场凝胶电泳(PFGE)实验步骤[6],选择XbaⅠ与BlnⅠ内切酶分别对68株和22株肠炎沙门菌进行单/双酶切分型。标准分子质量菌株为布伦登卢普沙门菌(H9812)[7]。电泳图谱使用BioNumerics 6.6软件进行聚类分析,采用PulseNet China提供的China MasterScripts v5.01标准脚本建立数据库,以H9812作为标准。每条带型间的相似度用Dice系数来衡量,条带位置差异容许度选择1.5%,优化值选择1.5%。用非加权组平均法(UPGMA)进行分析,最后导出聚类图。参考Tenover原则:酶切后图谱完全一致定为同一带型;酶切后图谱有1~3条带不同者,可认为菌株间关系较密切;酶切后图谱如有3条以上条带不同者则认为菌株间关系不密切[8]。
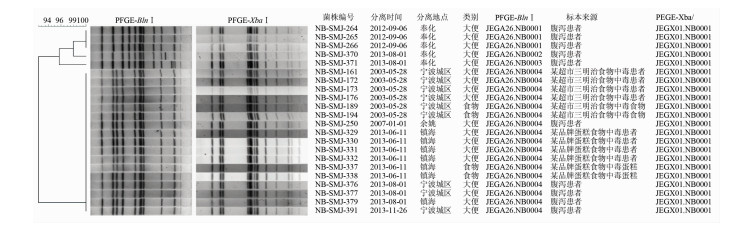
2 结果 2.1 肠炎沙门菌分子分型和聚类68株肠炎沙门菌基因组经XbaⅡ酶切,可获得12~14个片段, < 20.5 kb片段不参与分析。经软件处理,根据菌株的条带位置及数量差异,将全部68株肠炎沙门菌分为8个PFGE带型(以菌株间相似度系数100%为同一PFGE型别),分别命名为JEGX01.NB0001~8型(图 1)。以JEGX01.NB0001型(53株菌,占77.9%)为最优势带型;其次为JEGX01.NB0004型和JEGX01.NB0003型(分别有7株和3株);余下为JEGX01.NB0002型、JEGX01.NB0005~8型均有1株菌,各带型间的图谱相似系数在81.0%~96.3%之间。在JEGX01.NB0001型的肠炎沙门菌中挑选22株(包含2003年和2013年各自引发80例以上食源性暴发的肠炎菌株),加做BlnⅠ内切酶的图谱分析:存在4个型别(JEGA26.NB0001、JEGA26.NB0002、JEGA26.NB0003、JEGA26.NB0004型),双酶切聚类图谱提示JEGA26.NB0004型和JEGX01.NB0001型存在100%的遗传相似度(图 2)。因此认为,2003年宁波市发生的与三明治相关的肠炎暴发菌株与2013年宁波市镇海区发生的与蛋糕相关的肠炎暴发菌株间,虽然在时间和地理位置上存在差异,但仍然提示有高度的流行病学相关性。

|
| 图 1 68株肠炎沙门菌的分子分型聚类图,内切酶:XbaⅠ Figure 1 Cluster analysis of 68 S. entertiditis isolates by XbaⅠ digestion |
| |
|
| 图 2 食源性暴发肠炎沙门菌株的分子分型聚类图,内切酶:XbaⅠ与BlnⅠ Figure 2 Cluster analysis of foodborne S. enteritidis isolates by XbaⅠ and BlnⅠ digestion |
| |
68株肠炎菌株,氨苄西林耐药率为23.5%、强力霉素耐药率为4.4%、氨曲南、头孢吡肟和头孢噻肟的耐药率均为2.9%、复方新诺明、氯霉素耐药率均为1.5%、庆大霉素、环丙沙星和亚胺培南均敏感(表 1)。发现2株多重耐药菌株:1株耐氨曲南、氨苄西林、头孢噻肟和头孢吡肟;另1株耐氯霉素、氨曲南、氨苄西林、头孢噻肟、头孢吡肟和强力霉素。
| 抗生素 | 耐药株数 | 中介株数 | 敏感株数 | 耐药率(%) |
| 氨苄西林(AMP) | 16 | 0 | 52 | 23.5 |
| 强力霉素(DO) | 3 | 1 | 64 | 4.4 |
| 头孢噻肟(CTX) | 2 | 0 | 66 | 2.9 |
| 头孢吡肟(FEP) | 2 | 0 | 66 | 2.9 |
| 氨曲南(ATM) | 2 | 0 | 66 | 2.9 |
| 复方新诺明(SXT) | 1 | 1 | 66 | 1.5 |
| 氯霉素(C) | 1 | 0 | 67 | 1.5 |
| 庆大霉素(CN) | 0 | 0 | 68 | 0.0 |
| 亚胺培南(IPM) | 0 | 0 | 68 | 0.0 |
| 环丙沙星(CIP) | 0 | 0 | 68 | 0.0 |
肠炎沙门菌是我国非伤寒沙门菌腹泻或食物中毒中最常见的血清型,在我国分布广泛、检出率最高[9]。随着现代食品贸易的发展以及现代物流业的进步,跨区域的食品流动产生的沙门菌食源性疾病具有越来越复杂的特点,仅依靠传统血清学分型已不能满足日益复杂的流行病学调查与溯源要求。PFGE技术作为大多数细菌分子分型的金标准,其识别暴发与比对散发的能力得到全球的认可,我国已于2004年建立了基于PFGE分型技术的病原菌分子分型监测网络PulseNet China。国内外对肠炎沙门菌PFGE分型的研究结果表明,单酶切分型对于肠炎沙门菌型别的分辨力较低,采用双酶切或多酶切分型,可以提高PFGE技术对于肠炎沙门菌型别的分辨力,能够更好地满足该菌的分型要求[10-11]。
通过将本研究的分型结果与PulseNet China中心数据库进行比对发现,宁波地区最优势JEGX01.NB0001型肠炎沙门菌与中国最优势JEGX01.CN0003型肠炎沙门菌带型完全一致;宁波地区次优势JEGX01.NB0004型肠炎沙门菌与中国次优势JEGX01.CN0001型肠炎沙门菌带型也完全一致,表明宁波市肠炎沙门菌的带型分布特点与中国肠炎沙门菌带型的总体分布特征一致[12]。
本研究发现的JEGX01.NB0001型肠炎沙门菌,不但分离率高,而且致病性较强,对于宁波市具有重要的流行病学意义。通过图 1可以看出其除了引起数例散发病例外,主要于2003年5月(污染某超市的三明治面包)、2013年5月(污染某品牌慕斯蛋糕)各引起一起80人以上的食物中毒暴发事件[13-14]。图 2通过双酶切分型方法,对这2次食物中毒暴发的代表株以及同型散发株进行组合聚类分析,发现分离自奉化市的5株肠炎沙门菌虽然经XbaⅠ酶切形成的带型与其余沙门菌相同,但经BlnⅠ酶切后形成的带型与其余肠炎沙门菌不同;而包括2次食物中毒暴发株在内的其余菌株带型仍然完全相同。提示在进行肠炎沙门菌PFGE分型时,针对同一起暴发的分离株,用单酶切分型方法一般是可以满足要求的;肠炎沙门菌基因相对保守,单酶切分型的分辨力不高,对于跨时间、跨地区暴发或者散发的分离株,进行比对时,应使用双酶切或多酶切方法进行分型研究,才能得出更可靠的分型结论。
宁波市两起由JEGX01.NB0001/JEGA26.NB0004型肠炎沙门菌导致的食物中毒暴发,均系食用肠炎沙门菌污染的蛋类制品引起,与文献中经常报道的沙门菌容易污染蛋类、奶类、肉类食物一致[15];两次肠炎沙门菌食物中毒的暴发时间均为当年5月底,为本地夏季胃肠炎、食物中毒高发期,亦符合沙门菌食物中毒的流行特征。夏季是沙门菌腹泻或食物中毒的高发季节,应加强食品生产、经营领域的卫生监督执法,督促企业严格按照卫生规范操作,降低易污染类食品对致病性沙门菌的暴露风险,减少或杜绝该类食源性疾病暴发。
本研究显示肠炎沙门菌总体耐药率处于较低水平。对常用的治疗肠道沙门菌感染的三代头孢耐药率均为2.9%,对环丙沙星均敏感。对氨苄西林的耐药率最高,达23.5%,推测为青霉素类的广泛使用对细菌产生选择压力的结果。本研究发现多重耐药肠炎沙门菌共2株,且均分离于奉化市腹泻患者,虽然多重耐药率较低,也应加强对多重耐药株的持续监测,为临床合理使用抗生素、防止抗生素滥用导致更多耐药菌的出现提供实验室支持。
综上所述,宁波市肠炎沙门菌PFGE分子带型间的相似度高,存在优势克隆型,该优势型2003年、2013年均引起80人以上的食物中毒暴发事件。肠炎沙门菌的总体耐药率较低,但存在多重耐药株值得引起重视。
作者贡献:
杨元斌 ORCID:0000-0002-9666-1123
杨元斌:脉冲场凝胶电泳的全部操作、图谱生成、数据库建立、聚类分析、结果分析
宋启发:脉冲场凝胶电泳的部分操作,菌株收集,菌株库建立,结果分析
闫鹏:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
高红:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
叶硕:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
| [1] | Majowicz SE, Musto J, Scallan E, et al. The global burden of nontyphoidal Salmonella Gastroenteritis[J]. Clin Infect Dis, 2010, 50 (6) : 882–889. DOI:10.1086/649513 |
| [2] | Wu AP, Wang HQ, Zheng W, et al. Application of pulsed-field gel electrophoresis for tracking source of Salmonella enteritidis in two food poisoning events[J]. Disease Surveillance, 2013, 28 (12) : 1027–1029. (in Chinese) 吴爱萍, 汪皓秋, 郑伟, 等. 应用脉冲场凝胶电泳技术对肠炎沙门菌食物中毒溯源分析[J]. 疾病监测, 2013, 28 (12) : 1027–1029. |
| [3] | Huang Y, Sun GJ, Tang ZZ, et al. Molecular epidemiological survey with pulsed-field gel electrophoresis on two simultaneous but allopatric food-poisoning accidents caused by Salmonella enteritidis[J]. Chinese Journal of Food Hygiene, 2011, 23 (5) : 407–410. (in Chinese) 黄彦, 孙贵娟, 唐振柱, 等. 脉冲场电泳在两起同期异地肠炎沙门菌食物中毒分子流行病学调查中的应用研究[J]. 中国食品卫生杂志, 2011, 23 (5) : 407–410. |
| [4] | Zhu C, Xu XB. Serological diagnosis of salmonella-species[M]. Shanghai: Tongji University Press, 2009 . (in Chinese) 朱超, 许学斌. 沙门菌属血清型诊断[M]. 上海: 同济大学出版社, 2009 . |
| [5] | Clinical and Laboratory Standards Institute.M100S24E Performance standards for antimicrobial susceptibility testing:twenty-sixth informational supplement[S].Wayne, PA, USA:NCCLS, 2016. |
| [6] | Ribot EM, Fair MA, Gautom R, et al. Standardization of pulsed-field gel electrophoresis protocols for the subtyping of Escherichia coli O157:H7, Salmonella, and Shigella for PulseNet[J]. Foodborne Pathog Dis, 2006, 3 (1) : 59–67. DOI:10.1089/fpd.2006.3.59 |
| [7] | Hunter SB, Vauterin P, Lambert-Fair MA, et al. Establishment of a universal size standard strain for use with the PulseNet standardized pulsed-field gel electrophoresis protocols:converting the national databases to the new size standard[J]. J Clin Microbiol, 2005, 43 (3) : 1045–1050. DOI:10.1128/JCM.43.3.1045-1050.2005 |
| [8] | Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33 (9) : 2233–2239. |
| [9] | Zhao M, Cui XC, Yu HX, et al. Laboratory diagnosis and analysis of a food poisoning outbreak caused by Salmonella[J]. Disease Surveillance, 2015, 30 (5) : 381–384. (in Chinese) 赵萌, 崔旭初, 于慧霞, 等. 一起沙门菌食物中毒的实验室诊断与分析[J]. 疾病监测, 2015, 30 (5) : 381–384. |
| [10] | Zheng J, Keys CE, Zhao SH, et al. Simultaneous analysis of multiple enzymes increases accuracy of pulsed-field gel electrophoresis in assigning genetic relationships among homogeneous Salmonella strains[J]. J Clin Microbiol, 2011, 49 (1) : 85–94. DOI:10.1128/JCM.00120-10 |
| [11] | Diao BW, Nie YN, Li J, et al. Evaluation on application of multi locus variable number tandem repeat analysis in molecular typing of Salmonella enteritidis strains isolated in China[J]. Disease Surveillance, 2013, 28 (12) : 1021–1026. (in Chinese) 刁保卫, 聂艳妮, 李杰, 等. 多位点串联重复序列分析应用于中国肠炎沙门菌分型能力的评价[J]. 疾病监测, 2013, 28 (12) : 1021–1026. |
| [12] | Lou J, Diao BW, Li J, et al. Characterization of Salmonella enteritidis with pulsed-field gel electrophoresis in China[J]. Disease Surveillance, 2013, 28 (6) : 434–438. (in Chinese) 娄静, 刁保卫, 李杰, 等. 中国肠炎沙门菌脉冲场凝胶电泳分子分型数据库的分析[J]. 疾病监测, 2013, 28 (6) : 434–438. |
| [13] | Zhou NG, Xu JY, Yang ZX. A food-poisoning accident caused by Salmonella enteritidis[J]. China Preventive Medicine, 2004, 5 (3) : 204–205. (in Chinese) 周乃根, 徐景野, 杨芝厦. 一起肠炎沙门菌引起的食物中毒[J]. 中国预防医学杂志, 2004, 5 (3) : 204–205. |
| [14] | Song QF, Wang AH, Yang YB, et al. Application of molecular biological technology in a food poisoning incident[J]. Chinese Journal of Food Hygiene, 2014, 26 (3) : 254–258. (in Chinese) 宋启发, 王爱红, 杨元斌, 等. 分子生物学技术在一起食物中毒检测中的应用[J]. 中国食品卫生杂志, 2014, 26 (3) : 254–258. |
| [15] | Tang JN, Liu J, Chen J. Progress on the mechanisms of interactions between Salmonella enteritidis infection and egg contamination[J]. Chinese Journal of Food Hygiene, 2012, 24 (1) : 95–98. (in Chinese) 唐俊妮, 刘骥, 陈娟. 肠炎沙门菌感染与鸡蛋污染相互作用机制的研究进展[J]. 中国食品卫生杂志, 2012, 24 (1) : 95–98. |
 2016, Vol. 31
2016, Vol. 31


