扩展功能
文章信息
- 王敏, 顾一心, 梁昊, 付燕燕, 何利华, 张建中, 张茂俊
- WANG Min, GU Yi-xin, LIANG Hao, FU Yan-yan, HE Li-hua, ZHANG Jian-zhong, ZHANG Mao-jun
- 北京市零售鸡肉标本中弓形杆菌污染初步分析
- Isolation and identification of Arcobacter from retail chicken meat in Beijing
- 疾病监测, 2016, 31(12): 1050-1054
- Disease Surveillance, 2016, 31(12): 1050-1054
- 10.3784/j.issn.1003-9961.2016.12.017
-
文章历史
- 收稿日期:2016-09-30
弓形杆菌于1977年首次从流产的牛、猪胎儿中分离,由于与弯曲菌形态相似,最开始被划为弯曲菌属。1991年从弯曲菌属分离出来,纳入弯曲菌科弓形杆菌属[1]。近几年,弓形杆菌因其属内成员被认为是新发肠道病原菌和人畜共患菌,被逐渐引起重视[2-3]。弓形杆菌为革兰阴性菌,菌体大小(0.2~0.9)×(0.5~3.0)μm,无荚膜,无芽孢,通常呈S形或螺旋形,一端或两端具有单鞭毛,可运动,在15 ℃~-37 ℃需氧和微需氧条件下存活[1]。目前发现的弓形杆菌属已有21个菌种[4],其中布氏弓形杆菌(Arcobacter butzleri),嗜低温弓形杆菌(Arcobacter cryaerophilus)和斯氏弓形杆菌(Arcobacter skirrowii)与人类和动物疾病相关[5-8]。弓形杆菌感染的主要症状为腹痛、水样便[9],与弯曲菌的感染相比,弓形杆菌感染的水样便更多见。
食用了污染的食品或饮用污染的水是导致人感染弓形杆菌最常见的途径[9-10]。目前,多项国外研究报道已在食品,水,动物粪便,腹泻患者粪便等样品中检测到弓形杆菌。研究发现,肉类食品中鸡肉、牛肉污染率较高[7],鸡肉中可高达73%[11]。同时,研究显示在各类食品分离的弓形杆菌中,布氏弓形杆菌污染最多,其次是嗜低温弓形杆菌[12-17]。目前国际上还没有弓形杆菌标准的分离方法,虽然建立了选择性培养基、滤膜法直接过滤、增菌富集等方法分离培养弓形杆菌,但检出率仍较低。截至目前,我国弓形杆菌的相关报道较少,仅有使用聚合酶链反应(PCR)法检测禽肉样本中弓形杆菌污染情况的报道[18-19],对其病原学的研究以及耐药现状的分析仍是空白。
本次研究试用新的弯曲菌分离技术——驱动增强双孔滤膜法进行鸡肉样本中弓形杆菌的分离培养,希望了解本地区市场上鸡肉样本中的弓形杆菌的污染现状,为我国肉类食品中弓形杆菌的检测提供新的方法及基础数据。
1 材料与方法 1.1 材料 1.1.1 样本来源北京市某区随机选取6个零售市场,每个零售市场至少采集5份新鲜鸡肉样本,共计60份。将采集的样品放入无菌袋中冰袋冷藏,2~4 h内带回实验室。
1.1.2 试剂弯曲菌培养检测试剂盒购自青岛中创生物科技有限公司(ZC-CAMPY-002),QIAamp DNA Mini Kit (250)购自QIAGEN (北京)公司(Cat.No.51306),2×EasyTaq PCR SuperMix购自全式金生物技术有限公司(CAT:AS111),Gelred 10 000×染料购自BIOTIUM公司(cat:41003),Trans2K DNA Marker (BM101)购自全式金生物技术有限公司,引物由上海生工生物技术有限公司合成。
1.2 方法 1.2.1 样品处理称量鸡肉样本,取出检测试剂盒中的样品盥洗液稀释至工作浓度,将工作液加入到装有鸡肉样本的自封袋中至淹没样本(每1 kg鸡肉样本样品加入300 ml样品盥洗液)。自封袋封口后置于振荡器上,以100 r/min的速度振荡15 min,然后反复揉搓样本5 min。
1.2.2 双孔滤膜法弓形杆菌的分离培养取新鲜的盥洗液300 μl,分成6~7点,均匀地滴加于贴有滤膜的双孔板上,在大气环境下静置45~60 min, 待平皿上无明显液体后,使用无菌镊子轻轻揭去滤膜,于37 ℃微需氧环境(5% O2、10% CO2和85% N2)中培养48 h;在双孔板上各挑取2~3个可疑单菌落,接种于哥伦比亚血平皿上置于37 ℃,微需氧环境下纯化培养48 h。
1.2.3 核酸提取取新鲜的、生长状态良好的纯化培养物一环(10 μl),加入200 μl 0.85%的生理盐水混匀,13 000 r/min离心2 min, 去上清液,然后使用QIAgenDNA提取试剂盒,按说明提取菌株的DNA模板。使用ND-1000分光光度计测定DNA模板浓度,-20 ℃保存,备用。
1.2.4 多重PCR及测序鉴定参照文献[19]在弓形杆菌16S rDNA、23S rRNA基因上,设计嗜低温弓形杆菌、布氏弓形杆菌、斯氏弓形杆菌三重PCR鉴定引物,扩增目的DNA片段长度分别为257 bp、401 bp、641 bp。引物均由上海生工生物工程技术有限公司合成,引物序列见表 1。对部分鉴定菌株的PCR产物进行测序鉴定,序列结果与NCBI数据库比对,核实确定菌株的菌种结果。弓形杆菌多重PCR扩增体系体积为20 μl,其中包括模板DNA 1μl、2× EasyTaq PCR SuperMix 10 μl、每对上下游引物各0.4 μl (10 μm/L),去核酸水6.6 μl。PCR反应条件为首先94 ℃预变性2 min;94 ℃变性45 s,61 ℃退火45 s,72 ℃延伸30 s,32个循环;最后72 ℃延伸7 min。使用0.5 × TBE配制1.5%琼脂糖凝胶(加入GelRed染料), 每孔加样2 μl PCR产物, 2000 bp DNA ladder作为Marker, 120 V电压, 电泳40 min,使用凝胶成像系统成像,检测扩增结果。
| 菌种 | 引物名称 | 序列(5′~3′) | 扩增片段(bp) |
| 嗜低温弓形杆菌 | CRY-F | TGC TGG AGC GGA TAG AAG TA | 257 |
| CRY-R | AAC AAC CTA CGT CCT TCG AC | ||
| 布氏弓形杆菌 | BUTZ-F | CCT GGA CTT GAC ATA GTA AGA ATG A | 401 |
| ARCO-R | CGT ATT CAC CGT AGC ATA GC | ||
| 斯氏弓形杆菌 | SKIR-F | GGC GAT TTA CTG GAA CAC A | 641 |
| ARCO-R | CGT ATT CAC CGT AGC ATA GC |
使用通用引物27 F和1492 R对16S rRNA基因进行扩增,参照Korczak等[20]对ropB基因进行扩增,引物序列见表 2。16S rRNA和ropB基因的PCR扩增体系体积为20 μl,其中2× EasyTaq PCR SuperMix10 μl、模板DNA 1 μl, 每对上下游引物各0.4 μl (10 μm/L),去核酸水8.2 μl。16S rRNA基因的PCR反应条件为94 ℃预变性5 min;94 ℃变性60 s,54 ℃退火60 s,72 ℃延伸60 s,30个循环;最后72 ℃延伸5 min。rpoB基因的PCR反应条件为94 ℃预变性3 min;94 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸30 s,35个循环;最后72 ℃延伸7 min。
| 靶基因 | 引物名称 | 序列(5′~3′) | 片段大小(bp) |
| 16S rRNA | 16S-27F | AGA GTT TGA TCC TGG CTC AG | 1465 |
| 16S-1492R | GGT TAC CTT GTT ACG ACT T | ||
| rpoB | ARpoB-F | CCA ATT TAT GGA TCA AAC | 527 |
| ARpoB-R | GTT GCA TGT TNG NAC CCA T |
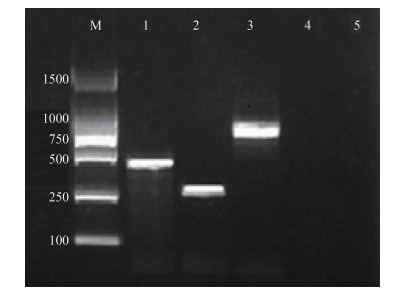
60份鸡肉样本,经弓形杆菌多重PCR扩增后布氏弓形杆菌在401 bp处、嗜低温弓形杆菌在257 bp处、斯氏弓形杆菌在641 bp处获得特异性条带。共鉴定出125株弓形杆菌,其中嗜低温弓形杆菌最多,占91.20%(114/125),其次是布氏弓形杆菌8.00%(10/125)和斯氏弓形杆菌0.80%(1/125),见图 1。
|
| 图 1 弓形杆菌16S rRNA、23 S rRNA基因三重PCR鉴定电泳结果 Figure 1 Electrophoresis results of 16S rRNA and rpoB genes ofArcobacter by multiplex PCR 注:M:DL2000 DNA Marker;1:布氏弓形杆菌;2:嗜低温弓形杆菌;3:斯氏弓形杆菌;4:空肠弯曲菌;5:空白对照。 |
| |
对分离到的菌株,使用16S rRNA和rpoB基因序列扩增进行菌种鉴定,序列与NCBI已有的数据库进行BLAST比对,所测序列鉴定度均在99%及以上,与多重PCR鉴定结果相符。
2.3 弓形杆菌分离情况分析60份鸡肉样本中44份样本弓形杆菌阳性,阳性率73.33%(见表 3),其中嗜低温弓形杆菌阳性43份(97.73%),布氏弓形杆菌阳性9份(20.45%),斯氏弓形杆菌阳性1份(2.27%)。8份布氏弓形杆菌和1份斯氏弓形杆菌阳性的样本,均存在着与嗜低温弓形杆菌的混合污染,混合污染率为15.00%(9/60)。不同农贸市场来源的样本中弓形杆菌的分离情况也不同,分离率在30.00%~100.00%之间。
| 采样点 | 来源 | 弓形杆菌属 | 嗜低温弓形杆菌 | 布氏弓形杆菌 | 斯氏弓形杆菌 | 样本数 | 阳性率(%) |
| 农贸市场1 | 鸡胴体 | 6 | 6 | 0 | 0 | 20 | 30.00 |
| 农贸市场2 | 鸡腿 | 8 | 8 | 0 | 1 | 10 | 80.00 |
| 农贸市场3 | 鸡腿 | 10 | 10 | 0 | 0 | 10 | 100.00 |
| 农贸市场4 | 鸡腿 | 6 | 6 | 1 | 0 | 5 | 100.00 |
| 农贸市场5 | 鸡腿 | 5 | 5 | 1 | 0 | 6 | 100.00 |
| 农贸市场6 | 鸡腿 | 9 | 8 | 7 | 0 | 9 | 88.89 |
| 合计 | 44 | 43 | 9 | 1 | 60 | 73.33 |
作为潜在的食源性病原菌,弓形杆菌已引起多国关注[2-3]。本研究中60份鸡肉样本应用驱动增强双孔滤膜法检出44份弓形杆菌阳性样本,阳性率为73.33%。目前我国尚无零售鸡肉中弓形杆菌分离情况的报道,游淑珠等[17]2013年使用PCR法检测20份禽肉样本中布氏弓形杆菌的污染,阳性检出率为15.00%,与本次鸡肉样本中布氏弓形杆菌的分离率(20.93%)相似。本研究与Rivas等[15]2004年的一项澳大利亚地区零售鸡肉中弓形杆菌73.00%(16/22)分离率的报道结果相似,高于尼日利亚(32.00%)、西班牙(64.30%)、北爱尔兰(62.00%)等多个地区报道的污染率[13-14, 21]。
本研究分离的44份弓形杆菌阳性标本中,嗜低温弓形杆菌所占比例最高,达97.73%,其次是布氏弓形杆菌(20.45%)。而国外的多数研究显示鸡肉分离的弓形杆菌以布氏弓形杆菌为主,最高可达100.00%,明显高于嗜低温弓形杆菌和斯氏弓形杆菌[12, 22-24],与我国鸡肉中弓形杆菌不同菌种的污染可能存在差异。在本研究中斯氏弓形杆菌的检出率较低,国外研究也显示了相似的结果[25-26],可能由于斯氏弓形杆菌在鸡肉样本中污染少,或者目前使用的分离培养方法不适合斯氏弓形杆菌的生长。本研究中弓形杆菌不同菌种的混合污染率为15.00%,国外的多项研究也发现了在鸡肉样本中存在弓形杆菌不同菌种的混合污染[25, 27]。农贸市场1的污染情况与其他的市场有较大差异,可能与样本屠宰后立即分装有关,减少了因堆积搁置而导致的交叉污染的可能。
国外食品样本中弓形杆菌的分离培养常使用选择性肉汤增菌后再过滤,在样本污染的菌量较少时能够一定程度提高分离率,但同时也会抑制弓形杆菌属内某些对抗生素较为敏感的菌种的生长。而之前本研究组使用选择性培养基培养弓形杆菌失败可能与样本中杂菌的耐药增强,导致国外研究者使用的选择性培养基对于我国样本无效或者效率降低有关。本研究试用驱动增强双孔滤膜法对鸡肉样本盥洗液直接分离培养,避免了培养中选择性抗生素的使用,利用细菌的动力特征可有效分离弓形杆菌。本次研究结果表明对于与弯曲菌大小及理化特点类似的弓形杆菌,驱动增强滤膜法具有相同的检测效果。
目前国内针对食品中弓形杆菌污染情况的相关报道较少,可能由于分离培养的方法不够灵敏和特异。本研究提供了弓形杆菌有效的分离培养方法,初步获得了本地区6个零售市场上鸡肉样本弓形杆菌的污染情况,为后期开展动物源性食品及腹泻患者中弓形杆菌的研究提供方法参考。
作者贡献:
王敏:样品采集和论文前言、结果、讨论的撰写
顾一心:分离培养实验
梁昊:样品采集
付燕燕:菌株鉴定
何利华:分离培养实验和菌株鉴定
张建中:文章修改
张茂俊:实验设计和文章整体修改
| [1] | Vandamme P, Falsen E, Rossau R, et al. Revision of Campylobacter, Helicobacter, and Wolinella taxonomy:emendation of generic descriptions and proposal of Arcobacter gen. nov[J]. Int J Syst Bacteriol, 1991, 41 (1) : 88–103. DOI:10.1099/00207713-41-1-88 |
| [2] | Houf K, Devriese LA, Haesebrouck F, et al. Antimicrobial susceptibility patterns of Arcobacter butzleri and Arcobacter cryaerophilus strains isolated from humans and broilers[J]. Microb Drug Resist, 2004, 10 (3) : 243–247. DOI:10.1089/mdr.2004.10.243 |
| [3] | Ho HTK, Lipman LJA, Gaastra W. Arcobacter, what is known and unknown about a potential foodborne zoonotic agent![J]. Vet Microbiol, 2006, 115 (1/3) : 1–13. |
| [4] | Giacometti F, Losio MN, Daminelli P, et al. Short communication:Arcobacter butzleri and Arcobacter cryaerophilus survival and growth in artisanal and industrial ricotta cheese[J]. J Dairy Sci, 2015, 98 (10) : 6776–6781. DOI:10.3168/jds.2015-9560 |
| [5] | Lehner A, Tasara T, Stephan R. Relevant aspects of Arcobacter spp. as potential foodborne pathogen[J]. Int J Food Microbiol, 2005, 102 (2) : 127–135. DOI:10.1016/j.ijfoodmicro.2005.03.003 |
| [6] | Ferreira S, Queiroz JA, Oleastro M, et al. Insights in the pathogenesis and resistance of Arcobacter:a review[J]. Crit Rev Microbiol, 2016, 42 (3) : 364–383. |
| [7] | Kayman T, Abay S, Hizlisoy H, et al. Emerging pathogen Arcobacter spp. in acute gastroenteritis:molecular identification, antibiotic susceptibilities and genotyping of the isolated arcobacters[J]. J Med Microbiol, 2012, 61 (Pt10) : 1439–1444. |
| [8] | Figueras MJ, Levican A, Pujol I, et al. A severe case of persistent diarrhoea associated with Arcobacter cryaerophilus but attributed to Campylobacter spp.[J]. New Microbes New Infect, 2014, 2 (2) : 31–37. DOI:10.1002/2052-2975.35 |
| [9] | Collado L, Figueras MJ. Taxonomy, epidemiology, and clinical relevance of the genus Arcobacter[J]. Clin Microbiol Rev, 2011, 24 (1) : 174–192. DOI:10.1128/CMR.00034-10 |
| [10] | Duffy LL, Fegan N. Prevalence and concentration of Arcobacter spp. on Australian Beef Carcasses[J]. J Food Prot, 2012, 75 (8) : 1479–1482. DOI:10.4315/0362-028X.JFP-12-093 |
| [11] | Andersen MME, Wesley IV, Nestor E, et al. Prevalence of Arcobacter species in market-weight commercial turkeys[J]. Antonie van Leeuwenhoek, 2007, 92 (3) : 309–317. DOI:10.1007/s10482-007-9153-7 |
| [12] | Zacharow I, Bystroń J, Walecka-Zacharska E, et al. Prevalence and antimicrobial resistance of Arcobacter butzleri and Arcobacter cryaerophilus isolates from retail meat in lower Silesia region, Poland[J]. Pol J Vet Sci, 2015, 18 (1) : 63–69. |
| [13] | Collado L, Guarro J, Figueras MJ. Prevalence of Arcobacter in meat and shellfish[J]. J Food Prot, 2009, 72 (5) : 1102–1106. DOI:10.4315/0362-028X-72.5.1102 |
| [14] | Scullion R, Harrington CS, Madden RH. Prevalence of Arcobacter spp. in raw milk and retail raw meats in Northern Ireland[J]. J Food Prot, 2006, 69 (8) : 1986–1990. DOI:10.4315/0362-028X-69.8.1986 |
| [15] | Rivas L, Fegan N, Vanderlinde P. Isolation and characterisation of Arcobacter butzleri from meat[J]. Int J Food Microbiol, 2004, 91 (1) : 31–41. DOI:10.1016/S0168-1605(03)00328-3 |
| [16] | Gude A, Hillman TJ, Helps CR, et al. Ecology of Arcobacter species in chicken rearing and processing[J]. Lett Appl Microbiol, 2005, 41 (1) : 82–87. DOI:10.1111/lam.2005.41.issue-1 |
| [17] | You SZ, Wang XY, Hu SN, et al. Detection of Arcobacter butzleri in animal derived food by a PCR method[J]. Modern Food Science and Technology, 2013, 29 (10) : 2533–2537. (in Chinese) 游淑珠, 王小玉, 胡松楠, 等. PCR法检测动物源性食品中布氏弓形菌[J]. 现代食品科技, 2013, 29 (10) : 2533–2537. |
| [18] | Bi SL. Application of polymerase chain reaction assay based on the gyrA gene for detection of Arcobacter in food[J]. Food and Fermentation Industries, 2013, 39 (9) : 170–174. (in Chinese) 毕水莲. 应用gyrA基因聚合酶链反应检测食品中弓形菌[J]. 食品与发酵工业, 2013, 39 (9) : 170–174. |
| [19] | Houf K, Tutenel A, de Zutter L, et al. Development of a multiplex PCR assay for the simultaneous detection and identification of Arcobacter butzleri, Arcobacter cryaerophilus and Arcobacter skirrowii[J]. FEMS Microbiol Lett, 2000, 193 (1) : 89–94. DOI:10.1111/fml.2000.193.issue-1 |
| [20] | Korczak BM, Stieber R, Emler S, et al. Genetic relatedness within the genus Campylobacter inferred from rpoB sequences[J]. Int J Syst Evol Microbiol, 2006, 56 (Pt 5) : 937–945. |
| [21] | Adesiji YO, Coker AO, Oloke JK. Detection of Arcobacter in feces of healthy chickens in Osogbo, Nigeria[J]. J Food Prot, 2011, 74 (1) : 119–121. DOI:10.4315/0362-028X.JFP-10-231 |
| [22] | Corry JEL, Atabay HI. Poultry as a source of Campylobacter and related organisms[J]. Symp Ser Soc Appl Microbiol, 2001, 90 (Suppl 6) : S96–114. |
| [23] | Kabeya H, Maruyama S, Morita Y, et al. Prevalence of Arcobacter species in retail meats and antimicrobial susceptibility of the isolates in Japan[J]. Int J Food Microbiol, 2004, 90 (3) : 303–308. DOI:10.1016/S0168-1605(03)00322-2 |
| [24] | Ho HTK, Lipman LJA, Gaastra W. The introduction of Arcobacter spp. in poultry slaughterhouses[J]. Int J Food Microbiol, 2008, 125 (3) : 223–229. DOI:10.1016/j.ijfoodmicro.2008.02.012 |
| [25] | Atabay HI, Corry JEL, On SLW. Diversity and prevalence of Arcobacter spp. in broiler chickens[J]. J Appl Microbiol, 1998, 84 (6) : 1007–1016. DOI:10.1046/j.1365-2672.1998.00437.x |
| [26] | Houf K, de Zutter L, van Hoof J, et al. Occurrence and distribution of Arcobacter species in poultry processing[J]. J Food Prot, 2002, 65 (8) : 1233–1239. DOI:10.4315/0362-028X-65.8.1233 |
| [27] | Rahimi E. Prevalence and antimicrobial resistance of Arcobacter species isolated from poultry meat in Iran[J]. Br Poult Sci, 2014, 55 (2) : 174–180. DOI:10.1080/00071668.2013.878783 |
 2016, Vol. 31
2016, Vol. 31


