扩展功能
文章信息
- 孙逸, 缪梓萍, 严菊英, 陈奕娟, 茅海燕, 张严峻
- SUN Yi, MIAO Zi-ping, YAN Ju-ying, CHEN Yi-juan, MAO Hai-yan, ZHANG Yan-jun
- 2015年浙江省洞头区病毒性脑炎暴发疫情病原学研究
- Etiology of viral meningitis outbreak in Dongtou, Zhejiang, 2015
- 疾病监测, 2017, 32(2): 141-144
- Disease Surveillance, 2017, 32(2): 141-144
- 10.3784/j.issn.1003-9961.2017.02.014
-
文章历史
- 收稿日期:2016-08-30
病毒性脑炎 (viral encephalitis) 是由病毒引起的一组以精神和意识障碍为突出表现的中枢神经系统感染性疾病,轻者能自行缓解,危重者可导致后遗症及死亡。引起病毒性脑炎的主要病原是人类肠道病毒 (human enteroviruses,HEV)。根据以往研究发现,HEV已超过100种血清型,均可感染人类[1]。埃可病毒30型 (echovirus 30,ECHO30) 便是该病毒属的一个血清型,是近20年来引起世界各地病毒性脑炎最常见病原之一[2]。文献表明,在过去20年间全球范围已经出现多次由ECHO30引起的病毒性脑炎流行,涉及到欧洲、亚洲和美洲等地区[3-7]。2015年1011月浙江省温州市洞头区鹿西小学与中心幼儿园发生了疑似病毒性脑炎暴发疫情,现将该疫情病原学研究结果报告如下。
1 材料与方法 1.1 疫情概况11月1日,温州市洞头区疾病预防控制中心 (CDC) 接到疫情报告,该地区小学与幼儿园发生疑似病毒性脑炎病例,存在聚集性可能。接报后,温州市与洞头区CDC立即组织开展调查。(1) 本次疫情波及鹿西小学与鹿西中心幼儿园。共计396人。发病时间集中在10月30日至11月21日。(2) 首发病例于10月26日出现头痛,发热 (38 ℃),随后出现恶心、呕吐现象,前往医院就诊,初步诊断为病毒性脑炎并住院观察,脑电图异常。用甘露醇降压、利巴韦林抗病毒治疗,3 d后症状缓解,1~2周痊愈。(3) 患者均有发热、头痛、呕吐症状,27例有脑电图异常,2例胸片提示肺部感染。脑脊液显示无色透明清亮,糖及氯化物正常。
1.2 纳入标准与样本采集10月15日至11月21日,在鹿西小学和鹿西中心幼儿园学生中,临床表现为头痛、发热 (≥37.8 ℃)、恶心或呕吐症状、伴有不同程度的意识障碍或脑膜刺激征等为患者;密切接触者为与患者同班,位于邻近座位,但无临床症状。根据病例纳入标准,开展流行病学调查,并采集样本冷藏运送至实验室。
1.3 检测方法 1.3.1 HEV核酸检测采用德国Qiagen公司的病毒核酸提取试剂盒 (MagAttract Virus Mini M48 Kit),肛拭子/粪便样本进行预处理,制成20%悬液,取上清液提取核酸,咽拭子样本混匀后直接取样,按试剂说明书进行操作。采用实时荧光定量-聚合酶链反应 (real-time polymerase chain reaction,PCR) 检测HEV核酸[8],试剂为宝生物工程 (大连) 有限公司一步法荧光反转录聚合酶链式反应 (reverse transcription PCR,RT-PCR) 试剂盒 (RR064A)。
1.3.2 病毒分离与鉴定采用人横纹肌瘤细胞 (human rhabdomyosarcoma,RD) 和人喉表皮样癌细胞 (human epidermoid cancer cells,Hep-2)(均由中国CDC病毒病预防控制所脊髓灰质炎病毒室提供) 培养法分离HEV[9]。阳性分离物采用HEV real-time PCR方法进行鉴定。
1.3.3 VP1基因扩增HEV核酸阳性或病毒分离株采用RT-PCR方法扩增VP1基因并测序,试剂采用宝生物工程 (大连) 有限公司一步法RT-PCR KIT (RR055A)。引物序列和反应条件参考文献[10],扩增片段876 bp。
1.3.4 测序与进化分析采用PCR扩增产物纯化后直接测序,由生工生物工程 (上海) 股份有限公司完成。数据处理采用Geneious 8.1.7软件 (http://www.geneious.com/)。采用Mega 7.0.14软件基于距离法构建邻接进化树 (Neighbor-Joining, NJ),可信度评估采用1 000 bp值[10-11]。
2 结果 2.1 HEV核酸检测和病毒分离本次疫情发病病例共计32例,罹患率8.1%(32/396),共搜索到75名密切接触者,见表 1。对其进行采样,获得咽拭子50份、粪便/肛拭子90份。进行HEV核酸检测,核酸阳性35例 (41份),阳性率32.7%(35/107)。对核酸阳性的样本采用RD细胞和Hep-2细胞分离病毒,在RD细胞上出现病变,分离到23株ECHO30,病毒分离率65.7%(23/35)。测序结果经GenBank BLAST比对,均为ECHO30。
| 对象 | 采样 人数 |
阳性 例数 (%) |
样本种类 | HEV核酸阳性 (%)(1) | HEV分离阳性(2) | VP1测序 | |||||||
| 粪便/肛拭子 | 咽拭子 | 粪便/肛拭子 | 咽拭子 | 粪便/肛拭子 | 咽拭子 | 粪便/肛拭子 | 咽拭子 | ||||||
| 患者 | 32 | 30(93.8) | 30 | 32 | 21(70.0) | 15(46.9) | 16 | 7 | 19 | 8 | |||
| 密切接触者 | 75 | 5(6.7) | 60 | 18 | 4(6.7) | 1(5.6) | 3 | 1 | 3 | 1 | |||
| 合计 | 107 | 35(32.7) | 90 | 50 | 25(27.8) | 16(32.0) | 19 | 8 | 22 | 9 | |||
| 注:(1)6例患者粪便/肛拭子、咽拭子HEV核酸检测均为阳性;(2)4例患者粪便/肛拭子、咽拭子均分离到病毒。 | |||||||||||||
对31份电泳阳性条带进行部分VP1区域测序,发现这31份样本核苷酸序列呈100.0%高度同源。因此从31份阳性中随机挑选2份粪便/肛拭子和2份咽拭子,共计4株ECHO30 VP1区进行测序。获得4份全长876个核苷酸的序列,可以编码292个氨基酸。经过比对与联配,4株新分离株VP1全长之间的核苷酸和氨基酸同源性分别为99.9%~100.0%和99.7%~100.0%。新分离株与原型株 (Bastianni) 之间核苷酸和氨基酸的同源性分别为81.8%和92.1%。与浙江省2002-2014年ECHO30分离株之间的核苷酸和氨基酸同源性分别为91.4%~99.5%和98.4%~100.0%。其中这4条VP1全长序列与浙江省CHN/ZJ/RA-72/2013株序列同源性最高,核苷酸和氨基酸序列分别为99.4%~99.5%和99.7%~100.0%。
2.3 进化分析4株ECHO30测序数据已登录GenBank,登录号为DT-F-9-ECHO30/ZJ/2015:KX261884、DT-F-18-ECHO30/ZJ/2015:KX261885、DT-Y-17-ECHO30/ZJ/2015:KX261886和DT-Y-9-ECHO30/ZJ/2015:KX261887。4株ECHO30与浙江省历年ECHO30分离株和GenBank下载的不同时期、不同国家毒株序列构建进化树 (图 1)。从VP1基因进化树可见,浙江省ECHO30明显分成两簇,分别位于进化支Ⅰ(GⅠ) 和Ⅱ(GⅡ) 分支。新分离ECHO30与2株浙江省2013-2014年ECHO30紧密聚集在一起,并位于GⅠ分支上 (图 1)。而与浙江省2002-2004年分离株如AY695093|SEB-24-E30/ZJ/2002和AY879321|LH-63-E30/ZJ/2004等GⅡ进化支的ECHO30亲缘关系相对较远。
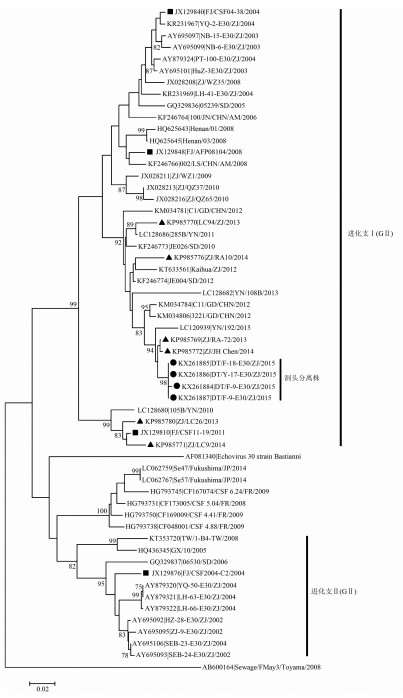
|
| 图 1 ECHO30分离株VP1区进化分析结果 Figure 1 Phylogenetic analysis on VP1 region of ECHO30 isolates 注:浙江省ECHO30分离株采用VP1全长核苷酸序列 (876 bp) 与GenBank下载的ECHO30毒株序列采用NJ构建进化树,boostrap值取1 000;●为本次疫情分离株;▲为浙江省2013-2014年分离株;■为福建分离株;其他为GenBank上的下载序列。 |
| |
本研究对温州市洞头区鹿西乡小学与中心幼儿园疑似病毒性脑炎暴发疫情进行病原学研究,32例患者样本中ECHO30阳性率为93.8%(30/32),明显高于75名密切接触者的阳性率6.7%(5/75),从140份样本中分离到23株病毒,获得了4份VP1全长序列,BLAST比对均为ECHO30。在病毒性脑炎实验室诊断中,从脑脊液中检测到病毒或核酸为确诊病例的金标准,而咽拭子或粪便中检测到病原仅只有提示作用,由于脑脊液的采集是一种创伤性取样,在实际工作中有一定的困难,未采集到脑脊液进行分析是本研究的一个缺陷。但在33名采集到两类样本的被调查者中,同时检测到ECHO30阳性的有6名 (18.2%);31份HEV VP1部分序列测定,均为ECHO30,且核苷酸同源性达100.0%,因此检测结果表明引起该起疫情的病原为ECHO30。
ECHO30是一个无包膜的正单链RNA病毒。与其他肠道病毒类似,VP1~VP3蛋白暴露在衣壳表面,是抗原决定簇的存在部位,带有中和抗原活性和特异性抗原位点。其中又以VP1蛋白为最重要的抗原表位研究对象,这是由于VP1是主要的病毒抗原决定簇,VP1基因的遗传多样性与病毒血清型也完全对应,常被作为肠道病毒属内不同血清型的分类依据[12]。因此,对该段序列的研究是毒株分型及其变异规律分析的有效手段之一[13]。本研究对ECHO30分离株进行VP1区测序分析,新分离株与原型株Bastianni之间核苷酸和氨基酸的同源性分别为81.8%和92.1%,根据肠道病毒同一血清型核苷酸和氨基酸同源性应分别超过75%和88%的原则[14],从分子水平上证实本次疫情的病原为ECHO30。由于4株ECHO30之间VP1区核苷酸和氨基酸同源性很高,分别为99.9%~100.0%和99.7%~100.0%,提示引起鹿西乡小学与中心幼儿园疫情的病原属于同一个传染来源。
浙江省自2002年以来,通过设立监测点开展对病毒性脑炎病原的监测。之前笔者团队基于VP1基因对2002-2012年引起无菌性脑炎的肠道病毒进行分型与研究,发现ECHO30已经分化成两个差异显著的进化支GⅠ和GⅡ。GⅠ从2002年至今一直存在于浙江省地区,GⅡ主要出现在2002-2004年的暴发疫情。基于VP1系统发育树的结果表明本次洞头地区疫情的ECHO30属于GⅠ,与浙江省2013-2014年ECHO30分离株ZJ/RA-72/2013和ZJ/JH Chen/2014具有较近的系统发育关系,进化分析提示:引起本次疫情的ECHO30与浙江省之前多次引起疑似病毒性脑炎暴发疫情的病原一致,均来源于近几年在当地环境中循环的ECHO30病原[10-12]。国外文献对福建省2001-2011年期间流行的ECHO30进行分子流行病学分析发现,福建地区已出现包括E-30_h和E-30_i在内的不同基因谱系的ECHO30。这些不同基因谱系的福建分离株在本次研究中分别属于进化支Ⅰ(JX129840|FJ/CSF04-38/2004、JX129848|FJ/AFP08104/2008和JX129810|FJ/CSF11-19/2011) 以及进化支Ⅱ (JX129876|FJ/CSF2004-C2/2004)(图 1)[15]。这些福建株在各个进化分支中与相对应的浙江株的同源性较高。结果提示ECHO30病原一直存在浙江、福建等中国东南部沿海地区,范围广,活动强度较大,隐性感染水平高,常引起病毒性脑炎散发病例和暴发疫情[8-9, 12],且ECHO30病原在分子水平上出现了多个由不同基因亚型组成的基因谱系,而在不同地区之间的ECHO30谱系享有较高的同源性。因此,建议加强病毒性脑炎病例监测,特别是需进一步加强跨省合作,及时掌握流行于省际和省内病原体的遗传变异及致病性改变,为该病的预警及防控提供科学依据。
作者贡献:
孙逸 ORCID:0000-0001-7549-8286
孙逸:ECHO30检测、生物信息学分析、论文撰写
缪梓萍:实验设计、流行病学调查
严菊英:实验设计、ECHO30细胞培养病毒分离、序列测定、论文修改
陈奕娟:流行病学调查、样本采集
茅海燕:ECHO30检测
张严峻:实验方案确定
| [1] | Kumar A, Shukla D, Kumar R, et al. Molecular epidemiological study of enteroviruses associated with encephalitis in children from India[J]. J Clin Microbiol , 2012, 50 (11) : 3509–3512. DOI:10.1128/JCM.01483-12 |
| [2] | Peigue-Lafeuille H, Croquez N, Laurichesse H, et al. Enterovirus meningitis in adults in 1999-2000 and evaluation of clinical management[J]. J Med Virol , 2002, 67 (1) : 47–53. DOI:10.1002/jmv.v67:1 |
| [3] | Savolainen C, Hovi T, Mulder MN. Molecular epidemiology of echovirus 30 in Europe: succession of dominant sublineages within a single major genotype[J]. Arch Virol , 2001, 146 (3) : 521–537. DOI:10.1007/s007050170160 |
| [4] | Carrol ED, Beadsworth MBJ, Jenkins N, et al. Clinical and diagnostic findings of an echovirus meningitis outbreak in the north west of England[J]. Postgrad Med , 2006, 82 (963) : 60–64. DOI:10.1136/pgmj.2005.036608 |
| [5] | Choi YJ, Park KS, Baek KA, et al. Molecular characterization of echovirus 30-associated outbreak of aseptic meningitis in Korea in 2008[J]. J Microbiol Biotechnol , 2010, 20 (3) : 643–649. |
| [6] | dos Santos GPL, Skraba I, Oliveira D, et al. Enterovirus meningitis in Brazil, 1998-2003[J]. J Med Virol , 2006, 78 (1) : 98–104. DOI:10.1002/(ISSN)1096-9071 |
| [7] | dos Santos GPL, da Costa EV, Tavares FN, et al. Genetic diversity of echovirus 30 involved in aseptic meningitis cases in Brazil (1998-2008)[J]. J Med Virol , 2011, 83 (12) : 2164–2171. DOI:10.1002/jmv.v83.12 |
| [8] | Yan JY, Miao ZP, Lyu HK, et al. Etiology and molecular-epidemiological characteristics of viral meningoencephalitis of Zhejiang province in 2013[J]. Chinese Journal of Epidemiology , 2015, 36 (3) : 280–284. (in Chinese) 严菊英, 缪梓萍, 吕华坤, 等. 浙江省2013年病毒性脑膜脑炎病原学及分子流行病学特征[J]. 中华流行病学杂志 , 2015, 36 (3) : 280–284. |
| [9] | Yang XH, Yan YS, Weng YW, et al. Molecular epidemiology of echovirus 30 in Fujian, China between 2001 and 2011[J]. J Med Virol , 2013, 85 (4) : 696–702. DOI:10.1002/jmv.v85.4 |
| [10] | Kumar S, Stecher G, Tamura K. Mega 7: molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Mol Biol Evol , 2016, 33 (7) : 1870–1874. DOI:10.1093/molbev/msw054 |
| [11] | Posada D, Crandall KA. Modeltest: testing the model of DNA substitution[J]. Bioinformatics , 1998, 14 (9) : 817–818. DOI:10.1093/bioinformatics/14.9.817 |
| [12] | Baily JL, Mirand A, Henquell C, et al. Phylogeography of circulating populations of humanechovirus 30 over 50 years: nucleotide polymorphism and signature of purifying selection in the VP1 capsid protein gene[J]. Infect Genet Evol , 2009, 9 (4) : 699–708. DOI:10.1016/j.meegid.2008.04.009 |
| [13] | Thoelen I, Moes E, Lemey P, et al. Analysis of the serotype and genotype correlation of VP1 and the 5 noncoding region in an epidemiological survey of the human enterovirus B species[J]. J Clin Microbiol , 2004, 42 (3) : 963–971. DOI:10.1128/JCM.42.3.963-971.2004 |
| [14] | Oberste MS, Maher K, Kilpatriek DR, et al. Molecular evolution of the human enteroviruses: correlation of serotype with VP1 sequence and application to pieornavirus classification[J]. J Virol , 1999, 73 : 1941–1948. |
| [15] | Yan JY, Miao ZP, Lyu HK, et al. Etiological and molecular-epidemiological analysis on enterovirus associated encephalitis in Zhejiang, 2008-2012[J]. Chinese Journal of Epidemiology , 2013, 34 (12) : 1189–1193. (in Chinese) 严菊英, 缪梓萍, 吕华坤, 等. 浙江省2008-2012年肠道病毒相关病毒性脑炎病原谱及分子流行病学特征分析[J]. 中华流行病学杂志 , 2013, 34 (12) : 1189–1193. |
 2017, Vol. 32
2017, Vol. 32


