扩展功能
文章信息
- 朱可, 张瑾, 薛晓宁, 徐翮飞, 陈晓光, 张娟
- ZHU Ke, ZHANG Jin, XUE Xiao-ning, XU He-fei, CHEN Xiao-guang, ZHANG Juan
- 2009-2015年青岛国际旅行者中乙型肝炎和丙型肝炎病毒感染的血清流行病学调查
- Sero-epidemiology of hepatitis B and C virus infections in international travelers in Qingdao
- 疾病监测, 2017, 32(3): 222-226
- Disease Surveillance, 2017, 32(3): 222-226
- 10.3784/j.issn.1003-9961.2017.03.013
-
文章历史
- 收稿日期:2016-08-26
2. 青岛机场出入境检验检疫局/山东出入境检验检疫局, 山东 青岛 266071
2. Qingdao Airport Entry-Exit Inspection and Quarantine Bureau, Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266071, Shandong, China
随着改革开放,中国与世界各地的交流与合作日益增强,出入境人员数量剧增,国际旅行者可作为传染源导致目的地国家新发传染病的暴发流行,还可导致目的地国家已有传染病出现新的基因型,甚至可能改变目的地国家传染病的分子流行病特征。有研究报道,丙型肝炎 (丙肝) 病毒 (hepatitis C virus,HCV)6a亚型主要通过越南移民传入我国南部及西南部地区,成为该地区吸毒人员中HCV的主要流行株[1]。加强国际旅行者中重要传染病的监测,了解传染病感染现状以及危险因素,制定相应的防控策略,对延缓甚至避免输入性传染病在我国的暴发流行具有重要的社会意义。
乙型肝炎 (乙肝) 病毒 (hepatitis B virus,HBV) 和HCV引起的病毒性肝炎已成为全球严重的公共卫生问题[2-3]。乙肝是我国重点防控的传染病,每年约有30万人死于乙肝相关疾病,占全球乙肝相关疾病死亡总数的40%~50%[2]。全球疾病调查估计中国丙肝抗体阳性率达到3.20%[4]。HBV和HCV感染者通常缺乏症状或处于亚临床状态,甚至需要数十年才发展为病毒性肝炎。因此,对HBV和HCV感染的监测是有效控制疾病传播和及时有效治疗的重要手段。口岸检疫机构长期以来也将乙肝和丙肝列为国际旅行者中传染病监测的重点疾病,是我国乙肝和丙肝防控的重要补充。
本研究对2009-2015年青岛口岸23 720名入境人员血浆乙肝表面抗原 (HBV surface antigen,HBsAg)、血浆抗HCV抗体 (抗-HCV)、血浆谷丙转氨酶 (alanine aminotransferase,ALT) 检测结果进行了描述性调查分析,探讨了青岛国际旅行者HBV和HCV感染的血清流行病学特点以及影响因素,现将分析结果报告如下。
1 对象与方法 1.1 对象以2009-2015年山东省青岛口岸23 720名申请来华居留1年或1年以上的入境人员为研究对象。
1.2 方法收集2009-2015年青岛口岸入境人员的基本信息及实验室检测结果。本研究收集的所有个人信息以及开展的相关检测项目均在知情同意情况下进行,并对个人信息以及具体检测结果实行保密原则。
受试者清晨空腹在无菌条件下采集5 ml肝素抗凝血,离心法分离血浆,血浆中HBsAg检测使用酶联免疫吸附法,试剂购于丽珠医药集团公司,严格遵守试剂说明书进行操作并在有效期内使用。血浆中抗-HCV检测使用酶联免疫吸附法,试剂购于英科新创科技有限公司。血浆ALT含量采用罗氏全自动生化仪 (Roche Modular PE P800) 酶法测定。ALT正常值范围男性9~50 IU/L,女性7~40 IU/L。
1.3 统计学分析采用SPSS 16.0软件进行分析。χ2检验用于HBsAg阳性和抗-HCV阳性检出的单因素分析,以及HBsAg阳性和抗-HCV阳性者性别与ALT异常间关系的分析。非条件logistic回归用于多因素分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 研究对象地域分布本研究共收集来自五大洲入境人员的23 720份样本,见表 1。其中男女性别比为1.94 : 1,年龄分布6~96岁,平均年龄为 (37.27±12.72) 岁。2013 2015年来自非洲的国际旅行者所占百分比明显升高,见表 1。
| 人群 | 2009- 2012年 |
2013- 2015年 |
合计 | 男性构 成比 (%) |
女性构 成比 (%) |
| 亚洲 | 10 186 | 7 483 | 17 669 | 67.00 | 33.00 |
| 非洲 | 329 | 778 | 1 107 | 86.45 | 13.55 |
| 欧洲 | 1 476 | 1 205 | 2 681 | 63.48 | 36.52 |
| 大洋洲 | 245 | 206 | 451 | 63.63 | 36.37 |
| 美洲 | 1 003 | 809 | 1 812 | 63.19 | 36.81 |
| 合计 | 13 239 | 10 481 | 23 720 | 65.99 | 34.01 |
本研究受试人群中HBsAg阳性率2.81%(667/23 720),抗-HCV阳性率0.46%(109/23 720)。未在受试人群中检出HBsAg阳性合并抗-HCV阳性。
2.3 HBsAg和抗-HCV阳性人群地域分布入境人群HBsAg阳性或抗-HCV阳性检出具有不同的地域分布特点。来自于五大洲的入境人员中均有HBsAg阳性检出,检出率最高的非洲为6.08%,最低的欧洲为0.48%,不同地区人群间HBsAg阳性检出率差异有统计学意义;来自亚洲和美洲入境人群中的抗-HCV阳性率最高,分别为0.51%和0.50%,来自大洋洲的入境人群中未检出抗-HCV阳性,抗-HCV阳性检出率各地区间差异无统计学意义,见表 2。与中国大陆临近的亚洲其他国家与地区中,HBsAg阳性率最高的3个国家或地区依次是蒙古9.76%、中国台湾9.22%和中国香港5.76%;抗-HCV阳性率最高的依次是蒙古10.97%、中国台湾1.48%和印度1.20%。
| 人口 特点 |
合计 | HBsAg | 抗-HCV | |||||||||
| 例数 (n=667) |
阳性率 (%) |
95%CI | χ2值 | P值 | 例数 (n=109) |
阳性率 (%) |
95%CI | χ2值 | P值 | |||
| 性别 | 32.582 | 0.000 | 1.305 | 0.304 | ||||||||
| 女 | 8 067 | 158 | 1.96 | 1.66~2.26 | 32 | 0.40 | 0.26~0.54 | |||||
| 男 | 15 653 | 509 | 3.25 | 2.97~3.53 | 77 | 0.49 | 0.38~0.60 | |||||
| 年龄组 (岁) | 152.341 | 0.000 | 49.961 | 0.000 | ||||||||
| < 20 | 2 271 | 16 | 0.70 | 0.36~1.04 | 4 | 0.18 | 0.01~0.35 | |||||
| 20~ | 5 896 | 88 | 1.49 | 1.18~1.80 | 18 | 0.31 | 0.17~0.45 | |||||
| 30~ | 6 214 | 180 | 2.90 | 2.48~3.32 | 13 | 0.21 | 0.10~0.32 | |||||
| 40~ | 5 446 | 247 | 4.54 | 3.99~5.09 | 32 | 0.59 | 0.39~0.79 | |||||
| 50~ | 2 891 | 105 | 3.63 | 2.95~4.31 | 29 | 1.00 | 0.64~1.36 | |||||
| ≥60 | 1 002 | 31 | 3.09 | 2.02~4.16 | 13 | 1.30 | 0.60~2.00 | |||||
| 地区 | 132.283 | 0.000 | 7.293 | 0.122 | ||||||||
| 亚洲 | 17 669 | 564 | 3.19 | 3.10~3.64 | 90 | 0.51 | 0.40~0.62 | |||||
| 非洲 | 1 107 | 67 | 6.05 | 2.21~4.29 | 1 | 0.09 | 0.00~0.27 | |||||
| 大洋洲 | 451 | 7 | 1.55 | 0.41~2.69 | 0 | 0.00 | 0.00 | |||||
| 欧洲 | 2 681 | 13 | 0.48 | 0.22~0.74 | 9 | 0.34 | 0.12~0.56 | |||||
| 美洲 | 1 812 | 16 | 0.88 | 0.45~1.31 | 9 | 0.50 | 0.18~0.82 | |||||
| 旅行目的 | 57.893 | 0.000 | 2.071 | 0.832 | ||||||||
| 定居 | 2 781 | 95 | 3.41 | 1.96~3.14 | 16 | 0.57 | 0.17~0.63 | |||||
| 商务 | 485 | 10 | 2.06 | 0.52~2.78 | 3 | 0.61 | 0.00~0.98 | |||||
| 劳务 | 15 214 | 493 | 3.24 | 2.13~2.61 | 65 | 0.42 | 0.20~0.36 | |||||
| 留学 | 4 514 | 60 | 1.33 | 0.82~1.44 | 22 | 0.48 | 0.16~0.50 | |||||
| 旅行 | 607 | 8 | 1.32 | 0.30~2.00 | 3 | 0.49 | 0.00~1.05 | |||||
| 其他 | 119 | 1 | 0.84 | 0.00~2.48 | 0 | 0.00 | 0.00 | |||||
HBsA g男性中阳性率为3.25%(509/15 653) 明显高于女性 (1.96%)(χ2=32.582,P=0.000);抗-HCV在男性中阳性率略高于女性,差异无统计学意义 (χ2=1.305,P=0.304)。HBsAg和抗-HCV阳性率随年龄变化趋势有所不同,HBsAg阳性率在<20岁年龄组最低,仅为0.70%,40~岁年龄组阳性率最高 (4.54%),随年龄增长阳性率呈下降趋势。相反,抗-HCV阳性率总体呈缓慢增长,随年龄增长阳性率升高,≥60岁组阳性率最高为1.30%,见表 2。
2.5 多因素相关性分析将χ2检验有统计学意义的单因素 (P < 0.05) 纳入多因素非条件logistic回归,采用前进法对变量进行分析。多因素分析发现国际旅行者中HBsAg阳性检出与性别、年龄、地域相关,抗-HCV阳性检出仅与年龄相关,见表 3、4。
| 变量 | β | sx | Wald χ2值 | P值 | OR值 | 95%CI |
| 性别 | ||||||
| 男 | - | - | - | - | 1.000 | - |
| 女 | -0.273 | 0.110 | 6.124 | 0.013 | 0.761 | 0.614~0.945 |
| 地区 | 51.396 | < 0.000 1 | ||||
| 亚洲 | - | - | - | - | 1.000 | - |
| 非洲 | 0.732 | 0.219 | 11.180 | 0.001 | 2.079 | 1.354~3.192 |
| 大洋洲 | -1.125 | 1.008 | 1.245 | 0.265 | 0.325 | 0.045~2.342 |
| 欧洲 | -1.460 | 0.295 | 24.494 | < 0.000 1 | 0.232 | 0.130~0.414 |
| 北美洲 | -0.828 | 0.232 | 12.770 | < 0.000 1 | 0.437 | 0.278~0.688 |
| 南美洲 | -17.714 | 4 832.829 | 0.000 | 0.997 | 0.000 | 0.000 |
| 年龄组 (岁) | 53.902 | < 0.000 1 | ||||
| < 20 | - | - | - | - | 1.000 | - |
| 20~ | 0.756 | 0.319 | 5.626 | 0.018 | 2.131 | 1.140~3.981 |
| 30~ | 1.307 | 0.304 | 18.553 | < 0.000 1 | 3.697 | 2.039~6.701 |
| 40~ | 1.626 | 0.301 | 29.106 | < 0.000 1 | 5.083 | 2.816~9.176 |
| 50~ | 1.488 | 0.314 | 22.484 | < 0.000 1 | 4.428 | 2.394~8.190 |
| ≥60 | 1.317 | 0.364 | 13.124 | < 0.000 1 | 3.733 | 1.830~7.612 |
| 常数项 | -4.547 | 0.294 | 239.722 | < 0.000 1 | 0.011 | - |
| 注:“-”表示无数据。 | ||||||
| 变量 | β | sx | Wald χ2值 | P值 | OR值 | 95%CI |
| 年龄组 (岁) | 22.911 | < 0.000 1 | ||||
| < 20 | - | - | - | - | 1.000 | - |
| 20~ | 0.400 | 0.646 | 0.384 | 0.536 | 1.492 | 0.420~5.297 |
| 30~ | -0.199 | 0.678 | 0.086 | 0.769 | 0.820 | 0.217~3.094 |
| 40~ | 0.762 | 0.622 | 1.502 | 0.220 | 2.143 | 0.633~7.254 |
| 50~ | 1.449 | 0.620 | 5.462 | 0.019 | 4.260 | 1.263~14.365 |
| ≥60 | 1.432 | 0.692 | 4.287 | 0.038 | 4.187 | 1.080~16.241 |
| 常数项 | -6.079 | 0.578 | 110.616 | < 0.000 1 | 0.002 | |
| 注:“-”表示无数据。 | ||||||
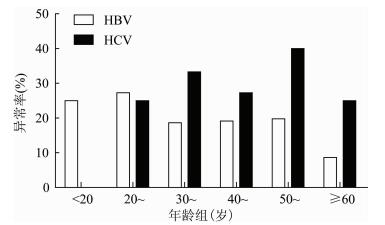
研究人群中ALT总异常率为10.55%。抗-HCV阳性人群ALT异常率 (26.61%) 略高于HBsAg阳性人群 (20.23%),但差异无统计学意义 (χ2=3.784,P=0.663)。抗-HCV和HBsAg阳性人群中,ALT异常率在男性中明显高于女性 (P=0.000),见表 5。HBsAg阳性人群中,ALT异常率最高出现在青壮年组 (20~岁);抗-HCV阳性人群中,ALT异常率最高出现在中老年组 (50~岁),见图 1。
| 性别 | HBsAg阳性人群 | 抗-HCV阳性人群 | |||
| ALT异常率 (%) |
ALT水平 (IU/L) |
ALT异常率 (%) |
ALT水平 (IU/L) |
||
| 男 | 23.18 | 80.82±64.64 | 31.17 | 103.42±60.82 | |
| 女 | 10.76 | 102.91±93.43 | 15.63 | 180.74±192.21 | |
|
| 图 1 不同年龄组HBsAg和anti-HCV阳性人群中ALT异常率 Figure 1 Age and gender-specific proportion of elevated alanine aminotransferase |
| |
本研究多因素分析结果显示,国际旅行者中HBsAg阳性检出与性别、年龄、地域均相关。男性中HBsAg阳性检出明显高于女性,差异有统计学意义,与文献报道一致[5]。可能由于雄性激素促进HBsAg的表达,促使细胞逃避机体免疫系统的防御,导致HBV的慢性携带[6]。年龄因素中,HBsAg阳性率在青少年组最低,中年组达到峰值,随后随年龄增长阳性率呈下降趋势,此结果与我国目前HBsAg阳性率调查结果一致[7-8],1992年世界卫生组织 (WHO) 发起在全世界范围内对新生儿实施的乙肝计划免疫导致青少年中HBV感染率显著下降。本研究中来自于非洲和亚洲的国际旅行者具有相对较高的阳性率,与其他相关报道一致[2],大部分非洲和亚洲的国家属于HBV高/中感染区[9]。针对这些特点,从疾病监测的角度,应加强对来自非洲和亚洲的中年男性HBV感染的监测和干预;从疾病预防的角度,我国属于乙肝的高感染区,国际旅行者面临感染HBV的高风险,建议口岸检疫机构对健康的国际旅行者加强防病知识宣传,并在知情同意的原则下,对有需求的国际旅行者实施乙肝疫苗成人免疫[10]。
我们的研究发现抗-HCV阳性检出仅与年龄相关。抗-HCV阳性率在青壮年呈缓慢增长状态,随年龄增长阳性率升高,≥60岁年龄组阳性率最高,这一变化趋势与大部分国家HCV流行特点相似[11]。血液传播是HCV最主要的传播途径,1989年美国Chiron公司首次发现HCV,但直到1992年,输血、血液制品或器官移植前进行HCV筛查才在全球范围内普遍应用。在此之前接受过输血、使用未经严格消毒的牙科器械、内镜检查、侵袭性操作的人都是感染丙肝的高危人群,目前该人群已经步入老龄[12]。老年人免疫系统功能相对衰退,加之大多存在其他疾病,对治疗药物耐受性低,一旦感染HCV,可能造成更加严重的危害。因此,在未来对HCV的监测工作中,应加强对60岁以上的老年人口感染现状的监测。
中国大陆周边的国家和地区中,来自蒙古的入境人员中HBsAg和抗-HCV都具有最高的阳性率 (9.76%,11.20%)。由于对医疗和牙科设备灭菌和消毒不当,病毒性肝炎在蒙古存在大范围流行,在健康人群中抗-HCV阳性率达15.60%[13],未接种乙肝疫苗人群中HBV感染率达到11.80%[14]。提示我们应针对性地加强该地区旅行者HBV和HCV感染防制知识宣传,在饮食、生活方式、用药等方面进行健康指导。
口岸检疫机构目前仍限于用血清学检测对HBV或HCV感染者进行筛查,对于筛查出的血清学阳性样本缺乏进一步的明确诊断,导致一些慢性乙肝和丙肝患者不能及时确诊,也无法得到及时的治疗和干预。建议实验室加强病毒核酸检测能力,阳性样本应进一步结合血浆ALT水平以及血清中病毒核酸进行明确诊断。对确诊的慢性乙肝或丙肝病例,及时告知并提供健康咨询,按规定向当地疾病预防控制中心报告;同时还应加强与地方卫生机构合作,对有需要的患者提供转诊服务。对非活动性HBsAg携带者、慢性HBV感染者和仅HCV抗体阳性者分别参照慢性乙肝防治指南和丙肝防治指南中的随访原则,在知情同意的原则下,进行随访。
2015年11月,WHO提出“到2030年消除作为公共卫生威胁的病毒性肝炎”的目标[15]。国境口岸的传染病监测系统作为全国传染病监测系统的一个重要补充,将国际旅行者作为监测的对象,获得这一特殊人群中HBsAg阳性率和抗-HCV阳性率及相关影响因子等基础数据,将为制定特别针对口岸入境人群病毒性肝炎的干预措施提供参考,这也是减少国际间病毒性肝炎传播的关键。
作者贡献:
朱可 ORCID:0000-0003-3718-4213
朱可:研究设计,论文撰写
张瑾:统计分析,论文撰写
徐翮飞:生化试验
薛晓宁:流行病调查
陈晓光:乙肝表面抗原检测
张娟:丙肝抗体检测
| [1] | Fu YS, Qin WB, Cao H, et al. HCV 6a prevalence in Guangdong province had the origin from Vietnam and recent dissemination to other regions of China: phylogeographic analyses[J]. PLoS One, 2012, 7(1): e28006. DOI:10.1371/journal.pone.0028006 |
| [2] | Ott JJ, Stevens GA, Groeger J, et al. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity[J]. Vaccine, 2012, 30(12): 2212–2219. DOI:10.1016/j.vaccine.2011.12.116 |
| [3] | Gower E, Estes C, Blach S, et al. Global epidemiology and genotype distribution of the hepatitis C virus infection[J]. J Hepatol, 2014, 61 Suppl 1: S45–57. |
| [4] | The Ministry of Health of the People's Republic of China. China health statistics yearbook[M]. Beijing: Peking Union Medical College Press, 2006: 236-237. (in Chinese) 中华人民共和国卫生部. 中国卫生统计年鉴[M]. 北京: 中国协和医科大学出版社, 2006: 236-237. |
| [5] | Pereira LM, Martelli CM, Merchan-Hamann E, et al. Population-based multicentric survey of hepatitis B infection and risk factor differences among three regions in Brazil[J]. Am J Trop Med Hyg, 2009, 81(2): 240–247. |
| [6] | Farza H, Salmon AM, Hadchouel M, et al. Hepatitis B surface antigen gene expression is regulated by sex steroids and glucocorticoids in transgenic mice[J]. Proc Natl Acad Sci USA, 1987, 84(5): 1187–1191. DOI:10.1073/pnas.84.5.1187 |
| [7] | Liang XF, Bi SL, Yang WZ, et al. Epidemiological serosurvey of hepatitis B in China-Declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2009, 27(47): 6550–6557. DOI:10.1016/j.vaccine.2009.08.048 |
| [8] | Liu J, Zhang SK, Wang QM, et al. Seroepidemiology of hepatitis B virus infection in 2 million men aged 21-49 years in rural China: a population-based, cross-sectional study[J]. Lancet Infect Dis, 2016, 16(1): 80–86. DOI:10.1016/S1473-3099(15)00218-2 |
| [9] | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures[J]. J Viral Hepat, 2004, 11(2): 97–107. DOI:10.1046/j.1365-2893.2003.00487.x |
| [10] | World Health Organization. Hepatitis B vaccines: WHO position paper[EB/OL].(2009-10-02)[2016-08-20]. http://www.who.int/wer/2009/wer8440/en/. |
| [11] | Alter MJ. Epidemiology of hepatitis C virus infection[J]. World J Gastroenterol, 2007, 13(17): 2436–2441. DOI:10.3748/wjg.v13.i17.2436 |
| [12] | Ghany MG, Strader DB, Thomas DL, et al. Diagnosis, management, and treatment of hepatitis C: an update[J]. Hepatology, 2009, 49(4): 1335–1374. DOI:10.1002/hep.22759 |
| [13] | Baatarkhuu O, Kim DY, Ahn SH, et al. Prevalence and genotype distribution of hepatitis C virus among apparently healthy individuals in Mongolia: a population-based nationwide study[J]. Liver Int, 2008, 28(10): 1389–1395. DOI:10.1111/j.1478-3231.2008.01820.x |
| [14] | Nymadawa P. Hepatitis B vaccination: worldwide and in Mongolia 2004[C]//Proceedings of the 10th National Conference on "Current Topics of Virology". Ulaanbaatar, Mongolia. 2004. |
| [15] | World Health Organization. Prevention and control of viral hepatitis infection: framework for global action[EB/OL].(2015-11-03)[2016-08-20]. http://www.who.int/hiv/pub/hepatitis/Framework/en/. |
 2017, Vol. 32
2017, Vol. 32


