扩展功能
文章信息
- 李华, 王艳, 王毅, 叶长芸
- LI Hua, WANG Yan, WANG Yi, YE Chang-yun
- 农贸市场中蜚蠊携带单增李斯特菌的调查及菌株特征分析
- Phenotypic and genotypic characteristics of L. monocytogenes isolates from cockroaches in farm produce market
- 疾病监测, 2017, 32(4): 318-322
- Disease Surveillance, 2017, 32(4): 318-322
- 10.3784/j.issn.1003-9961.2017.04.015
-
文章历史
- 收稿日期:2017-03-17
李斯特菌 (Listeria) 是一种兼性厌氧、革兰阳性菌,常见的包括单增李斯特菌 (L.monocytogenes)、伊氏李斯特菌 (L.ivanovii)、英诺克李斯特菌 (L.innocua)、威尔李斯特菌 (L.welshimeri)、西尔李斯特菌 (L.seeligeri) 和格氏李斯特菌 (L.grayi)。其中对人致病的主要为单增李斯特菌 (Listeria monocytogenes),它能引起人类的严重感染[1-2],导致败血症、脑膜炎、肠胃炎以及新生儿感染等[3-4],感染后发病的死亡率约为25%[5]。李斯特菌可广泛分布于各种食物产品中,如肉类、蔬菜、海产品、牛奶和奶制品等[6-9]。李斯特菌病的发生多数是由于食品污染单增李斯特菌引起的。1981年,在加拿大李斯特菌病的暴发首次证实了单增李斯特菌可以通过食物在人群中传播[10]。在中国,2012-2013年对北京市西城区食品中单增李斯特菌的携带调查中发现,检出率最高的为生禽畜肉,高达32.35%[11],调查农贸市场中生禽畜肉单增李斯特菌污染的来源从而降低其污染迫在眉睫。近年来加工环境和零售环境中的李斯特菌能导致食品的持续污染已经被证实[12-13]。但是关于市场中食品李斯特菌污染的危险因素调查却很少见,尤其是对市场内广泛活跃的蜚蠊是否能携带并传播李斯特菌以及是否可成为销售市场中食品污染的危险因素的研究很少,目前在中国尚未见报道。同时,蜚蠊具有传播病原菌的高危行为和特性,如活动广泛,喜好以垃圾、排泄物等为食[14]。为了解农贸市场中蜚蠊李斯特菌的携带情况及单增李斯特菌的分子特征,本研究采集了147份北京某肉类 (猪肉、牛羊肉、鸡肉) 和水产品销售市场中的蜚蠊样本,进行李斯特菌的分离鉴定,并对分离到的单增李斯特菌进行血清型、脉冲场凝胶电泳 (pulsed-field gel electrophoresis,PFGE)、多位点序列分型 (multilocus sequence typing,MLST) 分析。
1 材料与方法 1.1 样品来源2015年10-12月从北京市某肉类 (猪肉、牛羊肉、鸡肉) 及水产品销售市场共采集蜚蠊样本147份,每10~15只蜚蠊为1份样本。
1.2 试剂和主要仪器FRASER BROTH BASE、BRILLIANCETM LISTERIA AGAR BASE培养基 (英国Oxoid);脑心浸液 (北京陆桥);DNA提取试剂盒、2×Taq MasterMix (北京康为世纪生物科技);Gel Doc XR凝胶成像仪 (美国伯乐公司);凝胶成像系统 (GEL-Doc, 美国Bio-Rad);PCR仪 (德国圣欧国际),引物由北京天一辉远生物科技有限公司合成。
1.3 李斯特菌的分离培养按照国际标准ISO11290 (Anonymous, 1997) 的方法进行操作,有部分改动。样本共进行2次增菌培养。将10 ml一次增菌液 (Half Fraser) 加入装有采集的蜚蠊样本 (提前碾碎) 的无菌自封袋中,揉搓并静置浸泡5 min,然后将一次增菌液倒入50 ml离心管中,在恒温摇床中220 r/min、30 ℃培养24 h,吸取1 ml一次增菌液加入到装有5 ml的二次增菌液 (Fraser) 中,220 r/min、37 ℃培养48 h。用一次性接种环蘸取二次增菌液体 (混匀) 并接种到显色固体培养基上,37 ℃培养24 h后,在显色培养基上挑取可疑菌落 (周围有晕环的蓝绿色菌落) 于脑心浸液固体培养基中进行纯化培养,37 ℃培养24 h[15]。
1.4 菌株的鉴定细菌在脑心浸液培养基上纯化培养后,取适量纯培养物加入到200 μl无菌去离子水中,振荡混匀后100 ℃水浴15 min,13 000 r/min离心3 min,提取上清液为DNA模板,-20 ℃保存备用。用李斯特菌属和种的特异性引物进行PCR鉴定,引物序列见表 1。PCR体系 (20 μl):2 ×Taq Master Mix 10 μl,上下游引物 (10 μmol/L) 各1 μl、模板DNA 1 μl,无菌去离子水补充至20 μl。反应条件:94 ℃预变性4 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,共进行30个循环;72 ℃延伸10 min。
| 引物名称 | 引物序列 (5′-3′) | 种类 |
| lmo0733-F | GTT CTC ATA CAA TAG TGA TAA CAA CTG | L.monocytogenes |
| lmo0733-R | CAT AAC AGT TTC TCC AAG CAA AGT | |
| lin0464-F | CGC ATT TAT CGC CAA AAC TC | L. innocua |
| lin0464-R | TCG TGA CAT AGA CGC GAT TG | |
| Lwe1801-F | GAT CAT TGG AAA AGC GTT TCT AGT G | L. welshmeri |
| Lwe1801-R | CAC CAC AAA AAG CAC AAT CAA GT | |
| Lse0394-F | TGT TTC TTC CGC GAC GGC | L. seeligeri |
| Lse0394-R | AGC ATT AGA GCA ACA TTC TAG CT | |
| prs-F | GCT GAA GAG ATT GCG AAA GAA G | Listeria |
| prs-R | CAA AGA AAC CTT GGA TTT GCG G |
对分离得到的单增李斯特菌依照Doumith的方法将血清型分为5个血清组[16]。然后采用日本Denka Seiken公司的血清抗体,对5个血清组做进一步的血清型鉴定[17]。
1.6 PFGE根据美国PulseNet推荐的选用限制性核酸内切酶AscⅠ对单增李斯特菌进行酶切电泳[18-19]。所得PFGE图像用BioNumericsversion 7.0软件 (Applied Maths, Saint-Martine, Belgium) 进行分析。
1.7 MLST依据法国巴斯德研究所对单增李斯特菌MLST的操作流程,对该菌的7个管家基因 (abcZ, bglA, cat, dapE, dat, ldh, lhkA) 进行序列分析,每个管家基因的序列号和ST型别可以在网站http://www.pasteur.fr/recherhe/genopole/PF8/mlst/Lmono.html.Minimum.进行比对后获得。
2 结果 2.1 李斯特菌分离情况147份蜚蠊样本中李斯特菌的分离率为53.06%(78/147),单增李斯特菌的分离率为17.68%(26/147)。来自于鸡肉、羊肉、水产品、猪肉销售区域蜚蠊中英诺克李斯特菌的分离率分别为8.33%、11.11%、31.82%和22.86%,单增李斯特菌的分离率分别为16.67%、22.22%、18.18%和17.14%。其中羊肉销售市场中蜚蠊的单增李斯特菌分离率最高;只有来自猪肉销售区域的蜚蠊分离到威尔李斯特菌,分离率为7.14%。不同月份蜚蠊单增李斯特菌的分离率不同,10-12月分离率分别为25.71%、10.91%和8.7%,10月分离率最高。
2.2 单增李斯特菌的血清型特征血清型分析将26株单增李斯特菌分为4种血清型:1/2c (9/26)、1/2b (9/26)、1/2a (4/26) 和3a (4/26),其中1/2c与1/2b是主要的血清型别,均占34.6%。鸡肉、水产品、羊肉、猪肉销售区域蜚蠊中单增李斯特菌的主要血清型分别为1/2b (4/6)、1/2b (3/4)、1/2b (2/4) 和1/2c (7/12)。鸡肉、水产品、羊肉销售区域蜚蠊中单增李斯特菌的主要血清型别一致,均为1/2b。
2.3 单增李斯特菌的序列型别特征MLST分析将26株单增李斯特分离菌株分为5种序列型,分别为ST87(9/26)、ST9(7/26)、ST121(5/26)、ST155(3/26) 和ST35(2/26),优势的序列型为ST87(34.62%)。鸡肉、水产品、羊肉、猪肉销售区域蜚蠊中分离得到的单增李斯特菌的优势的序列型别分别为ST87(4/6)、ST87(3/4)、ST87(2/4) 和ST9(6/12)。其中,鸡肉、水产品、羊肉销售区域蜚蠊中分离得到的单增李斯特菌的优势序列型一致,均为ST87。
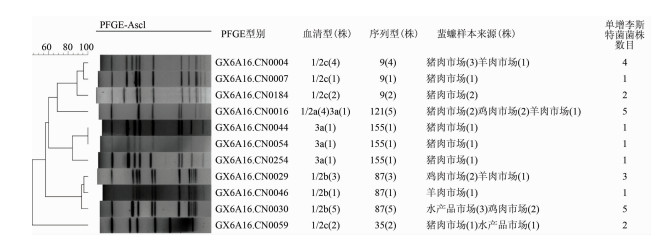
2.4 单增李斯特菌的PFGE型别特征PFGE分析将26株单增李斯特菌株分为11种PFGE带型,其中,PT16(19.23%)、PT30(15.38%) 和PT4(15.38%) 是主要的PFGE型别,优势的PFGE型为PT16。鸡肉销售区域蜚蠊中分离得到的单增李斯特菌的主要PFGE型为PT16(2/6)、PT29(2/6) 和PT30(2/6),且数目相同;水产品销售区域蜚蠊中分离得到的单增李斯特菌的优势PFGE型为PT30(3/22), 羊肉销售区域蜚蠊中分离得到的单增李斯特菌的优势PFGE型为PT4、PT16、PT29、PT46,且数目相同, 均为1。
鸡肉销售区域蜚蠊携带的单增李斯特菌的优势型别为1/2b,ST87,PT16;水产品销售区域蜚蠊携带的单增李斯特菌的优势型别为1/2b,ST87,PT30;羊肉销售区域蜚蠊携带的单增李斯特菌优势型别为1/2b,ST87,PT4、PT16、PT29、PT46;猪肉销售区域蜚蠊携带的单增李斯特菌的优势型别为1/2c,ST9,PT4。ST9型菌株均为1/2c血清型,ST87型菌株均为1/2b血清型,ST155型菌株均为3a血清型,而ST121型菌株包括1/2a和3a血清型。
| 蜚蠊样品 来源 | 样本数 (份) | 其他李斯特菌 (株) | 单增李斯特菌 菌株数目 (%) | 血清型 (株) | ST (株) | PT (株) |
| 鸡肉市场 | 36 | L.innocua (3) | 6(16.67) | 1/2b (4), 1/2a (2) | 87(4), 121(2) | 16(2), 29(2), 30(2) |
| 水产品市场 | 22 | L.innocua (7) | 4(18.18) | 1/2b (3), 1/2c (1), | 87(3), 35(1) | 30(3), 59(1) |
| 羊肉市场 | 18 | L.innocua (2) | 4(22.22) | 1/2b (2), 1/2c (1), 1/2a (1) | 87(2), 9(1), 121(1) | 4(1), 16(1), 29(1), 46(1) |
| 猪肉市场 | 70 | L.innocua (16), L.welshimeri (5) | 12(17.14) | 1/2c (7), 3a (4), 1/2a (1) | 9(6), 155(3), 121(2), 35(1) | 4(3), 16(2), 184(2), 7(1), 44(1), 54(1), 59(1), 254(1) |
| 合计 | 147 | L.innocua (28), L.welshimeri (5) | 26(17.68) | 1/2b (9), 1/2c (9), 1/2a (4), 3a (4) | 87(9), 9(7), 121(5), 155(3), 35(2) | 16(5), 30(5), 4(4), 29(3), 59(2), 184(2), 7(1), 44(1), 46(1), 54(1), 254(1) |
|
| 图 1 蜚蠊样本分离的26株单增李斯特菌的PFGE聚类图、血清型、ST型别及来源 Figure 1 PFGE patterns, serotypes, sequence typesand sources of 26 L.monocytogenes isolates from cockroaches |
| |
单增李斯特菌在低温、高盐、低水分活度环境中均能生长和繁殖,并能持续存在于食品的销售环境中,黏附在物体的表面并形成生物膜,造成食品的持续污染[20]。一直以来,人们普遍关注食品的生产环境中的单增李斯特菌对食品的污染[21],而对食品销售环境中存在的食品污染的危险因素调查却很少见,尤其是对市场内广泛活跃的蜚蠊是否能携带并传播单增李斯特菌而对食品造成污染的研究在中国还尚未见报道。本研究发现,农贸市场的蜚蠊中单增李斯特菌的携带率为17.68%,而罗丽娟等[22]和马爱静等[23]分别在四川省和北京市的某些农贸市场进行的关于生肉中单增李斯特菌的携带调查中发现其携带率分别为12.95%和6.20%,低于本研究蜚蠊中单增李斯特菌的携带率。提示在农贸市场中,蜚蠊可能作为单增李斯特菌的重要携带者,并有传播单增李斯特菌造成食品污染的风险。本研究中羊肉销售区域蜚蠊中单增李斯特菌的分离率最高,可能与市场阴暗潮湿的环境更适合蜚蠊的生存和繁殖有关。此外,不同的采样时间蜚蠊中的单增李斯特菌的分离率不同,从10-12月份,随着温度的降低,蜚蠊中单增李斯特菌的分离率降低,可能与蜚蠊在温度相对较低的环境中活动较少或是生长繁殖较低有关。鸡肉和猪肉销售区域蜚蠊中的单增李斯特菌的优势型别不同,分别为1/2b,ST87和1/2c,ST9,而马爱静等[23]对农贸市场内鸡肉和猪肉中单增李斯特菌的携带调查中发现,其优势型别分别与本研究中鸡肉和猪肉销售区域内蜚蠊中的单增李斯特菌的优势型别一致,这可能与不同的食品种类携带的单增李斯特菌的优势型别不一致有关,同时提示蜚蠊和鸡肉、猪肉间可能存在单增李斯特菌的交叉污染。但羊肉销售区域中单增李斯特菌的优势型别为1/2b、ST87,与马爱静等[23]对农贸市场内羊肉中的单增李斯特菌的携带调查的研究结果不同,其优势型别为1/2c、ST9,这可能与羊肉的采集来源地或进货来源不同有关。另外,水产品销售区域蜚蠊中单增李斯特菌优势型别为1/2b、ST87,与鸡肉和羊肉销售区域蜚蠊中单增李斯特菌的优势型别一致,可能与蜚蠊在不同的销售区域间活动导致污染的播散有关,但需要进一步的调查分析来证实。
由于此次在农贸市场中采集蜚蠊的同时未采集相关生肉食品和水产品等样本并进行分析,因此对于蜚蠊中的单增李斯特菌和不同食品中的单增李斯特菌的交叉污染的相关性,还需要进一步的对照研究予以证实。由于蜚蠊在农贸市场内较为常见,并且活动范围广泛,可能成为传播单增李斯特菌并污染食品的潜在危险因素,因此针对市场中蜚蠊的消杀及环境的及时清洁和定期消毒,是减少蜚蠊作为传播媒介导致病原菌污染食品的重要措施。
作者贡献:
李华 ORCID:0000-0002-3137-0034
李华:样本的收集、数据整理和分析、文章的撰写
王艳:实验技术指导
王毅:实验技术指导
叶长芸:负责课题设计的指导和文章的修改指导
| [1] | Mead PS, Slutsker L, Dietz V, et al. Food-related illness and death in the United States[J]. Emerg Infect Dis, 1999, 5(5): 607–625. DOI:10.3201/eid0505.990502 |
| [2] | Dalton CB, Austin CC, Sobel J, et al. An outbreak of gastroenteritis and fever due to Listeria monocytogenes in milk[J]. N Engl J Med, 1997, 336(2): 100–106. DOI:10.1056/NEJM199701093360204 |
| [3] | Salamina G, Dalle Donne E, Niccolini A, et al. A foodborne outbreak of gastroenteritis involving Listeria monocytogenes[J]. Epidemiol Infect, 1996, 117(3): 429–436. DOI:10.1017/S0950268800059082 |
| [4] | Hanssler L, Rosenthal E, Fitza B. Listeriosis of the newborn[J]. Klin Padiatr, 1990, 202(6): 379–382. DOI:10.1055/s-2007-1025549 |
| [5] | Yu JJ, Deng XM, Jiang JJ, et al. Cloning and analysis of virulence genes of Listerisa monocytogenes in Xinjiang clinical strains[J]. Journal of Shihezi University:Natural Science, 2014, 32(2): 153–157. (in Chinese) 于佳佳, 邓兴梅, 蒋建军, 等. 单增李斯特菌新疆临床分离株毒力基因的克隆和序列分析[J]. 石河子大学学报:自然科学版, 2014, 32(2): 153–157. |
| [6] | Wang Y, Wang Y, Ma AJ, et al. Rapid and sensitive detection of Listeria monocytogenes by cross-priming amplification of lmo0733 gene[J]. FEMS Microbiol Lett, 2014, 361(1): 43–51. DOI:10.1111/fml.2014.361.issue-1 |
| [7] | Fleming DW, Cochi SL, MacDonald KL, et al. Pasteurized milk as a vehicle of infection in an outbreak of listeriosis[J]. N Engl J Med, 1985, 312(7): 404–407. DOI:10.1056/NEJM198502143120704 |
| [8] | Zhang JM, Cao GJ, Xu XB, et al. Evolution and diversity of Listeria monocytogenes from clinical and food samples in Shanghai, China[J]. Front Microbiol, 2016, 7: 1138. |
| [9] | Jami M, Ghanbari M, Zunabovic M, et al. Listeria monocytogenes in aquatic food products-a review[J]. Compr Rev Food Sci Food Saf, 2014, 13(5): 798–813. DOI:10.1111/crf3.2014.13.issue-5 |
| [10] | Schlech WF, Lavigne PM, Bortolussi RA, et al. Epidemic listeriosis-evidence for transmission by food[J]. N Engl J Med, 1983, 308(4): 203–206. DOI:10.1056/NEJM198301273080407 |
| [11] | Centers for Disease Control and Prevention (CDC). Outbreak of Listeria monocytogenes infections associated with pasteurized milk from a local dairy-massachusetts, 2007[J]. MMWR Morb Mortal Wkly Rep, 2008, 57(40): 1097–1100. |
| [12] | Ferreira V, Wiedmann M, Teixeira P, et al. Listeria monocytogenes persistence in food-associated environments:epidemiology, strain characteristics, and implications for public health[J]. J Food Prot, 2014, 77(1): 150–170. DOI:10.4315/0362-028X.JFP-13-150 |
| [13] | O'connor L, O'Leary M, Leonard N, et al. The characterization of Listeria spp.isolated from food products and the food-processing environment[J]. Lett Appl Microbiol, 2010, 51(5): 490–498. DOI:10.1111/lam.2010.51.issue-5 |
| [14] | Pava-Ripoll M, Pearson REG, Miller AK, et al. Detection of foodborne bacterial pathogens from individual filth flies[J]. J Vis Exp, 2015(96): 52372. |
| [15] | Ryu J, Park SH, Yeom YS, et al. Simultaneous detection of Listeria species isolated from meat processed foods using multiplex PCR[J]. Food Control, 2013, 32(2): 659–664. DOI:10.1016/j.foodcont.2013.01.048 |
| [16] | Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR[J]. J Clin Microbiol, 2004, 42(8): 3819–3822. DOI:10.1128/JCM.42.8.3819-3822.2004 |
| [17] | Burall LS, Simpson AC, Datta AR. Evaluation of a serotyping scheme using a combination of an antibody-based serogrouping method and a multiplex PCR assay for identifying the major serotypes of Listeria monocytogenes[J]. J Food Prot, 2011, 74(3): 403–409. DOI:10.4315/0362-028X.JFP-10-355 |
| [18] | Graves LM, Swaminathan B. PulseNet standardized protocol for subtyping Listeria monocytogenes by macrorestriction and pulsed-field gel electrophoresis[J]. Int J Food Microbiol, 2001, 65(1/2): 55–62. |
| [19] | Halpin JL, Garrett NM, Ribot EM, et al. Re-evaluation, optimization, and multilaboratory validation of the PulseNet-standardized pulsed-field gel electrophoresis protocol for Listeria monocytogenes[J]. Foodborne Pathog Dis, 2010, 7(3): 293–298. DOI:10.1089/fpd.2009.0394 |
| [20] | Alonso AN, Perry KJ, Regeimbal JM, et al. Identification of Listeria monocytogenes determinants required for biofilm formation[J]. PLoS One, 2014, 9(12): e113696. DOI:10.1371/journal.pone.0113696 |
| [21] | Muhterem-Uyar M, Dalmasso M, Bolocan AS, et al. Environmental sampling for Listeria monocytogenes control in food processing facilities reveals three contamination scenarios[J]. Food Control, 2015, 51: 94–107. DOI:10.1016/j.foodcont.2014.10.042 |
| [22] | Luo LJ, Zhang ZD, Wang H, et al. A 12-month longitudinal study of Listeria monocytogenes contamination and persistence in pork retail markets in China[J]. Food Control, 2017, 76: 66–73. DOI:10.1016/j.foodcont.2016.12.037 |
| [23] | Ma AJ, Wang Y, Wang Y, et al. Molecular epidemiological characteristics of Listeria monocytogenes isolated from raw meat samples in some regions of Beijing, China[J]. Chinese Journal of Zoonoses, 2015, 31(5): 403–407. (in Chinese) 马爱静, 王艳, 王毅, 等. 北京市一些地区生肉标本中单增李斯特菌的分离及其分子流行病学特征分析[J]. 中国人兽共患病学报, 2015, 31(5): 403–407. |
 2017, Vol. 32
2017, Vol. 32


