扩展功能
文章信息
- 贾园春, 袁敏, 陈东科, 周海健, 陈霞, 赵晓菲, 李娟, 陈会波
- JIA Yuan-chun, YUAN Min, CHEN Dong-ke, ZHOU Hai-jian, CHEN Xia, ZHAO Xiao-fei, LI Juan, CHEN Hui-bo
- 临床来源碳青霉烯耐药大肠埃希菌药物敏感性及分子流行病学特征分析
- Drug susceptibility and molecular epidemiological characteristics of clinical isolates of carbapenem-resistant Escherichia coli
- 疾病监测, 2017, 32(4): 346-350
- Disease Surveillance, 2017, 32(4): 346-350
- 10.3784/j.issn.1003-9961.2017.04.021
-
文章历史
- 收稿日期:2016-11-02
2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室, 北京 102206;
3. 北京医院检验科, 北京 100730
2. State Key Laboratory for Communicable Diseases Prevention and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Department of Clinical Laboratory, Beijing Hospital, Beijing 100730, China
大肠埃希菌是临床常见的条件致病菌,居革兰阴性菌检出率首位[1]。碳青霉烯类抗生素是目前最高级别的β-内酰胺类药物,被视为临床治疗革兰阴性菌感染的最后一道防线。但随着碳青霉烯类药物在临床应用的增加,碳青霉烯耐药大肠埃希菌菌株时有检出,临床抗感染治疗及院感控制面临严峻的挑战。目前肠杆菌科细菌对碳青霉烯类耐药的主要机制是产碳青霉烯酶[2]。碳青霉烯酶主要包括Ambler分类法中的A、B、D 3种类型,其中临床上最常见的是A类KPC型碳青霉烯酶,B类NDM型、IMP型和VIM型等碳青霉烯酶以及D类的OXA型碳青霉烯酶[3]。本研究收集了某医院2015年间21株碳青霉烯耐药大肠埃希菌,对其药物敏感性特征、碳青霉烯酶携带状况及分子型别特征进行分析,为了解碳青霉烯耐药大肠埃希菌耐药机制及传播特征提供基础数据。
1 材料与方法 1.1 菌株收集某医院临床分离的碳青霉烯耐药大肠埃希菌,共计21株。所有菌株均经VITEK 2 Compact全自动微生物分析仪进行鉴定及药敏试验,大肠埃希菌ATCC25922为药敏试验质控菌株。
1.2 仪器与试剂VITEK 2 Compact全自动微生物分析仪 (法国生物梅里埃公司);哌拉西林、头孢吡肟、头孢曲松、头孢他啶、美罗培南、米诺环素、阿米卡星、左氧氟沙星、磷霉素 (均购自中国食品药品检定研究院),亚胺培南 (美国Sigma公司),甲氧苄啶-磺胺甲恶唑 (中国兽医药品监察所);细菌总蛋白抽提试剂 (Thermo公司);酚红 (Amresco公司);细菌多点接种仪 (日本SAKUMA公司);PCR仪 (德国Senso公司);脉冲场凝胶电泳仪 (美国Bio-rad公司);凝胶成像仪 (UVP);Xba Ⅰ限制性内切酶、Taq mix及DL2000 DNA Marker (大连TaKaRa公司);PCR引物合成、扩增产物测序 (北京天一辉远生物技术有限公司)。
1.3 方法 1.3.1 菌株药物敏感性检测采用琼脂稀释法测定菌株不同药物的最低抑菌浓度 (MIC)。11种抗菌药物为哌拉西林、头孢吡肟、头孢曲松、头孢他啶、亚胺培南、美罗培南、米诺环素、阿米卡星、左氧氟沙星、磷霉素、甲氧苄啶-磺胺甲恶唑。参照2016年美国临床实验室标准委员会 (CLSI) 的M 100-S26中的标准,根据11种抗菌药物的敏感和耐药界值先将不同抗菌药物配成原液,再倍比稀释成12个连续浓度梯度。取新鲜菌落制备成0.5麦氏单位的菌悬液,用多点接种仪将菌悬液分别接种至不同浓度梯度含药平板上,37 ℃孵育16~20 h后读取结果,药敏结果根据2016年CLSI的标准进行判断。
1.3.2 Carba NP试验检测方法及结果判读均根据2016年CLSI的M 100-S26中的标准。步骤如下:取2个离心管分别加入100 μl细菌蛋白抽提液,用接种环从37 ℃培养18~22 h的培养基上直接刮取细菌菌落,混悬于细菌蛋白抽提液中,漩涡振荡器上剧烈振荡5 s,充分混匀,分别加100 μl检测液A、B,并用移液器吹打混匀,置于37 ℃孵箱内,每0.5 h观察记录颜色变化直至孵育2 h结束。检测液A:2 ml 0.5 %酚红溶液 (pH 7.0~7.8) 中加入16.6 ml水、180 μl 10 mmol/L ZnSO4溶液,调pH值至7.8±0.1。检测液B:每毫升检测液A中含有终浓度为6 mg/ml的亚胺培南。
1.3.3 PCR反应对21株碳青霉烯耐药大肠埃希菌进行耐药基因 (包括blaNDM、blaKPC、blaIMP、blaVIM、blaOXA) 筛查。用DNA基因组提取试剂盒提取实验菌株基因组DNA,-20 ℃保存。PCR反应体系为25 μl,包括Taq Mix 12.5 μl,上游引物、下游引物各1 μl,DNA模板2 μl,去离子水8.5 μl。PCR扩增程序为95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min进行30个循环,最后72 ℃延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳,电压为120 V,电泳完成后用凝胶成像仪观察结果。将阳性菌株扩增产物进行测序,测序结果在NCBI (http://www.ncbi.nlm.nih.gov/blast/) 数据库中进行检索比对,确定基因型。PCR引物序列,见表 1。
| 基因 | 引物序列 (5′~3′) | 片段长度 (bp) | 退火温度 (℃) | 参考文献 |
| KPC | F:TGT CAC TGT ATC GCC GTC | 1 010 | 55 | [4] |
| R:CTC AGT GCT CTA CAG AAA ACC | ||||
| NDM | F:GGT TTG GTG ATC TGG TTT TC | 1 100 | 55 | [4] |
| R:CGG AAT GGC TCA TCA CGA TC | ||||
| VIM | F:AGT GGT GAG TAT CCG ACA G | 261 | 55 | [4] |
| R:ATG AAA GTG CGT GGA GAC | ||||
| IMP | F:ACC GCA GCA GAG TCT TTG CC | 587 | 55 | [4] |
| R:ACA ACC AGT TTT GCC TTA CC | ||||
| OXA-48 | F:TTG GTG GCA TCG ATT ATC GG | 740 | 55 | [4] |
| R:GAG CAC TTC TTT TGT GAT GGC |
用DNA基因组试剂盒提取细菌基因组DNA,按照MLST数据库 (http://mlst.warwick.ac.uk/mlst/dbs/Ecoli) 提供的大肠埃希菌MLST分型方案,采用PCR方法扩增大肠埃希菌7个管家基因 (adk、fum、gyr、icd、mdh、pur、rec) 并进行测序,再与该数据库进行比对,分析菌株的序列型。PCR引物序列、扩增体系及条件参考文献[5]。
1.3.5 脉冲场凝胶电泳 (PFGE)取400 μl细菌悬浊液 (调浊度至4.0~4.5麦氏单位) 于37 ℃孵育5 min后加入20 μl蛋白酶K (20 mg/ml),将菌悬液与400 μl 1% SeaKem Gold:1%SDS混匀后加入模具制备成胶块,胶块经Xba Ⅰ限制性内切酶酶切2 h后进行电泳。电泳参数:温度14 ℃,脉冲时间6.8~35.4 s,电泳时间18.5 h[6]。电泳完成后染色,凝胶成像仪上观察并保存电泳图谱。使用BioNumerics Version 5.10软件,根据条带间的相似性Dice系数 (Dice coefficients),用非加权配对算数平均法 (unweighted pair group average method,UPGMA) 对图谱进行聚类分析。
2 结果 2.1 菌株分布21株碳青霉烯耐药大肠埃希菌中来源于尿液11株,引流液4株,痰液3株,其余3株分别来源于胆汁、血和分泌物。
2.2 药敏试验21株碳青霉烯耐药大肠埃希菌对亚胺培南和美罗培南均耐药,MIC范围分别为8~>64 μg/ml和4~>128 μg/ml。对哌拉西林、头孢吡肟、头孢曲松、头孢他啶等β-内酰胺类、左氧氟沙星均耐药。对甲氧苄啶-磺胺甲恶唑的耐药率也高达76.19%。仅有4株对磷霉素耐药,对米诺环素和阿米卡星耐药的分别有5株,耐药率均较低,见表 2。
| 抗菌药物 | 耐药菌株数 | 耐药率 (%) | MICrange | MIC50 | MIC90 |
| 哌拉西林 | 21 | 100.0 | >512 | >512 | >512 |
| 头孢吡肟 | 21 | 100.0 | 128~>256 | >256 | >256 |
| 头孢曲松 | 21 | 100.0 | >512 | >512 | >512 |
| 头孢他啶 | 21 | 100.0 | 512~>512 | >512 | >512 |
| 亚胺培南 | 21 | 100.0 | 8~>64 | 8 | 32 |
| 美罗培南 | 21 | 100.0 | 4~>128 | 16 | 32 |
| 米诺环素 | 5 | 23.8 | 1~32 | 4 | 32 |
| 阿米卡星 | 5 | 23.8 | 2~>1 024 | 4 | >1 024 |
| 左氧氟沙星 | 21 | 100.0 | 16~64 | 32 | 64 |
| 磷霉素 | 4 | 19.1 | <0.5~>1 024 | <0.5 | 1 024 |
| 甲氧苄啶-磺胺甲恶唑 | 16 | 76.2 | <0.062 5/1.187 5~>128/2 432 | >128/2 432 | >128/2 432 |
| 注:MIC:最低抑菌浓度,单位为μg/ml。 | |||||
有17株菌株Carba NP试验阳性,阳性率为80.95%。
2.4 PCR扩增结果17株产酶菌株blaNDM基因检测阳性,经序列比对显示均为blaNDM-1亚型,其他4种碳青霉烯耐药基因及其余4株菌株的5种碳青霉烯耐药基因筛查结果均为阴性。
2.5 MLST分型结果共有9种型别,分别为ST101、ST167、ST359、ST405、ST410、ST540、ST617、ST1421和ST3835,主要为ST167型 (10株)、ST540型 (3株) 和ST410型 (2株),其余ST型各有1株。其中10株ST167菌株中有2株不携带blaNDM-1基因,ST405和ST1421各有1株菌株不携带blaNDM-1基因,其余菌株均携带blaNDM-1基因,见图 1。
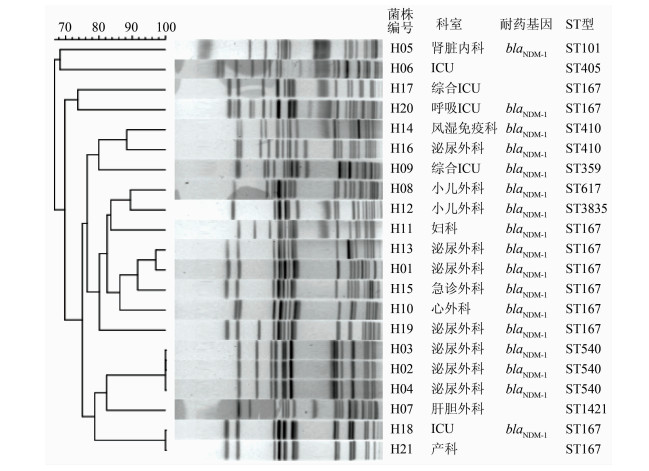
|
| 图 1 21株碳青霉烯耐药大肠埃希菌聚类分型结果 Figure 1 PFGE patterns of 21 carbapenem-resistant E. coli strains |
| |
21株大肠埃希菌PFGE条带之间差别较大,来自泌尿外科的3株菌株带型完全相同,另来自ICU和产科的2株菌株带型相同,其余型别散在分布于肾脏内科、ICU、心外科、妇科等 (图 1)。
3 讨论我国碳青霉烯耐药肠杆菌科细菌主要以携带blaKPC-2基因的肺炎克雷伯菌为主。碳青霉烯耐药大肠埃希菌的临床分离率较低[7],其药敏特征、耐药机制及传播方式尚不清楚。本研究中的21株碳青霉烯耐药大肠埃希菌对亚胺培南、美罗培南、哌拉西林、头孢吡肟、头孢曲松、头孢他啶等β-内酰胺类均耐药,与吴伟清等[8]研究结果一致。对甲氧苄啶-磺胺甲恶唑的耐药率为76.19%,对左氧氟沙星耐药率也高达100%,部分菌株对阿米卡星、米诺环素以及磷霉素等也耐药,表明该医院21株碳青霉烯耐药大肠埃希菌均表现为多重耐药且耐药率较高,给临床抗感染治疗带来困难。21株菌均分离自住院患者,主要分布在泌尿外科和ICU,需重点关注。
Carba NP法用于检测肠杆菌科菌株产碳青霉烯酶情况,由Nordmann等[9]首次报道。本研究中21株碳青霉烯耐药菌株中有17株产碳青霉烯酶,阳性率为80.95%,与以往报道的肠杆菌科菌株碳青霉烯耐药80%是由产碳青霉烯酶引起的结果一致[10-11],PCR检测结果显示该17株菌株均携带blaNDM-1型基因,但国内以往的研究结果显示碳青霉烯耐药大肠埃希菌主要是以携带blaKPC型基因为主,张嵘等[12]、Cai等[13]对杭州地区分离到的大肠埃希菌为blaKPC-2型。提示在该医院碳青霉烯耐药大肠埃希菌的耐药机制与以往研究不同,出现了携带blaNDM-1基因的大肠埃希菌,应密切关注其流行特征,减缓或阻断其在该医院向其他科室及院外的传播。
PFGE以其重复性好、分辨率高而被称为细菌分子生物学分型技术的金标准[14]。MLST通过对管家基因部分序列的比对,确定其亚型,分型结果便于不同实验室间进行比较[15]。本研究综合PFGE和MLST分型的结果分析菌株间的关系,来自泌尿外科的3株菌株H02、H03和H04,均为ST540型且PFGE带型相同,来自产科和ICU的2株菌株H18、H21,PFGE和MLST型别也完全相同,提示该医院存在科室内和科室间同一耐药克隆株传播。此外,具有不同ST型的菌株均携带blaNDM-1基因,也提示在该医院可能存在blaNDM-1基因在不同大肠埃希菌菌株间的水平转移。
ST167型大肠埃希菌在临床中并不常见,以往关注较少。在本研究中发现有10株大肠埃希菌属于ST167型,PFGE图谱不尽相同,携带blaNDM-1基因的情况也不相同,其中8株携带blaNDM-1基因,另2株不携带blaNDM-1基因,但均表现出对碳青霉烯类药物的耐药。据文献报道,印度、中国也曾报道携带blaNDM-1基因的ST167大肠埃希菌[16-17];在法国和本课题组的其他相关研究中,也发现ST167型大肠埃希菌携带NDM-7、NDM-5等多种基因亚型[17-19]。无论是否携带blaNDM-1基因,需高度警惕ST167克隆株在我国临床的出现和流行。
本次研究收集到的碳青霉烯耐药大肠埃希菌其耐药机制主要是携带blaNDM-1基因,对常用抗菌药物表现为多重耐药,且来源自该医院的不同科室。提示在该医院内存在blaNDM-1基因的传播及ST167、ST540等耐药克隆株的传播。携带blaNDM-1基因的碳青霉烯耐药大肠埃希菌给临床抗感染治疗带来严重挑战,对其药敏特征、传播机制及流行趋势的研究将为减缓或阻断其产生和传播提供重要依据。
作者贡献:
贾园春 ORCID:0000-0001-9969-4089
贾园春:实验操作、分析及文章撰写
袁敏、周海健、陈霞、赵晓菲:实验指导
陈东科:菌株分离培养、实验指导
陈会波:实验设计及文章修改
李娟:实验设计、指导及文章修改
| [1] | Shen JL, Pan YP, Xu YH, et al. Susceptibility of Escherichia coli strains in hospitals across China:results from the CHINET antimicrobial resistance surveillance program, 2005-2014[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(2): 129–140. (in Chinese) 沈继录, 潘亚萍, 徐元宏, 等. 2005-2014年CHINET大肠埃希菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 129–140. |
| [2] | Marchaim D, Chopra T, Perez F, et al. Outcomes and genetic relatedness of carbapenem-resistant Enterobacteriaceae at Detroit medical center[J]. Infect Control Hosp Epidemiol, 2011, 32(9): 861–871. DOI:10.1086/661597 |
| [3] | Howe RA, Andrews JM. BSAC standardized disc susceptibility testing method (version 11)[J]. J Antimicrob Chemother, 2012, 67(12): 2783–2784. DOI:10.1093/jac/dks391 |
| [4] | Pang H, Gong YE, Yuan M, et al. Characterization and prevalence of Klebsiella pneumonia carrying the carbapenemase gene in a hospital in Shanxi province, China[J]. Chin J Zoon, 2014, 30(11): 1110–1115. |
| [5] | Bai XN, Zhao AL, Xia SL, et al. Multilocus sequence typing of non-O157 Shiga toxin-producing Escherichia coli isolates[J]. Chinese Journal of Zoonoses, 2012, 28(6): 544–548, 560. (in Chinese) 白向宁, 赵爱兰, 夏胜利, 等. 非O157产志贺毒素大肠杆菌分离株的多位点序列分型研究[J]. 中国人兽共患病学报, 2012, 28(6): 544–548, 560. |
| [6] | Jin D, Zhao AL, Bai XN, et al. Pulsed-field gel electrophoresis typing on non-O157 Shiga toxin-producing Escherichia coli isolates[J]. Chinese Journal of Epidemiology, 2013, 34(5): 503–506. (in Chinese) 金东, 赵爱兰, 白向宁, 等. 非O157产志贺毒素大肠埃希菌分离株脉冲场凝胶电泳分析[J]. 中国流行病学杂志, 2013, 34(5): 503–506. |
| [7] | Wei WJ, Yang HF, Ye Y, et al. New delhi metallo-β-lactamase-mediated carbapenem resistance:origin, diagnosis, treatment and public health concern[J]. Chin Med J, 2015, 128(14): 1969–1976. DOI:10.4103/0366-6999.160566 |
| [8] | Wu WQ, You LP, Xu C, et al. Reaserch on β-lactam antimicrobial resistance gene in carbapenem-resistance Enterobacteriaceae[J]. Chinese Journal of Health Laboratory Technology, 2015, 25(11): 1856–1859. (in Chinese) 吴伟清, 油丽萍, 徐茶, 等. 碳青霉烯类耐药肠杆菌科细菌的β-内酰胺酶耐药基因的研究[J]. 中国卫生检验杂志, 2015, 25(11): 1856–1859. |
| [9] | Nordmann P, Poirel L, Dortet L. Rapid detection of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2012, 18(9): 1503–1507. DOI:10.3201/eid1809.120355 |
| [10] | Ckakraborty A, Adhikari P, Shenoy S, et al. Molecular characterization and clinical significance of New Delhi metallo-beta-lactamases-1 producing Escherichia coli recovered from a South Indian tertiary care hospital[J]. Indian J Pathol Microbiol, 2015, 58(3): 323–327. DOI:10.4103/0377-4929.162864 |
| [11] | Castanheira M, Mendes RE, Woosley LN, et al. Trends in carbapenemase-producing Escherichia coli and Klebsiella spp.from Europe and the Americas:report from the SENTRY antimicrobial surveillance programme (2007-09)[J]. J Antimicrob Chemother, 2011, 66(6): 1409–1411. DOI:10.1093/jac/dkr081 |
| [12] | Zhang R, Chi D, Cai JC, et al. Molecular types of carbapenem-non-susceptible Escherichia coli isolates and their mechanism of drug resistance[J]. Chinese Journal of Microbiology and Immunology, 2014, 34(4): 256–263. (in Chinese) 张嵘, 池丹, 蔡加昌, 等. 大肠埃希菌对碳青霉烯类抗生素的耐药机制及分子分型[J]. 中华微生物学和免疫学杂志, 2014, 34(4): 256–263. |
| [13] | Cai JC, Zhang R, Hu YY, et al. Emergence of Escherichia coli sequence type 131 isolates producing KPC-2 carbapenemase in China[J]. Antimicrob Agents Chemother, 2014, 58(2): 1146–1152. DOI:10.1128/AAC.00912-13 |
| [14] | Ye R, Shi LY, Wang P, et al. Brief introduction of pulsed-field gel electrophoresis and its application in bacterial molecular typing[J]. Chinese Journal of Vector Biology and Control, 2013, 24(2): 182–185. (in Chinese) 叶蕊, 石丽媛, 王鹏, 等. 脉冲场凝胶电泳技术简介及其在细菌分子分型中的应用[J]. 中国媒介生物学及控制杂志, 2013, 24(2): 182–185. |
| [15] | Gao Y, Zhang L, Li MC, et al. Molecular typing of Klebsiella pneumonia by pulse-field gel electrophoresis in combination with multilocus sequence typing[J]. Chinese Journal of Epidemiology, 2010, 31(7): 786–790. (in Chinese) 高源, 张砺, 李马超, 等. 肺炎克雷伯菌脉冲场凝胶电泳及多位点序列分型技术的联合应用[J]. 中华流行病学杂志, 2010, 31(7): 786–790. |
| [16] | Castanheira M, Deshpande LM, Mathai D, et al. Early dissemination of NDM-1-and OXA-181-producing Enterobacteriaceae in Indian hospitals:report from the SENTRY Antimicrobial Surveillance Program, 2006-2007[J]. Antimicrob Agents Chemother, 2011, 55(3): 1274–1278. DOI:10.1128/AAC.01497-10 |
| [17] | Huang YL, Yu XN, Xie MM, et al. Widespread dissemination of carbapenem-resistant Escherichia coli sequence type 167 strains harboring blaNDM-5 in clinical settings in China[J]. Antimicrob Agents Chemother, 2016, 60(7): 4364–4368. DOI:10.1128/AAC.00859-16 |
| [18] | Cuzon G, Bonnin RA, Nordmann P. First identification of novel NDM carbapenemase, NDM-7, in Escherichia coli in France[J]. PLoS One, 2013, 8(4): e61322. DOI:10.1371/journal.pone.0061322 |
| [19] | Chen DK, Gong L, Walsh TR, et al. Infection by and dissemination of NDM-5-producing Escherichia coli in China[J]. J Antimicrob Chemother, 2016, 71(2): 563–565. DOI:10.1093/jac/dkv352 |
 2017, Vol. 32
2017, Vol. 32


