扩展功能
文章信息
- 曹阳, 遇晓杰, 韩营营, 李杰, 阚飙, 闫梅英
- CAO Yang, YU Xiao-jie, HAN Ying-ying, LI Jie, KAN Biao, YAN Mei-ying
- 我国非伤寒沙门菌对多粘菌素的耐药现况及mcr-1基因携带概况
- Polymyxin resistance and mcr-1 prevalence in non-typhoid Salmonella isolates in China
- 疾病监测, 2017, 32(5): 365-371
- Disease Surveillance, 2017, 32(5): 365-371
- 10.3784/j.issn.1003-9961.2017.05.005
-
文章历史
- 收稿日期:2017-03-07
2. 黑龙江省疾病预防控制中心, 黑龙江 哈尔滨 150000
2. Heilongjiang Provincial Center for Disease Control and Prevention, Harbin 150000, Heilongjiang, China
早期多粘菌素应用因为其肾毒性和神经毒性受到限制[1]。近年来,因为其在治疗多重耐药革兰阴性菌引起的感染方面取得较好疗效[2],重新获得关注。现临床上常用的为多粘菌素B和E,多粘菌素E多应用于动物,多粘菌素B主要应用于人。然而,随着该药在临床上的应用,已经发现革兰阴性菌对多粘菌素产生耐药性[3]。最新研究发现,细菌对多粘菌素的抗性显著增加,并通过携带mcr-1基因的质粒介导,将其耐药性传递给其他菌株[4]。因此,加强对多粘菌素耐药性的监测对指导临床用药具有重要意义。目前,针对肺炎克雷伯菌、大肠埃希菌对多粘菌素的耐药研究较多,沙门菌对多粘菌素的耐药研究多见于动物源性沙门菌对多粘菌素E的相关研究[5-6]。本研究对分离自食品、腹泻患者粪便、动物粪便或肠内容物的沙门菌进行多粘菌素的药物敏感性试验及mcr-1基因检测,初步探究沙门菌对多粘菌素的耐药情况,为临床使用多粘菌素治疗沙门菌,特别是多重耐药沙门菌感染提供一定的依据。
1 材料与方法 1.1 菌株来源随机选取2011-2014年共404株沙门菌进行试验。其中,2011年4株(0.99%),2012年24株(5.94%),2013年344株(85.15%),2014年32株(7.92%)。菌株来自北京(108株)、云南(108株)、深圳(70株)、天津(31株)、内蒙古(44株)、厦门(13株)、河北(7株)、河南(6株)、贵州(5株)等12个省(直辖市、自治区)及国外(8株)。其中,分离自食品的沙门菌共72株(17.82%),除2株来源于厦门市,其余70株菌来自深圳市。分离自野生动物(红嘴鸥和鼠)的沙门菌共128株(31.68%),84株来源于云南省昆明市,44株来源于内蒙古自治区赤峰市。分离自腹泻患者粪便的沙门菌共204株(50.50%),来自于除深圳以外的各个省市,其中北京市最多,为86株。明确血清型的菌株共189株,包括鼠伤寒沙门菌、德尔卑沙门菌、肠炎沙门菌等38种血清型,见图 1、2。实验用菌株均来自中国疾病预防控制中心(CDC)传染病预防控制所腹泻病室,均采用API 20E试剂条及血清凝集试验进行了确认。沙门菌抗血清购自丹麦国家食品研究所并在有效期内使用。
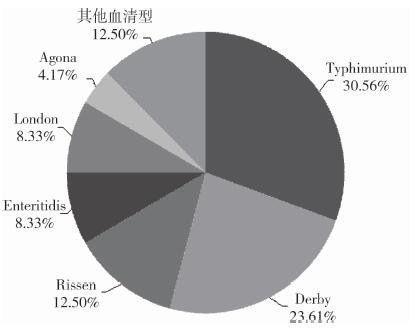
|
| 图 1 分离自食物菌株血清型构成比 Figure 1 Proportion of serotypes of Salmonella from food samples 注:其他血清型,共包括26种血清型,每种血清型包含的菌株数均 < 3株 |
| |
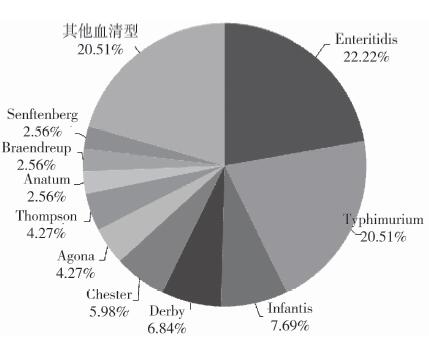
|
| 图 2 分离自人粪便菌株血清型构成比 Figure 2 Proportion of serotypes of Salmonella from human stool samples 注:其他血清型,共包括26种血清型,每种血清型包含的菌株数均 < 3株 |
| |
采用微量肉汤稀释法测试404株沙门菌对多粘菌素B和E的敏感性。2种抗生素浓度范围为0.125、0.25、0.5、1、2、4、8、16 μg/ml。药敏板由上海星佰生物技术有限公司订制,实验步骤按照说明书进行,具体包括:(1) 制备菌悬液:挑取纯菌培养的新鲜菌落于2~3 ml灭菌生理盐水中,用0.5麦氏浊度比浊,调菌液浓度至1.5×108 CFU/ml;(2) 取15 μl上述菌悬液于3 ml营养肉汤培养液中,充分混匀;(3) 在各浓度对应的药敏板相应孔位加入100 μl上述稀释菌液;(4)35 ℃静置培养18~20 h;(5) 孵育后,人工判读各株菌对多粘菌素B及E的最低抑菌浓度(MIC)。大肠埃希菌ATCC25922作为药敏试验质控菌株确保结果的可靠性。
1.2.2 抗生素的药物敏感性试验若菌株对多粘菌素B的最小抑菌浓度≥8 μg/ml,则同时进行16种抗生素(氨苄西林、阿莫西林-克拉维酸钾、萘啶酸、环丙沙星、氯霉素、链霉素、庆大霉素、阿奇霉素、头孢西丁、头孢曲松、头孢吡肟、亚胺培南、四环素、磺胺异恶唑、复方新诺明、强力霉素)的敏感性试验。药敏板购自上海星佰生物技术有限公司,实验步骤按照说明书进行。所得菌株MIC值,根据2016年美国临床和实验室标准协会(CLSI)制定的标准,获得相应敏感(S)、中度敏感(I)和耐药(R)结果。大肠埃希菌ATCC25922作为质控菌株确保药敏结果的可靠性。
1.3 mcr-1基因PCR筛查 1.3.1 模板制备采用热裂解法制备模板。挑取单个纯菌培养的新鲜菌落于100 μl纯水中,制成悬浊液。100 ℃煮沸10 min,冰浴10 min,12 000 r/min离心5 min,取上清作为反应模板。-20 ℃保存以备用。
1.3.2 聚合酶链式反应(PCR)体系及条件根据发表的mcr-1基因序列,设计引物进行mcr-1基因检测。mcr-1基因筛查引物序列:CST-partial-F:5′-CTT GGT CGG TCT GTA GGG-3′,CST-partial-R5′-CGG TCA GTC CGT TTG TTC-3′。引物由北京天一辉远生物科技有限公司合成。PCR反应总体积为2 μl,其中2×Taq PCR MasterMix (TaKaRa公司)12.5 μl,mcr-1上下游引物(10 μmol/L)各200 pmol,DNA模板1 μl。PCR反应程序:94 ℃预变性3 min,然后94 ℃ 30 s,55 ℃30 s,72 ℃ 30 s,进行30个循环,最后72 ℃延伸5 min。PCR扩增结束后,将产物上样于1.0%的琼脂糖凝胶中,在0.5×TBE电泳缓冲液中进行电泳,记录PCR扩增结果。预期PCR产物长度为309 bp,对PCR阳性产物的样本进行mcr-1全基因扩增,并将扩增阳性的PCR产物送北京天一辉远生物科技有限公司进行序列测定,获得的mcr-1基因序列经比对后提交GenBank数据库,获得序列号。mcr-1全基因PCR扩增引物为:mcr1_F:5′-GCG GAT GAA TGC GGT GCG-3′,mcr1_R:5′-ATG ATG CAG CAT ACT TCT GTG-3′。mcr-1全基因扩增长度为1 623 bp,扩增条件与mcr-1基因筛查时的条件,除扩增循环中72 ℃延伸1.5 min外,其余均相同。每次实验均平行设立阴性对照(去离子水为模板)及阳性对照(含mcr-1基因的质粒DNA为模板)保证结果的准确性、可靠性。
1.4 S1-脉冲场凝胶电泳(PFGE)参照国际实验室分子分型监测网络PulseNet中沙门菌PFGE分型标准化方案进行操作。简述如下:将细菌悬于细胞悬液(100 mmol/L Tris-HCl:100 mmol/L EDTA,pH 8.0) 中,调整浊度至5.0左右。吸取400 μl菌悬液加入20 μl蛋白酶K混匀,再加入400 μl低溶点琼脂(含1% SDS,56 ℃)混匀,灌制胶块。胶块加5 ml细胞裂解液(50 mmol/L Tris:50 mmol/L EDTA,pH 8.0,加1%十二烷基肌氨酸钠)和25 μl蛋白酶K (终浓度0.1 mg /ml),54 ℃水浴摇床孵育2 h裂解细胞,然后用50 ℃预热的TE漂洗4次。切取2 mm胶块加入1 ml 10 mmol/L Tris-HCl (pH 7.5) 漂洗2次(每次15 min),将胶块置于200 μl S1酶切缓冲液(50 mmol/L氯化钠, 30 mmol/L醋酸钠,5 mmol/L硫酸锌)中,加入1 U S1核酸酶(Sigma公司),37 ℃酶切45 min[7]。将酶切后的胶块进行PFGE(脉冲时间2.2~63.8 s,电泳19 h)。电泳完毕后,利用Del Dox 2000成像仪(Bio-Rad公司)获取经GelRed染色的凝胶图像。利用BioNumerics软件分析凝胶条带,并与DNA分子质量标准Marker进行比对,获得菌株内质粒大小情况。
1.5 质粒接合转移实验以携带mcr-1基因的菌株为供体菌,大肠埃希菌J53作为受体菌,单菌落37 ℃活化过夜,次日以1 : 50的比例转接至新鲜5 ml LB中,37 ℃振荡培养至对数生长期A600= 0.5~0.6,按1 : 1的比例在1.5 ml的离心管中混匀,低速离心集菌,弃上清。菌沉淀用新鲜LB洗2次后加200 μl LB重悬。将菌悬液加到0.45 μm滤膜上,37 ℃培养过夜。用1 ml LB将滤膜上的细菌洗下,离心沉淀,梯度稀释后分别涂布于含叠氮钠(100 μg/ml)的麦康凯培养基及同时含含叠氮钠(100 μg/ml)及多粘菌素B(2 μg/ml)双抗的麦康凯培养基上,37 ℃培养24 h。对长出的菌落分别进行计数,计算接合转移率(接合子数/受体菌数)。接合子为PCR扩增mcr-1阳性的大肠埃希菌。同时对这些接合子进行S1-PFGE分析,确定转移质粒大小。
1.6 统计学分析运用SPSS 17.0软件包进行统计学分析。用χ2检验进行率的比较,P < 0.05为差异有统计学意义。
2 结果 2.1 沙门菌对多粘菌素的耐受情况404株菌对多粘菌素B的MIC范围为≤0.125 μg/ml至 > 16 μg/ml,MIC50为1 μg/ml,MIC90为8 μg/ml。其中, < 4 μg/ml的共321株(79.46%),≤4 μg/ml或 < 8 μg/ml的共360株(89.11%),≥8 μg/ml的共44株(10.89%),见图 3。
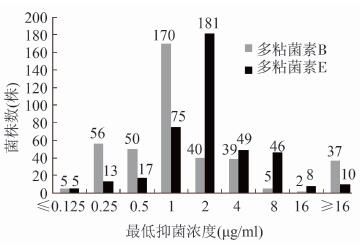
|
| 图 3 多粘菌素B及E对沙门菌的最低抑菌浓度分布 Figure 3 MIC distributions of polymyxin B and E for Salmonella |
| |
404株菌对多粘菌素E的MIC范围为≤ 0.125 μg/ml至 > 16 μg/ml,MIC50为2 μg/ml,MIC90为8 μg/ml。其中, < 4 μg/ml的共291株(72.03%),≤4 μg/ml或 < 8 μg/ml的共340株(84.16%),≥8 μg/ml的共64株(15.84%),见图 3。
以8 μg/ml为判定耐药折点,实验菌株对多粘菌素B和E的耐药率分别为10.89%和15.84%。共13株菌株同时耐多粘菌素B及E,交叉耐药率为3.22%。
2.1.1 不同来源沙门菌对多粘菌素B的药敏结果分离自食品的72株沙门菌,对多粘菌素B,MIC50为0.5 μg/ml,MIC90为 > 16 μg/ml。其中, < 4 μg/ml的共61株(84.72%),≤4 μg/ml或 < 8 μg/ml的共63株(87.50%),≥8 μg/ml的共9株(12.50%),见表 1。
| 最低抑菌浓度 (μg/ml) |
多粘菌素B/Ea | ||
| 食品 (n=72) |
腹泻患者 (n=204) |
动物 (n=128) |
|
| ≤0.125 | 4/2 | 1/3 | 0/0 |
| 0.25 | 25/2 | 31/11 | 0/0 |
| 0.5 | 20/0 | 23/17 | 7/0 |
| 1 | 10/24 | 57/50 | 103/92 |
| 2 | 2/33 | 20/56 | 18/92 |
| 4 | 2/5 | 37/10 | 0/34 |
| 8 | 0/1 | 5/44 | 0/1 |
| 16 | 1/2 | 1/6 | 0/0 |
| > 16 | 8/3 | 29/7 | 0/0 |
| 注:a一定最低抑菌浓度下,多粘菌素B及E的菌株数 | |||
分离自患者粪便的204株沙门菌,对多粘菌素B,MIC50为1 μg/ml,MIC90为 > 16 μg/ml。其中, < 4 μg/ml的共132株(64.71%),≤4 μg/ml或 < 8 μg/ml的共169株(82.84%),≥8 μg/ml的共35株(17.16%)(表 1)。
分离自野生动物的128株沙门菌,对多粘菌素B,MIC50为1 μg/ml,MIC90为2 μg/ml。所有菌株对多粘菌素B的MIC值 < 4 μg/ml(表 1)。
以8 μg/ml为判定折点,食源性、人源性、动物源性沙门菌对多粘菌素B的耐药率分别为12.50%、17.16%和0.00%。不同来源沙门菌对多粘菌素B的耐药率差异有统计学意义(χ2=24.09,P < 0.01)。
2.1.2 不同来源沙门菌对多粘菌素E的药敏结果分离自食品的72株沙门菌,对多粘菌素E,MIC50为2 μg/ml,MIC90为4 μg/ml。其中, < 4 μg/ml的共61株(84.72%),≤4 μg/ml或 < 8 μg/ml的共66株(91.67%),≥8 μg/ml的共6株(8.33%)(表 1)。
分离自人粪便的204株沙门菌,对多粘菌素E,MIC50为2 μg/ml,MIC90为8 μg/ml。其中, < 4 μg/ml的共137株(67.16%),≤4 μg/ml或 < 8 μg/ml的共147株(72.06%),≥8 μg/ml的共57株(27.94%)(表 1)。
分离自动物的128株沙门菌,对多粘菌素E,MIC50为2 μg/ml,MIC90为4 μg/ml。所有菌株对多粘菌素E的MIC值均≤8 μg/ml(表 1)。
以8 μg/ml为判定折点,食源性、人源性、动物源性沙门菌对多粘菌素E的耐药率分别为8.30%、27.94%和0.78%。不同来源沙门菌对多粘菌素E的耐药率差异有统计学意义(χ2=47.22,P < 0.01)。
2.2 其他抗生素的敏感性结果对多粘菌素B≥8 μg/ml的菌株(食源9株,人源35株)同时进行16种抗生素的敏感性试验。结果表示,44株多粘菌素B≥8 μg/ml的沙门菌株除对亚胺培南全部敏感外,不同来源的沙门菌对各类抗生素均有不同程度的耐药,见表 2。食源性沙门菌对氨苄西林的耐药率最高(88.89%),其次为阿奇霉素(55.66%)及萘啶酸、头孢西丁、四环素(均为44.44%),对头孢吡肟的耐药率为11.11%。人源性沙门菌对萘啶酸耐药率最高(77.14%),其次为链霉素(60.00%)、环丙沙星(45.71%),对头孢吡肟的耐药率为8.75%。
| 抗生素 | 食品来源 | 患者来源 | |||
| 菌株数 | 耐药率 (%) |
菌株数 | 耐药率 (%) |
||
| 氨苄西林 | 8 | 88.89 | 13 | 37.14 | |
| 阿莫西林-克拉维酸钾 | 2 | 22.22 | 3 | 8.57 | |
| 萘啶酸 | 4 | 44.44 | 27 | 77.14 | |
| 环丙沙星 | 1 | 11.11 | 16 | 45.71 | |
| 氯霉素 | 2 | 22.22 | 9 | 25.71 | |
| 链霉素 | 3 | 33.33 | 21 | 60.00 | |
| 庆大霉素 | 2 | 22.22 | 6 | 17.41 | |
| 阿奇霉素 | 5 | 55.56 | 4 | 11.43 | |
| 头孢西丁 | 4 | 44.44 | 2 | 5.71 | |
| 头孢曲松 | 2 | 22.22 | 3 | 8.57 | |
| 头孢吡肟 | 1 | 11.11 | 2 | 5.71 | |
| 亚胺培南 | 0 | 0.00 | 0 | 0.00 | |
| 四环素 | 4 | 44.44 | 13 | 37.14 | |
| 强力霉素 | 3 | 33.33 | 14 | 40.00 | |
| 复方新诺明 | 2 | 22.22 | 7 | 20.00 | |
| 磺胺异恶唑 | 3 | 33.33 | 14 | 40.00 | |
44株多粘菌素B≥8的沙门菌中,仅有2株对多粘菌素E及16种抗生素均敏感(食源性沙门菌1株,人源性沙门菌1株),其余均为多重耐药菌株。同时耐受多粘菌素及三代头孢的菌株有7株,其中食源性沙门菌2株(分别为鼠伤寒沙门菌及肠炎沙门菌),人源性沙门菌5株(3株鼠伤寒沙门菌、1株汤普逊沙门菌、1株德尔卑沙门菌)。
2.3 多粘菌素耐药表型与血清型关系对明确血清型的189株沙门菌进行分析,发现72株食源性沙门菌中,优势血清型为鼠伤寒沙门菌(S.Typhimurium,30.56%)及德尔卑(S.Derby,23.61%);117株人源性沙门菌中,优势血清型为肠炎沙门菌(S.Enteritidis,22.22%)及鼠伤寒沙门菌(S.Typhimurium,20.51%)。食源性鼠伤寒沙门菌及德尔卑沙门菌对多粘菌素B的MIC值均集中在0.25~0.5 μg/ml,对多粘菌素E的MIC值均集中在1~2 μg/ml。人源性肠炎沙门菌对多粘菌素B的MIC值于4 μg/ml及 > 16 μg/ml处分布较多,对多粘菌素E的MIC值大多 > 4 μg/ml。人源性鼠伤寒沙门菌对多粘菌素B的MIC值均集中在1~2 μg/ml,其次为 > 16 μg/ml。而对多粘菌素E的MIC值于1 μg/ml处分布最多, 见表 3。
| 最低抑菌浓度 (μg/ml) |
食源性优势血清型 (多粘菌素B/E)a |
人源性优势血清型 (多粘菌素B/E)a | |||
| S. Typhimurium | S.Derby | S. Enteritidis | S. Typhimurium | ||
| 0.25 | 9/1 | 8/0 | 1/0 | 3/1 | |
| 0.5 | 6/0 | 6/0 | 4/2 | 2/4 | |
| 1 | 3/9 | 3/5 | 2/3 | 6/12 | |
| 2 | 1/8 | 0/11 | 1/4 | 4/3 | |
| 4 | 0/2 | 0/1 | 9/3 | 2/0 | |
| 8 | 0/0 | 0/0 | 2/6 | 2/3 | |
| 16 | 0/0 | 0/0 | 0/4 | 1/0 | |
| > 16 | 3/1 | 0/0 | 7/4 | 4/0 | |
| 合计 | 22 | 17 | 26 | 24 | |
| 注:a多粘菌素B/E:一定最低抑菌浓度下,多粘菌素B及E的菌株数。 | |||||
对404株沙门菌进行mcr-1 PCR检测,发现1株人源鼠伤寒沙门菌HLJ-Sa10131 mcr-1基因阳性,mcr-1基因总体携带率为0.25%,人源菌株携带率为0.49%。通过核酸BLAST比对,与已报道的mcr-1基因序列100%一致(基因号KY646314)。S1-PFGE结果显示,该菌株含有~80 kb、~120 kb、~250 kb大小3个质粒,见图 4。接合转移实验结果提示该菌株对多粘菌素的耐药性可以约4.50%的效率转移至受体菌E.coli J53中。接合子S1-PFGE显示可转移质粒大小为~ 240 kb(图 4)。综上所述及接合子mcr-1 PCR扩增阳性提示mcr-1基因位于大小为~240 kb的可转移质粒上。耐药表型结果显示:接合子对三代头孢菌素、多粘菌素B及E、氯霉素、链霉素、复方新诺明、庆大霉素等12种抗生素耐药,见表 4。
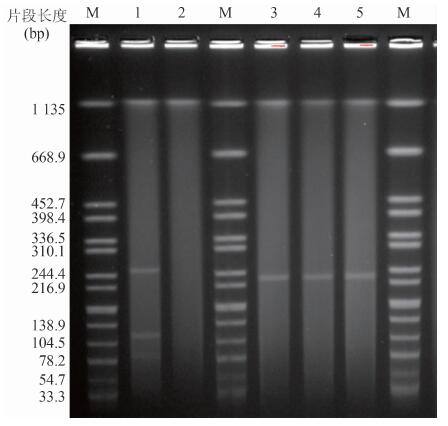
|
| 图 4 S1-PFGE图谱 Figure 4 S1-PFGE electrophoretogram 注:M:DNA Marker; 1:供体菌HLJ-Sa10131; 2:受体菌E.coli J53; 3~5:接合子1, 2, 3 |
| |
| 抗生素 | HLJ-Sa10131 | E.coli J53 | 接合子 |
| 氨苄西林 | > 128 | 4 | > 128 |
| 氯霉素 | > 32 | 8 | > 32 |
| 链霉素 | > 32 | 4 | 32 |
| 磺胺异恶唑 | > 512 | ≤8 | 512 |
| 四环素 | 32 | 2 | 2 |
| 复方新诺明 | > 8/152 | ≤0.13/2.4 | > 8/152 |
| 阿莫西林-克拉维酸钾 | 64/32 | 8/4 | > 64/32 |
| 头孢曲松 | > 16 | 0.5 | 16 |
| 头孢曲松-克拉维酸钾 | 4/4 | 0.12/4 | 4/4 |
| 头孢他啶 | 4 | 2 | 2 |
| 头孢他啶-克拉维酸钾 | 1/4 | ≤0.12/4 | 2/4 |
| 萘啶酸 | > 128 | ≤8 | 16 |
| 环丙沙星 | 1 | ≤0.03 | 0.12 |
| 头孢吡肟 | 32 | ≤0.5 | 16 |
| 亚胺培南 | ≤0.25 | ≤0.25 | ≤0.25 |
| 头孢西丁 | 4 | 16 | 8 |
| 氨曲南 | 16 | ≤0.5 | 2 |
| 头孢噻呋 | > 32 | 1 | 32 |
| 庆大霉素 | > 32 | ≤0.5 | 8 |
| 多粘菌素E | 8 | 2 | 8 |
| 多粘菌素B | 4 | 1 | 4 |
| 卡那霉素 | > 64 | ≤2 | > 64 |
| 强力霉素 | > 16 | 4 | 4 |
目前,不同抗菌药物组织委员会对多粘菌素敏感性折点的判定值不同[8]。沙门菌对多粘菌素B及E敏感性判定的标准目前尚无统一、明确的规定。SENTRY监测计划[9]按照MIC≥2 μg/ml作为判定沙门菌对多粘菌素B耐药的流行病学标准。按照这一折点标准,本试验中,沙门菌对多粘菌素B的耐药率为30.45%(123/404),略高于SENRY结果(24.00%)。根据本试验中沙门菌对多粘菌素B和E的MIC值分布特征,建议将多粘菌素B及E的临床耐药判定折点设为8 μg/ml(该折点尚需临床药物动力学数据的进一步验证)。按照这一判定标准,沙门菌对多粘菌素B和E的耐药率分别为10.89%和15.84%。且3种来源的沙门菌对多粘菌素B和E的耐药率存在差异,人源性沙门菌对多粘菌素的耐药率相对较高,提示应加强人源性耐药性沙门菌污染监测。
本研究表明多粘菌素B和E之间存在交叉耐药,对多粘菌素B耐药的细菌亦能通过同样的耐药机制对多粘菌素E耐药[8]。绝大多数人源性与食源性沙门菌为多重耐药菌,发现多株同时耐受多粘菌素与三代头孢菌素的沙门菌株,但均对亚胺培南敏感,这与目前临床常将多粘菌素与碳青霉烯类联用的方案相一致[10]。另外,多粘菌素耐药的沙门菌,其他测试的抗生素如头孢吡肟等,也存在敏感性,目前为止尚未检测到泛耐药沙门菌。发现相同来源,不同血清型沙门菌对多粘菌素的耐药性不同。另外,相同血清型,不同来源的沙门菌对多粘菌素的耐药性也不完全相同。沙门菌不同血清型对多粘菌素耐药表型差异的机制有待进一步研究。
最新研究发现,多粘菌素E的耐药性可通过携带mcr-1基因的质粒介导菌株间的水平转移[4]。目前全球发现携带mcr-1基因的致病菌主要包括大肠埃希菌、沙门菌、肺炎克雷伯菌及宋内志贺菌[11],发现mcr-1阳性人源沙门菌血清型主要包括鼠伤寒沙门菌、肠炎沙门菌、乙型副伤寒菌沙门菌爪哇变种、维尔肖沙门菌等。本研究在404株沙门菌中,发现1株腹泻患者来源的鼠伤寒沙门菌mrc-1阳性,且该基因位于高水平可转移的质粒上,提示该耐药基因可能通过质粒水平转移引起播散。但接合子中的质粒大小与供体菌中质粒大小存在差异,提示该质粒在沙门菌内可能处于活跃的复制重组状态,造成质粒大小的差异,具体机制有待进一步研究。此外,接合子耐药表型提示该质粒同时携带产ESBL(Extended-Spectrum β-Lactamases,超广谱β-内酰胺酶)相关基因及氯霉素-链霉素-磺胺异恶唑-卡那霉素耐药基因,说明该质粒为多重耐药大质粒。这是国内报道人源产ESBLs沙门菌携带mcr-1基因。有关该耐药质粒的来源、遗传背景与已报道的携带mcr-1基因的其他质粒的关系正在研究中。除mcr-1基因介导多粘菌素E抗性外,发现鼠伤寒沙门菌对多粘菌素耐药主要是通过pmrAB及phoPQ二元调控系统发生突变,从而激活arnBCADTEF及pmrCAB操纵子,引起脂质A的修饰[12],导致菌株对多粘菌素耐受。mig-14基因亦参与其中[13]。本研究中对多粘菌素耐药的绝大多数沙门菌株不携带mcr-1基因,其具体耐药机制是否由上述基因变异或其他耐药机制引起,尚待进一步研究。
总之,本研究发现我国人源产ESBLs鼠伤寒沙门菌携带可转移的mcr-1基因,且mcr-1基因与产ESBLs基因位于同一个可转移的多重耐药大质粒上。发现多种人源及食物源性沙门菌同时耐多粘菌素及三代头孢菌素。食品及野生动物中多粘菌素耐药菌株的发现,特别是在野生动物中发现多粘菌素E耐药菌株,提示应加强不同来源沙门菌的联合耐药监测、特别是可转移耐药基因及元件的检测及监测,控制耐药播散。
作者贡献:
曹阳 ORCID:0000-0002-0731-2555
曹阳:实验操作,数据分析,论文写作
遇晓杰:实验指导,数据分析
韩营营:实验操作
李杰:实验指导
阚飙:课题指导
闫梅英:实验设计与指导,论文指导与写作
| [1] | Li YP, Li ZR. Research development of polypeptides antibacterial agents[J]. World Notes on Antibiotics, 2009, 30(4): 148–153. (in Chinese) 李艳萍, 李卓荣. 多肽类抗菌剂研究进展[J]. 国外医药抗生素分册, 2009, 30(4): 148–153. |
| [2] | Cui AL, Li ZR. Research development of polymyxins[J]. World Notes on Antibiotics, 2015, 36(5): 205–210. (in Chinese) 崔阿龙, 李卓荣. 多黏菌素研究进展[J]. 国外医药抗生素分册, 2015, 36(5): 205–210. |
| [3] | Wei RR, Zhang CP, Zou M, et al. Advance in polymyxin resistence and mechanisms in gram-negative bacteria[J]. Progress in Veterinary Medicine, 2013, 34(2): 79–82. (in Chinese) 魏蕊蕊, 张纯萍, 邹明, 等. 革兰阴性菌对多黏菌素的耐药性及其机制研究进展[J]. 动物医学进展, 2013, 34(2): 79–82. |
| [4] | Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161–168. DOI:10.1016/S1473-3099(15)00424-7 |
| [5] | Morales AS, de Araújo JF, de Moura Gomes VT, et al. Colistin resistance in Escherichia coli and Salmonella enterica strains isolated from swine in Brazil[J]. Sci World J, 2012, 2012: 109795. |
| [6] | Anjum MF, Duggett NA, AbuOun M, et al. Colistin resistance in Salmonella and Escherichia coli isolates from a pig farm in Great Britain[J]. J Antimicrob Chemother, 2016, 71(8): 2306–2313. DOI:10.1093/jac/dkw149 |
| [7] | Barton BM, Harding GP, Zuccarelli AJ. A general method for detecting and sizing large plasmids[J]. Anal Biochem, 1995, 226(2): 235–240. DOI:10.1006/abio.1995.1220 |
| [8] | Yang Z, Yuan Z. New progresses of polymyxins in treatment of multidrug-resistant Gram-negative bacteria[J]. Chinese Journal of New Drugs and Clinical Remedies, 2013, 32(12): 931–936. (in Chinese) 杨政, 袁喆. 多黏菌素治疗多重耐药革兰阴性菌感染的新进展[J]. 中国新药与临床杂志, 2013, 32(12): 931–936. |
| [9] | Gales AC, Jones RN, Sader HS. Global assessment of the antimicrobial activity of polymyxin B against 54 731 clinical isolates of Gram-negative bacilli: report from the SENTRY antimicrobial surveillance programme (2001-2004)[J]. Clin Microbiol Infect, 2006, 12(4): 315–321. DOI:10.1111/j.1469-0691.2005.01351.x |
| [10] | Shen SQ, Ren HY, Cai Y. Research progress on combination of polymyxins[J]. Chinese Journal of Antibiotics, 2016, 41(3): 166–172. (in Chinese) 沈绍清, 任浩洋, 蔡芸. 多黏菌素联合用药研究进展[J]. 中国抗生素杂志, 2016, 41(3): 166–172. |
| [11] | Baron S, Hadjadj L, Rolain JM, et al. Molecular mechanisms of polymyxin resistance: knowns and unknowns[J]. Int J Antimicrob Agents, 2016, 48(6): 583–591. DOI:10.1016/j.ijantimicag.2016.06.023 |
| [12] | Olaitan AO, Morand S, Rolain JM. Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria[J]. Front Microbiol, 2014, 5: 643. |
| [13] | Brodsky IE, Ernst RK, Miller SI, et al. mig-14 is a Salmonella gene that plays a role in bacterial resistance to antimicrobial peptides[J]. J Bacteriol, 2002, 184(12): 3203–3213. DOI:10.1128/JB.184.12.3203-3213.2002 |
 2017, Vol. 32
2017, Vol. 32


