扩展功能
文章信息
- 杨元斌, 高红, 章丹阳, 闫鹏, 宋启发, 叶硕
- YANG Yuan-bin, GAO Hong, ZHANG Dan-yang, YAN Peng, SONG Qi-fa, YE Shuo
- 一起食源性疾病暴发中的副溶血性弧菌病原学分析
- Etiology of a Vibrio parahemolyticus caused foodborne-disease outbreak
- 疾病监测, 2017, 32(6): 481-485
- Disease Surveillance, 2017, 32(6): 481-485
- 10.3784/j.issn.1003-9961.2017.06.010
-
文章历史
- 收稿日期:2017-03-01
副溶血性弧菌(Vibrio parahemolyticus)是一种嗜盐性细菌,主要存在于近海岸的海水、海水沉积物和鱼虾贝类等水产品中,是我国沿海地区引起感染性腹泻的主要病原菌之一。国内文献报道,副溶血性弧菌引起的食物中毒已超过沙门菌,居细菌性食物中毒之首[1-3]。2016年夏季,某外地旅行团于宁波市某景区饭店聚餐后,陆续有人出现腹痛、腹泻、呕吐等食物中毒症状,实验室检查均有WBC升高(12.9×109/L~22.8×109/L),发病高峰为就餐后13~15 h,累计发病15例,参与聚餐的另外22人及该团未参与聚餐的12人未发病。宁波市疾病预防控制中心(CDC)负责对患者启动流行病学调查、实验室检测工作。市场监督部门负责采集可疑食品进行病原菌分离,但因可疑食物未留样,未能获取可疑食品的病原菌污染信息。通过流行病学调查,结合患者临床表现以及患者腹泻标本的细菌分离、鉴定,确定该起食物中毒是由混合血清型副溶血性弧菌感染引起。本文从实验室角度将该起食物中毒的病原学特点分析如下。
1 材料与方法1.1 材料1.1.1 菌株来源副溶血性弧菌共8株,分别来自2016年夏季一起食源性疾病暴发中的15例腹泻患者中的8例的粪便标本。
1.1.2 主要仪器与试剂脉冲场凝胶电泳仪CHEF Mapper XA和凝胶成像仪Gel Doc XR+(Bio-Rad,美国);蛋白酶K、限制性内切酶SfiⅠ/NotⅠ(Promega,美国);低熔点琼脂糖(LONZA,美国);弧菌显色平板(CHROMagar®,法国);全自动细菌鉴定仪Vitek 2 Compact(生物梅里埃,法国);副溶血性弧菌诊断血清(Denka Seiken日本);ABI Step One Plus荧光PCR仪(美国);副溶血性弧菌(tdh、trh、tlh)3重核酸检验试剂盒(荧光PCR法)(深圳生科原生物股份有限公司)。
1.2 方法1.2.1 细菌的鉴定及血清学分型按照GB 4789.72013《食品安全国家标准食品微生物学检验副溶血性弧菌检验》中的方法,粪便标本接种于3%NaCl的碱性胨水37 ℃增菌16 h,分离于弧菌显色培养基,可疑菌落以Vitek 2 Compact全自动细菌鉴定仪进行系统生化鉴定。用3%NaCl TSA培养基上的菌苔做玻片凝集检测K抗原。另取新鲜培养物至3% NaCl灭菌盐水试管中研磨制成均匀浓厚的菌悬液,经121 ℃灭菌1 h,4 000 r/min离心15 min,吸弃上清液,再用3%NaCl灭菌盐水重悬,此菌悬浮液用于检测O抗原,并用生理盐水作为对照。
1.2.2 抗生素敏感试验参照《全国临床检验操作规程》第4版(卫生部2014) 和美国临床实验室标准化委员会(CLSI 2016),采用MIC法进行抗生素敏感试验,10种抗菌药物分别为帕拉西林/他唑巴坦、头孢曲松、头孢吡肟、氨曲南、亚胺培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、复方新诺明。判定标准参照CLSI 2016药敏试验指南中规定的“其他非肠杆菌科菌的解释标准”。质控菌株为大肠埃希菌ATCC25922。
1.2.3 细菌DNA提取用水煮法粗提DNA:经复苏的分离株接种于3%NaCl TSA斜面培养基,37 ℃培养18~24 h后,挑取1环菌苔于200 μl灭菌水中充分研磨,菌悬液于100 ℃水浴10 min后冰浴5 min,1 000 r/min离心5 min,上清即为菌株DNA稀释液。
1.2.4 毒力因子PCR检测对8株副溶血性弧菌进行毒力基因(tdh、trh、tlh)PCR检测[4-5]。按照3重核酸检验试剂盒要求,将细菌DNA模板加入要求的反应体系,反应条件设置为UNG处理50 ℃,2 min,95 ℃预变性,3 min;95 ℃,5 s;55 ℃,60 s,45个循环。
1.2.5 脉冲场凝胶电泳(pulsed-fieldgel electrophoresis,PFGE)分型参照PulseNet China副溶血性弧菌PFGE实验步骤[6],选择NotⅠ与SfiⅠ内切酶分别对8株副溶血性弧菌进行酶切分型分析。标准分子量菌株为布伦登卢普沙门菌(H9812)[7]。电泳图谱使用Bionumerics 6.6软件进行聚类分析,采用PulseNet China提供的China MasterScripts v5.01标准脚本建立数据库,以H9812株作为标准。每条带型间的相似度用Dice系数来衡量,条带位置差异容许度选择1.5%,优化值选择1.5%。用非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)进行分析,同时进行2种内切酶图谱的组合聚类分析,最后导出聚类图。参考Tenover原则判断菌株间的关系:酶切后图谱完全一致定为同一菌株型;酶切后图谱有1~3条带不同者,可认为菌株间关系较密切;酶切后图谱如有3条以上条带不同者则认为菌株间关系不密切[8]。
2 结果2.1 血清学分型从15例腹泻患者中的8例粪便标本分离出8株副溶血性弧菌,其中2株为O3:K6血清型,另外6株为O4:KUT血清型。
2.2 抗生素敏感试验8株副溶血性弧菌对10种选定的抗生素均敏感,未发现耐药株。
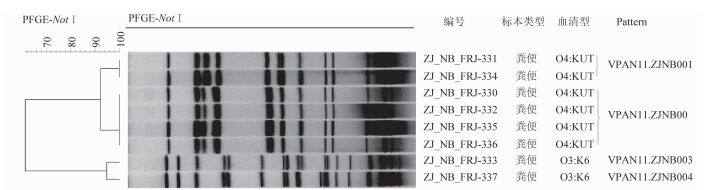
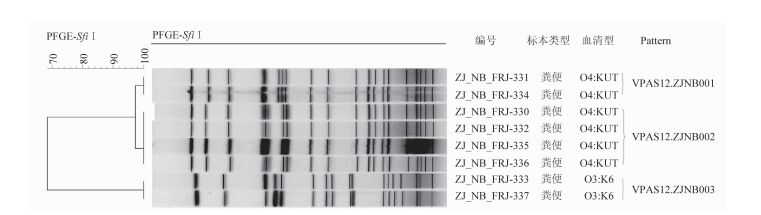
2.3 毒力基因及分子分型采用实时荧光PCR方法检测毒力基因,8株副溶血性弧菌菌株tdh、tlh基因均阳性,trh基因均阴性。8株副溶血性弧菌菌株经Not Ⅰ内切酶消化后,共产生4个PFGE带型,分别为VPAN11.ZJNB001~VPAN11.ZJNB004型,见图 1;经SfiⅠ内切酶消化后,产生3个PFGE带型,分别为VPAS12.ZJNB001~VPAS12.ZJNB003型,见图 2。对8株细菌两种内切酶指纹图谱进行组合聚类分析,确认4株血清型为O4:KUT的菌株间相似度为100%,为同一克隆,该克隆为VPAN11.ZJNB002/VPAS12.ZJNB002型,是本次食物中毒分离株的最优势带型,见图 3。
|
| 图 1 8株副溶血性弧菌使用内切酶NotⅠ的PFGE分型聚类图 Figure 1 PFGE analysis of 8 Vibrio parahaemolyticus isolates by Not Ⅰ digestion |
| |
|
| 图 2 8株副溶血性弧菌使用内切酶SfiⅠ的PFGE分型聚类结果 Figure 2 PFGE analysis of 8 Vibrio parahaemolyticus isolates by SfiⅠ digestion |
| |

|
| 图 3 8株副溶血性弧菌NotⅠ和SfiⅠ双内切酶PFGE组合聚类分析 Figure 3 Composite PFGE analysis of 8 isolates by NotⅠ and SfiⅠ digestion |
| |
本次食物中毒未获得可疑食物的留样,故未能从可疑食物中分离到致病菌。通过对可疑餐次暴露食品的病例对照研究发现,本次聚餐的海鲜食品、腌渍菜及凉拌菜为高度可疑食物,推测该起副溶血性弧菌食物中毒由海鲜食物、腌渍食物或者不洁砧板加工食物引起,符合副溶血性弧菌食物中毒的传播特征。15例腹泻患者粪便标本有8例分离到副溶血性弧菌,标本的阳性率为53.33%。血清学诊断的结果确认8株副溶血性弧菌的血清型为O3:K6与O4:KUT,与该细菌在国内外流行的优势血清型基本一致[9]。
本文采用PulseNet China网络实验室推荐的副溶血性弧菌PFGE标准分型方法进行分型分析。其中规定NotⅠ为首选内切酶,SfiⅠ作为次选内切酶。
本研究兼用NotⅠ、SfiⅠ两种内切酶对副溶血性弧菌分离株的基因组DNA进行酶切,再进行PFGE单酶切聚类分析与双酶切组合聚类分析。所有分离株经NotⅠ酶切后分成4个带型,经SfiⅠ酶切后分成3个带型。6株O4:KUT菌株采用两种内切酶的PFGE分型结果完全一致,双酶切组合聚类分析显示,其中2株同属于VPAN11.ZJNB001/VPAS12.ZJNB001带型,另4株同属于VPAN11.ZJNB002/VPAS12.ZJNB002带型,上述两带型副溶血性弧菌克隆株之间只有2~3个条带差异,根据Tenover原则,可以判断为高度相关。剩余2株O3:K6菌株虽经SfiⅠ酶切后带型比对相似度为100%,但经NotⅠ酶切后比对相似度为94%,说明二者并非完全相同的带型,为非同克隆。
本次食物中毒未能从可疑食物中获得标本及分离细菌,但是从食物中毒不同患者的粪便中分离到相同克隆的副溶血性弧菌,其他致病菌(沙门菌、志贺菌、金黄色葡萄球菌等)均未检出。经实验室检测推断这是一起由于共同暴露于同一污染食物引起的食源性疾病暴发事件。
副溶血性弧菌毒力因子主要为tdh和trh,具有溶血活性、肠毒素和致死作用,tdh、trh基因也被作为有毒株和无毒株的分子标识。TLH是一种非典型的磷脂酶,具有种属特异性,tlh作为副溶血性弧菌的特异性基因,对该菌的分子诊断、监测方面具有较高的应用价值[10-12]。本研究毒力基因的检测结果表明,所有副溶血性弧菌暴发分离株均携带tdh、tlh毒力基因,trh毒力基因均阴性,提示所有的分离株都存在毒力,符合文献中关于该菌临床分离株毒力基因携带特点的相关报道[13-14]。
本起食源性疾病暴发事件比较特殊,8株副溶血性弧菌的分离、生化鉴定以及初步的血清学鉴定工作由2家区CDC以及1家市属医院完成,菌株最终的血清学确认及PFGE分型工作由宁波市CDC完成。由于菌株的初分离过程确定没有针对多个菌落分别进行血清型鉴定,所以3个初分离部门均报告单一血清型。而最终8株细菌的血清学鉴定结果提示该起暴发事件是由2个血清型的副溶血性弧菌引起,类似的多克隆混合感染国内也有报道[15-17]。检验人员必须提高对混合株感染的认识水平,针对每一份副溶血性弧菌食物中毒的标本,应尽量多挑取可疑菌落分别进行分离、血清型鉴定,并针对血清分型结果进行进一步的PFEG分子分型,以确认菌株是否为相同克隆。只有避免该菌多克隆混合感染情况下的漏检,才能避免多克隆导致暴发后出现患者分离株与可疑食物分离株分型不符的情况。实验室真实地反映食物中毒事件中食物的污染及患者的感染情况,才能为流行病学调查及溯源分析提供充分、可靠的证据。
作者贡献:
ORCID:0000-0002-9666-1123
杨元斌:细菌耐药分析,脉冲场凝胶电泳的全部操作、图谱生成、数据库建立、聚类分析、结果分析
高红:毒力基因的检测
章丹阳:菌株的血清学分型
闫鹏:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
宋启发:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
叶硕:脉冲场凝胶电泳的部分操作,菌株收集,结果分析
| [1] |
Mao XD, Hu JF, Liu XM.
Epidemiological characteristics of bacterial foodborne disease during the year 2003-2007 in China[J].
Chinese Journal of Food Hygiene, 2010, 22(3): 224–228.
(in Chinese) 毛雪丹, 胡俊峰, 刘秀梅. 2003-2007年中国1060起细菌性食源性疾病流行病学特征分析[J]. 中国食品卫生杂志, 2010, 22(3): 224–228. |
| [2] |
Li JS, Liang JH, Ke BX, et al.
Surveillance of foodborne disease in Guangdong, 2012[J].
South China Journal of Preventive Medicine, 2013, 39(6): 10–16.
(in Chinese) 李剑森, 梁骏华, 柯碧霞, 等. 2012年广东省食源性疾病监测结果分析[J]. 华南预防医学, 2013, 39(6): 10–16. |
| [3] | Zhang HZ, Sun SF, Shi WM, et al. Serotype, virulence, and genetic traits of foodborne and clinical Vibrio parahaemolyticus isolates in Shanghai, China[J]. Foodborne Pathog Dis, 2013, 10(9): 796–804. DOI:10.1089/fpd.2012.1378 |
| [4] |
Zhang SH, Shen B, Wang ZF.
Serotyping and detection of virulence genes in Vibrio parahaemolyticus from feces of a food poisoning patient and suspected food[J].
Chinese Journal of Nosocomiology, 2013, 23(6): 1478–1780.
(in Chinese) 张少华, 沈飚, 王忠发. 一起食物中毒患者粪便与可疑食品中副溶血性弧菌血清分型与毒力基因检测分析[J]. 中华医院感染学杂志, 2013, 23(6): 1478–1780. |
| [5] | Bej AK, Patterson DP, Brasher CW, et al. Detection of total and Hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh[J]. J Microbiol Methods, 1999, 36(3): 215–225. DOI:10.1016/S0167-7012(99)00037-8 |
| [6] | Ribot EM, Fair MA, Gautom R, et al. Standardization of pulsed-field gel electrophoresis protocols for the subtyping of Escherichia coli O157:H7, Salmonella, and Shigella for PulseNet[J]. Foodborne Pathog Dis, 2006, 3(1): 59–67. DOI:10.1089/fpd.2006.3.59 |
| [7] | Hunter SB, Vauterin P, Lambert-Fair MA, et al. Establishment of a universal size standard strain for use with the PulseNet standardized pulsed-field gel electrophoresis protocols:converting the national databases to the new size standard[J]. J Clin Microbiol, 2005, 43(3): 1045–1050. DOI:10.1128/JCM.43.3.1045-1050.2005 |
| [8] | Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233–2239. |
| [9] | Martinez-Urtaza J, Simental L, Velasco D, et al. Pandemic Vibrio parahaemolyticus O3:K6, Europe[J]. Emerg Infect Dis, 2005, 11(8): 1319–1320. DOI:10.3201/eid1108.050322 |
| [10] | Takeda Y. Thermostable direct hemolysin of Vibrio parahaemolyticus[J]. Methods Enzvmol, 1988, 165: 189–193. DOI:10.1016/S0076-6879(88)65029-4 |
| [11] | Nishibuchi M, Taniguchi T, Misawa T, el al. Cloning and nucleotide sequence of the gene(trh)encoding the hemolysinrelated to the thermostable direct hemolysin of Vibrio parahaemolyticus[J]. Infect Immun, 1989, 57(9): 2691–2697. |
| [12] | Nishibuchi M, Kaper JB. Thermostable direct hemolysin gene of Vibrio parahaemolyticus:avirulence gene acquired by a marine bacterium[J]. Infect Immun, 1995, 63(6): 2093–2099. |
| [13] |
Shi XL, Wang Y, Hu QH, et al.
Molecular characterization of Vibrio parahaemolyticus collected from human infections in Shenzhen, between 2002 and 2008[J].
Chinese Journal of Epidemiology, 2013, 34(6): 609–613.
(in Chinese) 石晓路, 王艺, 扈庆华, 等. 深圳地区2002-2008年副溶血弧菌分子特征研究[J]. 中华流行病学杂志, 2013, 34(6): 609–613. |
| [14] |
Li WW, Mei LL, Tang Z, et al.
Analysis of molecular features of clinical Vibrio parahaemolyticus strains in China[J].
Chinese Journal of Preventive Medicine, 2014, 48(1): 44–52.
(in Chinese) 李薇薇, 梅玲玲, 唐震, 等. 2007-2009年中国副溶血性弧菌临床分离株分子特征分析[J]. 中华预防医学杂志, 2014, 48(1): 44–52. |
| [15] |
Yuan M, Li B, Cheng Y, et al.
Laboratory detection of food poinsoning caused by Vibrio parahaemolyticus[J].
Disease Surveillance, 2012, 27(3): 214–217.
(in Chinese) 袁梦, 李博, 程妍, 等. 一起副溶血性弧菌引起食物中毒实验室溯源检测[J]. 疾病监测, 2012, 27(3): 214–217. |
| [16] |
Fang YZ, Huang SW, Luo Y, et al.
Research on toxin gene and molecular genotype of Vibrio parahaemolyticus with different serotypes isolated from samples of one food poisoning[J].
Chinese Journal of Health Laboratory Technology, 2012, 22(1): 96–98.
(in Chinese) 方叶珍, 黄世旺, 罗芸, 等. 一起两种血清型副溶血性弧菌食物中毒的毒力基因及分子分型研究[J]. 中国卫生检验杂志, 2012, 22(1): 96–98. |
| [17] |
Huang Y, Tang ZZ, Wang H, et al.
Detection of virulence gene and serotyping of Vibrio parahaemolyticus isolated from one food poisoning[J].
Journal of Applied Preventive Medicine, 2012, 18(4): 197–199.
(in Chinese) 黄彦, 唐振柱, 王红, 等. 一起不同血清型食物中毒副溶血性弧菌毒力基因检测[J]. 应用预防医学, 2012, 18(4): 197–199. |
 2017, Vol. 32
2017, Vol. 32


