扩展功能
文章信息
- 刘笑舒, 廖凤, 于栓宝, 李文革, 陈小萍, 吴媛, 卢金星
- LIU Xiao-shu, LIAO Feng, YU Shuan-bao, LI Wen-ge, CHEN Xiao-ping, WU Yuan, LU Jin-xing
- 咔哒唑胺与利奈唑胺对艰难梭菌的敏感性实验
- Sensitivity test of Clostridium difficile to cadazolid and linezolid
- 疾病监测, 2017, 32(8): 683-686
- Disease Surveillance, 2017, 32(8): 683-686
- 10.3784/j.issn.1003-9961.2017.08.017
-
文章历史
- 收稿日期:2017-01-16
2. 云南省第一人民医院, 云南 昆明 650034
2. The First People's Hospital of Yunnan Province, Kunming 650034, Yunnan, China Corresponding authors:WU Yuan, Email:wuyuan@icdc. cn; LU Jin-xing, Email:lujinxing@icdc. cn
艰难梭菌(Clostridium difficile)是一种严格厌氧的革兰阳性芽孢杆菌,以产A/B毒素以及少量菌株产二元毒素致病。15%~20%的抗生素药物治疗后产生的腹泻由艰难梭菌导致,它也是成年人医院感染性腹泻的主要病因。艰难梭菌感染(CDI)临床表现变化大,可从无症状至温和的自限性腹泻,再导致比较严重的伪膜性肠炎、结肠炎症和组织损伤,甚至巨结肠症、肠穿孔、败血症以及中毒性休克等[1-2]。CDI的患病率和病死率居高不下,是导致老年住院患者发病以及死亡的主要原因。美国、加拿大以及欧洲的多项调查研究表明,随着强毒株核糖体027型以及核糖体078型的出现,CDI呈上升趋势,已经成为全球公共卫生的新挑战[1-9]。如何高效及时地防控艰难梭菌感染成为难题。治疗CDI的主要抗菌药物有万古霉素与甲硝唑,但治疗效果不佳,复发率高,菌株的耐药形式也越发严峻[10-12]。同时,CDI的治疗也导致肠道菌群对万古霉素产生耐药性[13]。咔哒唑胺是一种新型噁唑烷酮类药物,目前已用于CDI性腹泻的治疗[14]。本实验采用咔哒唑胺与利奈唑胺,对10株不同基因型别的艰难梭菌、1株产气荚膜梭菌和1株脆弱拟杆菌进行药物敏感性实验,获得各菌株测试药物对应的最低抑菌浓度(minimun inhibitory concentration,MIC)值。选取其中1株艰难梭菌,试验咔哒唑胺对菌株芽孢形成的影响,从而对药物进行评价。
1 材料与方法 1.1 实验菌株选择10株艰难梭菌,其中4株ATCC菌株具有代表性的毒素特征和基因型,包括具有高致病性的艰难梭菌的高毒株核糖体027型ATCC BAA-1803;其余6株为临床分离样本;不同基因型别的艰难梭菌,拟用以对比不同基因型别菌株对药物敏感度的差异;另外,1株产气荚膜梭菌和1株脆弱拟杆菌作为对照,对2种药物咔哒唑咹与利奈唑胺进行敏感性测试。选择艰难梭菌高产毒株ATCC BAA-1803对药物咔哒唑咹进行芽孢形成影响的实验,见表 1。
| 菌株名称 | 编号 | 核糖体/ ST型别 | 毒素型别 |
| 艰难梭菌 | ATCC BAA-1803 | 027 | A+B+, cdtB+ |
| 艰难梭菌 | ATCC 9689 | 001 | A+B+, cdtB- |
| 艰难梭菌 | ATCC 700057 | 038 | A-B-, cdtB- |
| 艰难梭菌 | ATCC 43598 | 017 | A-B+, cdtB- |
| 艰难梭菌 | SH 0201-018 | 017 | A-B+, cdtB- |
| 艰难梭菌 | XA 0204-005 | ST54 | A+B+, cdtB- |
| 艰难梭菌 | HZ 0206-001 | ST1 | A+B+, cdtB+ |
| 艰难梭菌 | TAFY 36 | ST3 | A+B+, cdtB- |
| 艰难梭菌 | ZR22 | ST35 | A+B+, cdtB- |
| 艰难梭菌 | GZ15 | ST119 | A-B-, cdtB- |
| 产气荚膜梭菌 | ATCC 13124 | ||
| 脆弱拟杆菌 | ATCC 25285 |
恒温厌氧培养箱(德国Memmert),温控高速离心机(德国Eppendorf),布氏培养基(美国BD),琼脂粉(美国BD),ddH2O (美国Gibco),DMSO(日本Sigma),脱纤维羊血(北京宝特),氯化血红素和维生素K(北京陆桥)。
1.3 方法 1.3.1 贮存浓度药物制备将试验药物使用相应溶剂分别配制成浓度3 840 μg/ml的储存液,置-70 ℃冰箱中备用;使用DMSO溶解咔哒唑胺,使用ddH2O溶解利奈唑胺。本实验标准使用clinical and laboratory standards institute (CLSIM) M11-A7关于确定厌氧菌MICs的指导文件。
1.3.2 含抗生素平板制备布氏琼脂培养基高压灭菌(121 ℃,20 min)后待其温度降到50 ℃,加入羊血、氯化血红素和维生素K,其终浓度分别为5%、1‰和1‰;加入试验抗生素,制备浓度范围0.5~16.0 μg/ml的平板(梯度浓度分别为0.5、1.0、2.0、4.0、8.0、16.0 μg/ml);若无菌株生长,未得出MIC值,则制备浓度范围0.03~0.25 μg/ml的平板(梯度浓度分别为0.031、0.063、0.125、0.25 μg/ml)再次实验。
1.3.3 菌悬液制备及药敏实验将冻存菌株接种在布氏琼脂血平板上培养,挑取单菌落第2次接种培养(艰难梭菌48 h;产气荚膜梭菌和脆弱拟杆菌24 h);用布氏培养液制备菌悬液(0.5 McF麦氏浊度)。吸取制备好的菌悬液2 μl,点接种到相应浓度的抗生素平板及对照平板上,每个平板接种9个点。每个菌株的每一种药物平板按照试验前有氧、厌氧,浓度由低到高,试验后厌氧、有氧的顺序依次接种。37 ℃,厌氧培养48 h,需氧对照平板在有氧环境中培养48 h。
1.3.4 咔哒唑胺对艰难梭菌芽孢形成影响实验艰难梭菌(ATCC BAA-1803) 在布氏培养液(1‰氯化血红素和1‰维生素K)中37 ℃厌氧培养6~7 h至对数生长期(约0.5 McF麦氏浊度);将20 μl菌悬液加入到含有1 ml布氏培养液(含浓度0.03~0.25 μg/ml的抗生素)中,37 ℃厌氧培养4 d。将MIC定义为完全抑制可见生长(浊度)的浓度,0.5×MIC是容许可见生长药物的最高浓度。
吸取40 μl菌悬液加入到2 ml布氏培养液(含0.5×MIC浓度的抗生素)中,37 ℃厌氧培养48 h和96 h。全部细胞菌落形成单位(CFU)评价:培养物100 μl的10倍稀释液涂布于布氏琼脂血平板上,37 ℃厌氧培养48 h,对菌落计数(N1)。在室温下,向菌液添加1倍体积无水乙醇处理1 h,选择性杀死营养细胞,随后涂布于布氏琼脂血平板上,37 ℃厌氧培养48 h,对芽孢计数(N2)。参考文件CN102014903A专利说明书-20-27部分。平行设置空白对照。
1.4 数据分析药敏实验中得到不同基因型别艰难梭菌的MIC值。芽孢形成实验中得到MIC值与芽孢形成率(N2/N1)。
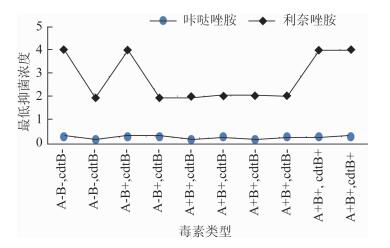
2 结果实验得到各菌株对2种药物的MIC值,见表 2。艰难梭菌咔哒唑胺MIC为0.25(0.03~0.25)μg/ml,利奈唑胺MIC为4.0(0.5~16.0)μg/ml,咔哒唑胺MIC值低于利奈唑胺16倍。2种抗生素对不同基因型别、毒素型别的艰难梭菌均有抑菌作用,其中艰难梭菌的高毒株核糖体027型菌株(ATCC BAA-1803) 咔哒唑胺MIC为0.25 μg/ml,利奈唑胺MIC为4.0 μg/ml,2种抗生素对高毒致病株有有效的抑菌效果。具有相同基因型的菌株,对药物的耐药能力不同。具有相同毒素类型的菌株,对药物的耐药能力并不相同。2种药物对不同毒素基因类型菌株MIC值比较见图 1。2种药物同时对产气荚膜梭菌有良好抑菌效果:咔哒唑胺MIC为0.125(0.03~0.25)μg/ml,菌株利奈唑胺MIC为4.0(0.5~16.0)μg/ml。同时,咔哒唑胺对脆弱拟杆菌无抑菌效果,而利奈唑胺对其有抑菌效果,MIC值为8.0(0.5~16.0)μg/ml。2种药物的抑菌效果见表 3、4。
| 菌株名称 | 最低抑菌浓度(μg/ml) | |
| 咔哒唑胺 | 利奈唑胺 | |
| 艰难梭菌SH 0201-018 | 0.250 | 4.0 |
| 艰难梭菌TAFY 36 | 0.125 | 2.0 |
| 艰难梭菌ZR22 | 0.250 | 2.0 |
| 艰难梭菌ATCC 700057 | 0.250 | 4.0 |
| 艰难梭菌XA 0204-005 | 0.125 | 2.0 |
| 艰难梭菌GZ15 | 0.125 | 2.0 |
| 艰难梭菌HZ 0206-001 | 0.250 | 4.0 |
| 艰难梭菌ATCC9689 | 0.250 | 2.0 |
| 艰难梭菌ATCC BAA-1803 | 0.250 | 4.0 |
| 艰难梭菌ATCC 43598 | 0.250 | 2.0 |
| 产气荚膜梭菌ATCC 13124 | 0.125 | 4.0 |
| 脆弱拟杆菌ATCC 25285 | NA | 8.0 |
| 注:NA为咔哒唑胺对脆弱拟杆菌无杀菌作用 | ||
|
| 图 1 2种药物对不同毒素基因型菌株的最低抑菌浓度 Figure 1 MICs of two antibiotics to strains with different toxin type |
| |
| 菌株 | 对照 需氧 | 对照 厌氧 | 药物浓度(μg/ml) | 对照 厌氧 | 对照 需氧 | |||
| 0.031 | 0.063 | 0.125 | 0.250 | |||||
| ATCC BAA-1803 | - | + | + | + | + | - | + | - |
| ATCC 9689 | - | + | + | + | + | - | + | - |
| ATCC 700057 | - | + | + | + | + | - | + | - |
| ATCC 43598 | - | + | + | + | + | - | + | - |
| SH 0201-018 | - | + | + | + | + | - | + | - |
| XA 0204-005 | - | + | + | + | - | - | + | - |
| HZ 0206-001 | - | + | + | + | + | - | + | - |
| TAFY 36 | - | + | + | + | - | - | + | - |
| ZR22 | - | + | + | + | + | - | + | - |
| GZ15 | - | + | + | + | - | - | + | - |
| ATCC 13124 | - | + | + | + | - | - | + | - |
| ATCC 25285 | - | + | + | + | + | + | + | - |
| 菌株 | 对照 需氧 | 对照 厌氧 | 药物浓度(μg/ml) | 对照 厌氧 | 对照 需氧 | |||||
| 0.5 | 1.0 | 2.0 | 4.0 | 8.0 | 16.0 | |||||
| ATCC BAA-1803 | - | + | + | + | + | - | - | - | + | - |
| ATCC 9689 | - | + | + | + | - | - | - | - | + | - |
| ATCC 700057 | - | + | + | + | + | - | - | - | + | - |
| ATCC 43598 | - | + | + | + | - | - | - | - | + | - |
| SH 0201-018 | - | + | + | + | + | - | - | - | + | - |
| XA 0204-005 | - | + | + | + | - | - | - | - | + | - |
| HZ 0206-001 | - | + | + | + | + | - | - | - | + | - |
| TAFY 36 | - | + | + | + | - | - | - | - | + | - |
| ZR22 | - | + | + | + | - | - | - | - | + | - |
| GZ15 | - | + | + | + | - | - | - | - | + | - |
| ATCC 13124 | - | + | + | + | + | - | - | - | + | - |
| ATCC 25285 | - | + | + | + | + | + | - | - | + | - |
芽孢形成影响实验发现艰难梭菌(ATCC BAA-1803) 咔哒唑胺的MIC为0.25 μg/ml。在含0.125 μg/ml咔哒唑胺的布氏培养液(96 h)中无芽孢形成;在布氏培养液(不含抗生素)中的芽孢形成率为2.610×10-4。
3 讨论咔哒唑胺是新型的噁唑烷酮类抗菌药物,是一种嵌合药物,将2种具有不同作用机制的药物相结合,在噁唑烷酮结构的基础上增加了一个氟喹诺酮的侧链,使药物活性更强、降低耐药率[14]。咔哒唑胺的主要作用方式为抑制细菌蛋白的合成,可干扰细菌蛋白的翻译,能够抑制艰难梭菌A、B毒素的形成[15]。同时具有抑制芽孢形成的作用。
本研究发现艰难梭菌咔哒唑胺的MIC为0.25 μg/ml,利奈唑胺的MIC为4.0 μg/ml,艰难梭菌对咔哒唑胺的MIC值低于利奈唑胺16倍,咔哒唑胺对艰难梭菌有更高效的杀菌作用。艰难梭菌的高毒株(核糖体027型菌株ATCC BAA-1803) 咔哒唑胺的MIC为0.25 μg/ml。具有相同基因型的菌株,对药物的耐药能力不同。具有相同毒素类型的菌株,对药物的耐药能力并不相同。菌株的产毒增加与其对药物的耐受性不成正比。2种药物同时对产气荚膜梭菌有良好抑菌效果:产气荚膜梭菌咔哒唑胺的MIC为0.125 μg/ml,利奈唑胺的MIC为4.0 μg/ml。咔哒唑胺对脆弱拟杆菌不产生效果,说明其并不对此类肠道正常菌群产生抑菌作用,而利奈唑胺对其有抑菌效果,MIC为8.0 μg/ml。
研究发现艰难梭菌(ATCC BAA-1803) 在布氏培养液中咔哒唑胺的MIC值为0.25 μg/ml,在含0.5×MIC浓度(0.125 μg/ml)咔哒唑胺的布氏培养液中无芽孢形成,而对照组的芽孢形成率为2.610×10-4。咔哒唑胺有明显的抑制芽孢形成的作用。芽孢抵抗理化作用的能力强,产芽孢细菌的芽孢是其重要的致病作用因子,咔哒唑胺能有效杀灭芽孢,是治疗艰难梭菌感染的高效药物。咔哒唑胺对脆弱拟杆菌并不产生抑菌效果,表明对其他种肠道菌群的影响相对低于利奈唑胺,能够更适用于多种微生物共存的肠道环境的治疗,该药物可针对特殊致病菌,并不过分影响肠道正常微生态环境,能减少抗生素治疗过程中产生的再次感染。
综合考虑抑菌效果、抑制芽孢生长的作用以及对其他种肠道细菌的影响,目前使用咔哒唑胺治疗艰难梭菌感染是相对有效的方法。
作者贡献:
刘笑舒 ORCID:0000-0001-9233-1576
廖凤 ORCID:0000-0001-7528-9513
刘笑舒:实验操作,论文撰写
廖凤:标本收集、筛选,实验操作
于栓宝:实验操作
李文革:实验操作
陈小萍:实验操作
吴媛:论文修改
卢金星:项目指导,论文修改
| [1] |
Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection:new developments in epidemiology and pathogenesis[J]. Nat Rev Microbiol, 2009, 7(7): 526-536. DOI:10.1038/nrmicro2164 |
| [2] |
Bauer MP, Notermans DW, van Benthem BH, et al. Clostridium difficile infection in Europe:a hospital-based survey[J]. Lancet, 2011, 377(9759): 63-73. DOI:10.1016/S0140-6736(10)61266-4 |
| [3] |
Carroll KC, Bartlett JG. Biology of Clostridium difficile:implications for epidemiology and diagnosis[J]. Annu Rev Microbiol, 2011, 65: 501-521. DOI:10.1146/annurev-micro-090110-102824 |
| [4] |
Gerding DN. Global epidemiology of Clostridium difficile infection in 2010[J]. Infect Control Hosp Epidemiol, 2010, 31(Suppl 1): S32-34. |
| [5] |
Voth DE, Ballard JD. Clostridium difficile toxins:mechanism of action and role in disease[J]. Clin Microbiol Rev, 2005, 18(2): 247-263. DOI:10.1128/CMR.18.2.247-263.2005 |
| [6] |
Cornely OA, Crook DW, Esposito R, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA:a double-blind, non-inferiority, randomised controlled trial[J]. Lancet Infect Dis, 2012, 12(4): 281-289. DOI:10.1016/S1473-3099(11)70374-7 |
| [7] |
He M, Miyajima F, Roberts P, et al. Emergence and global spread of epidemic healthcare-associated Clostridium difficile[J]. Nat Genet, 2013, 45(1): 109-113. |
| [8] |
Lessa FC, Mu Y, Bamberg WM, et al. Burden of Clostridium difficile infection in the United States[J]. N Engl J Med, 2015, 372(9): 825-834. DOI:10.1056/NEJMoa1408913 |
| [9] |
Wiegand PN, Nathwani D, Wilcox MH, et al. Clinical and economic burden of Clostridium difficile infection in Europe:a systematic review of healthcare-facility-acquired infection[J]. J Hosp Infect, 2012, 81(1): 1-14. DOI:10.1016/j.jhin.2012.02.004 |
| [10] |
Kamboj M, Khosa P, Kaltsas A, et al. Relapse versus reinfection:surveillance of Clostridium difficile infection[J]. Clin Infect Dis, 2011, 53(10): 1003-1006. DOI:10.1093/cid/cir643 |
| [11] |
Brazier JS, Fawley W, Freeman J, et al. Reduced susceptibility of Clostridium difficile to metronidazole[J]. J Antimicrob Chemother, 2001, 48(5): 741-742. DOI:10.1093/jac/48.5.741 |
| [12] |
Baines SD, O'Connor R, Freeman J, et al. Emergence of reduced susceptibility to metronidazole in Clostridium difficile[J]. J Antimicrob Chemother, 2008, 62(5): 1046-1052. DOI:10.1093/jac/dkn313 |
| [13] |
Venugopal AA, Johnson S. Current state of Clostridium difficile treatment options[J]. Clin Infect Dis, 2012, 55(Suppl 2): S71-76. DOI:10.1093/cid/cis355 |
| [14] |
Karoli T, Mamidyala SK, Zuegg J, et al. Structure aided design of chimeric antibiotics[J]. Bioorg Med Chem Lett, 2012, 22(7): 2428-2433. DOI:10.1016/j.bmcl.2012.02.019 |
| [15] |
Locher HH, Caspers P, Bruyère T, et al. Investigations of the mode of action and resistance development of cadazolid, a new antibiotic for treatment of Clostridium difficile infections[J]. Antimicrob Agents Chemother, 2014, 58(2): 901-908. DOI:10.1128/AAC.01831-13 |
 2017, Vol. 32
2017, Vol. 32


