扩展功能
文章信息
- 李贵昌, 刘起勇
- Li Guichang, Liu Qiyong
- 恙虫病的流行现状
- Epidemic trend of scrub typhus in the world
- 疾病监测, 2018, 33(2): 129-138
- Disease Surveillance, 2018, 33(2): 129-138
- 10.3784/j.issn.1003-9961.2018.02.006
-
文章历史
- 收稿日期:2017-12-30
恙虫病(tsutsugamushi disease)也称灌丛斑疹伤寒(scrub typhus,ST)、螨传斑疹伤寒(mite-borne typhus)或恙螨传立克次体病(chigger-borne rickettsiosis),由携带恙虫病东方体(Orientia tsutsugamushi,Ot)的恙螨幼虫叮咬而引起感染,临床表现为发热、皮疹、淋巴结肿大、焦痂。严重可导致黄疸、脑膜炎、心肌炎和间质性肺炎等严重并发症,不经治疗的病死率中位数为6%[1]。多种纤恙螨属(Leptotrombidium)恙螨可以传播Ot。雌恙螨须经过卵传递Ot给下一代恙螨幼虫,经叮咬传播给人。因此,恙螨既是传播媒介也是储存宿主,在恙虫病的发病过程中起关键作用。
恙虫病是一种古老传染病,分布在亚洲东南部,西至阿富汗,东南至澳大利亚北部,东北至俄罗斯远东沿海的广大地区,该区域被称为“恙虫病三角”(Tsutsugamushi triangle)。在第二次世界大战(二战)期间,日军和盟军在东南亚恙虫病病例分别为2.0万和1.6万例[2]。近年来,在该区域外有恙虫病存在的证据,但并未引起重视[3]。本文通过对近30年恙虫病的流行趋势进行综述,以期为恙虫病的防控提供参考。
1 恙虫病传统疫区“恙虫病三角” 1.1 东亚及东北亚区域涵盖中国、日本、韩国和俄罗斯远东地区,朝鲜未见其相关报道,发病情况不明。
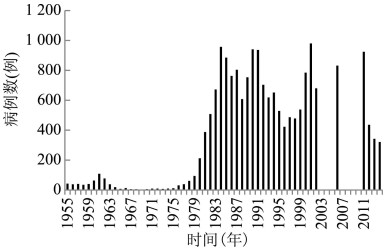
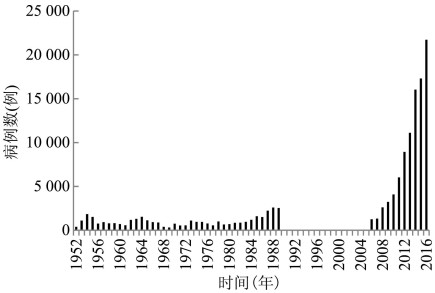
1.1.1 中国东晋葛洪《肘后备急方》首次记载恙虫病,称为沙虱毒,流行于岭南地区,在中国存在至少1 600余年[4]。1908年我国台湾恙虫病为中国近代最早记载,此后在台湾澎湖县、广西壮族自治区(广西)、西藏自治区(西藏)墨脱市、广东、福建、浙江、云南、四川和海南省等地陆续发现流行,1952- 1979年我国大陆地区恙虫病每年报告病例400~ 1 534例,1980年后病例数呈上升趋势,1988年达2 590例[4]。1990- 2005年无监测数据。2006- 2016年恙虫病报告病例数快速增长,11年间增加了15.4倍。2016年我国报告病例22 558例(包括疑似病例),报告发病率1.64/10万,见图 1[5]。
|
| 图 1 1952-2016年我国恙虫病报告发病数 Figure 1 Reported case numbers of scrub typhus in China, 1952-2016 |
| |
我国大陆地区恙虫病发病率快速增长,发病区域不断扩大。1986年以前,我国恙虫病疫区仅分布在长江以南,集中在广东、云南、福建和浙江4省,此后东北3省、山东、江苏、天津、山西、河北、江西、贵州、北京、陕西等省(直辖市)也陆续发现病例。2006年后发病数较高的地区有广西、云南、广东、福建、江苏、安徽和山东省(自治区),2016年7个省区的病例数占全部发病数的91.6%。目前,根据最新监测数据发现,恙虫病已扩散至除宁夏回族自治区(宁夏)和上海市以外的全部地区[5]。西北地区的新疆维吾尔自治区(新疆)、内蒙古自治区(内蒙古)、甘肃和青海省仅有个别病例报告。新疆的博尔塔拉、博乐、乌鲁木齐、米泉和吐鲁番等地健康人群曾检出Ot IgG抗体,在野鼠和博乐纤恙螨(L. bolei)中检测到Ot基因片段,内蒙古西部和东北部健康人群血清阳性率为0.65%,西北部的大沙鼠(Rhombomys opimus)血清阳性率为1.67%,东北部野鼠脏器Ot核酸阳性率为6.67%,甘肃省甘南地区迭部县人群血清学阳性率为1.42%[6],仅青海省未见相关报道。
1999-2008年,中国香港共报告恙虫病病例136例,年发病数为2~30例,2002年后有上升趋势[7],均为本地感染,无死亡病例,全年均有发病,高峰期在5-11月,与广东省流行季节一致。1970年中国台湾台东地区花莲县暴发恙虫病,此后每年均有报道。2003-2008年中国台湾共报告病例1 558例,发病率为1.15/10万,女性病例多于男性(1.43:0.85),病例分布于全台湾地区,东部和中部山区发病率较高,病例集中在花莲、台东和南投3个县,西南部的高雄市病例也较多[8]。金门、马祖和澎湖岛屿恙虫病的发病率也较高[9],发病季节以夏、秋季为主,冬季有少量病例[10]。台湾岛以地里纤恙螨(L. deliense)为主要传播媒介,金门和马祖夏季均以地里纤恙螨为主,冬季则分别以小板纤恙螨(L. scutellare)和苍白纤恙螨(L. pallidum)为主[11]。
我国已经证实恙虫病传播媒介为6种,另有10种可疑媒介待证实[4]。恙虫病在南方地区发病高峰期为6-10月,北方地区为10-11月,在华南地区全年均有发病[5]。
1.1.2 日本恙虫病在日本流行的历史较长,现代恙虫病研究始于日本。1860年记载该病流行于日本本州岛东北部,流行季节在4-5月,后证实传播媒介为红纤恙螨(L. akamushi)。二战后,在日本各地陆续发现恙虫病病例,1959-1969年病例减少直至消失,1976年后重新开始流行,1990年病例数达941例[12-13]。见图 2。
1998年日本调查发现,全年恙虫病发病462例,88%的病例经过血清学诊断,病例分布在除北海道和琉球群岛以外的日本全境;九州岛、本州岛的关中和东北地区3个地区发病数分别占总发病数的51%、27%和19%;本州东北部发病高峰为5月,在10-11月也有1个小高峰,其他地区发病均在10- 12月;男女性发病数各半,61~75岁年龄组发病数占总发病数的62%;在农业、林业和野外采集中感染的病例占64%;秋、冬季疫源地的传播媒介为小板纤恙螨和苍白纤恙螨[14]。1999年日本将恙虫病列为法定报告传染病,实验室诊断病例必须报告。1999-2006年共报告病例3 633例。2008年日本琉球群岛出现恙虫病病例[15]。
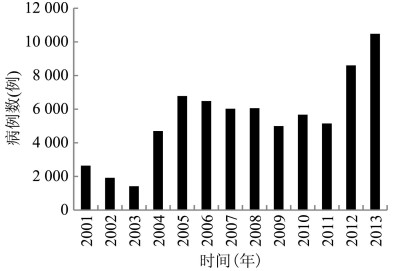
1.1.3 韩国在朝鲜战争期间,美国和英国军队报告恙虫病6例。1965- 1985年仅有个例报道,1986- 1993年韩国进行全国性的人群血清学调查,Ot抗体阳性率为27.7%~51.0%[16]。因此,恙虫病开始受重视,并在1994年被韩国疾病预防控制中心纳入法定报告传染病。20世纪90年代恙虫病病例数波动,每年约300例,2000年后病例数快速上升,2013年共报告10 485例,见图 3,发病率达20.9/10万。病例年龄以50~79岁为主,女性多于男性(62.84:37.16)。发病率较高的地区包括全罗北道、全罗南道、忠清南道、庆尚北道和庆尚南道,均位于半岛南部和西南部,发病高峰在10-11月,其他月份仅有少量病例[17]。小板纤恙螨主要分布在韩国南部的庆尚南道和济州岛,其他地区均以苍白纤恙螨为主,两种恙螨为韩国恙虫病的主要传播媒介[18]。
20世纪60年代,在俄罗斯滨海边疆区南部报道恙虫病病例40余例,并在野鼠和在巴氏纤恙螨(L. pavlovskyii)中分离到Ot。20世纪70年代勘察加半岛和千岛群岛也有报道。1994年秋季在滨海边疆区南部捕获的鼠血清经免疫荧光法(IFA)检测,阳性率为10.1%(14/139),抗体滴度最高为1:160,鼠和恙螨中均未分离出Ot。Ot血清阳性率和检出率较20世纪60年代低,并低于韩国和日本鼠的阳性率同期水平[19]。此后,俄罗斯无恙虫病发病相关报道。
1.2 东南亚地区东南亚地区恙虫病的发现历史可追溯到20世纪初,疫区几乎涵盖东南亚所有国家,但因各国地理环境、经济发展水平和重视程度不同,调查研究水平差异很大,文献不能反映所有国家的实际发病情况。
1.2.1 泰国1952年泰国中部地区报道恙虫病病例,主要传播媒介为地里纤恙螨,部分地区有清莱纤恙螨(L. chiangraiensisi)和英帕纤恙螨(L. chiangraiensis)等。恙虫病病例分布于全国,高发地区包括西北部泰缅边界和东南部泰老柬边界地区[20]。血清学调查发现,人群感染率非常高,如北部和东北部3个村庄感染率可达59%~77%。2009年泰国公共卫生部统计,1983年前每年病例≤100例,1988-1991年750~900例/年,2001年后达3 000~ 5 000例/年。全年均有恙虫病病例报告,以夏秋季为主[21]。
1.2.2 缅甸1930年前缅甸和印度阿萨姆地区有类似恙虫病病例,1944-1946年该地区的盟军病例493例[22]。近年来,泰缅边界泰国一侧为恙虫病高发地区,但缅甸无相关报道。
1.2.3 越南越南战争期间,通过IFA对南部的美国士兵和后勤人员中的发热患者进行筛查发现,109例血清抗体滴度>4倍升高,确诊为恙虫病,在越南的美国人发病率为50/10万[23]。2001-2003年对越南国家热带病医院的发热患者进行筛查发现,恙虫病临床诊断病例占全部入院病例的10.4%(749/7 226),酶联免疫吸附试验(ELISA)或恙虫病快速检测试剂盒阳性率为3.5%(251/7 226)。全年均有病例发生,5-9月为高发期[24]。对2001-2003年越南北部医院749例急性非特异性发热(排除疟疾、登革热和伤寒)患者进行血清学调查发现,Ot抗体阳性率为27.8%~73.3%[25]。对北部健康人群调查发现,血清学阳性率为1.1%(10/908)[26]。中部广南省(Quang Nam)3个医院67例病例来自广南省和周边地区的临床诊断病例,32例经定量PCR或IFA证实为Ot感染[27]。2000年后越南恙虫病报道集中在北部和中部地区,南部地区反而再无相关报道。
1.2.4 马来西亚1927年马来西亚有恙虫病病例报道。2013年西马来西亚原住民(主要生活在农村地区)恙虫病血清抗体阳性率为0%~36.4%,平均阳性率为17.9%(50/280)[28]。
1.2.5 老挝2010年老挝首都万象人群血清经ELISA检测IgG抗体阳性率为20.3%(349/2 002)。城区和周边分别为13.1%和28.4%,郊区阳性率较高[29]。对万象、北部琅南塔省(Luang Namtha)和沙湾拿吉省(Savannakhet)3个地区医院发热患者(排除疟疾)进行筛查发现,Ot阳性率分别为14.8%(63/ 427)、7%(122/1 871)和2.6%(6/229)[30-32]。
1.2.6 柬埔寨1938年柬埔寨报告恙虫病病例20例,所有患者均为在林区清理灌丛的男性,疾病发生在雨季暴雨引发洪水之后[33]。1997年在柬埔寨训练的印度尼西亚士兵Ot抗体阳性为8%[34]。2013年针对北部城市Angkor某医院儿童发热患者血清学进行调查(ELISA,IgM)发现,阳性率为8.4%(95/1 179)[35]。分子流行病学研究证实,金边恙虫病病原体存在5个基因型[36]。
1.2.7 印度尼西亚印度尼西亚恙虫病病例最早可追溯到1902年得利(Deli)和苏门答腊(Samudra)。二战时期,美国军队在西新几内亚感染恙虫病。1997年对东爪哇城市Malang居民进行调查发现,血清学阳性率为1.3%[37]。1997-2000年对巴布亚东北部发热患者进行ELISA检测发现,血清学阳性率为3.0%(7/236)[38]。总体而言,恙虫病病例报告少,感染率较低,主要传播媒介恙螨有地里纤恙螨和沙栖纤恙螨(L. arenicola)。
1.2.8 菲律宾1908年菲律宾即有恙虫病报道。1944-1945年驻菲律宾美国军队在莱特(Leyte)、萨马(Samar)、民都洛(Mindoro)、吕宋(Luzon)、内格罗斯(Negros)和棉兰老(Mindanao)等岛屿发生恙虫病,病死率达4.5%。上述岛屿除莱特岛外,媒介恙螨为地里纤恙螨,吕宋岛和内格罗斯岛发现有红纤恙螨,Vercammen-Grandjean和Langston[39]认为,红纤恙螨仅分布在日本东北部,东南亚的红纤恙螨应为绯红纤恙螨(L. fletcheri)[40]。1976年在吕宋岛中部捕获野鼠,IFA血清阳性率为84%,说明该地区动物仍存在Ot感染[41],但未见人间病例报道。
1.2.9 新加坡1957年报道新加坡岛东部樟宜(Changi)有恙虫病病例16例,在地里纤恙螨中检出Ot,疫源地属于山区[42]。
1.3 南亚、西亚和中亚 1.3.1 印度二战时期,在印度东北部的阿萨姆邦(Assam)和西孟加拉邦(West Bengal)地区军队中发生恙虫病流行,两次印巴战争期间印巴边境克什米尔地区(Kashmir)和查谟-锡亚尔科特(JammuSialkot)也有军人感染恙虫病报道[43-44]。1990年在西北部再次出现恙虫病病例。2003年后沿喜马拉雅山的喜马偕尔邦(Himachal)、锡金(Sikkim)、西孟加拉邦,以及德里(Delhi)、西部拉贾斯坦邦(Rajasthan)和南部等多个地区流行恙虫病[45-46]。印度南部韦洛尔市(Vellore)健康成年人恙虫病血清阳性率为15%[47]。2012年10-12月在拉贾斯坦邦首府一所医院170名疑似病例中,ELISA检测IgM阳性率为24.7%。恙虫病在印度发病数和面积均扩大,疫区已分布全国,相关报道较多,但尚无全印度恙虫病病例监测数据。已知地里纤恙螨为印度恙虫病传播媒介[48-49]。
1.3.2 尼泊尔尼泊尔1979年证实有恙虫病病例。2015年4月25日8.1级地震后,恙虫病发病率显著增高,8月中旬报告恙虫病病例91例,其中47例来自Chitwan地区,死亡3例,包括2名儿童[50]。Chang等[15]对2015年434例不明原因发热并伴其他疑似症状的患者进行ELISA血清学检测IgM抗体,阳性率40.3%。对部分病例进行real-time PCR和IFA检测得到部分阳性结果。阳性患者分布在尼泊尔的30个区,涵盖各种生境,主要发生在7-11月[51]。2016年6-9月对发热患者进行调查发现,IgM抗体阳性率为44.1%(181/440)[52]。综上所述,恙虫病在尼泊尔的流行季节以夏秋季为主,流行范围广泛且多被误诊和漏报。尼泊尔在地震后人群失去原有居所,与野外环境接触机会增加可能引起灾区恙虫病的流行,对我国灾后防病工作有借鉴意义。
1.3.3 马尔代夫二战期间,马尔代夫驻扎的英国士兵感染恙虫病达1 000余例,在当地鼠体发现地里纤恙螨。1945-2001年马尔代夫一直无恙虫病病例报告。2002年5月至2003年4月期间,马尔代夫卫生部公布恙虫病病例168例,死亡10例。病例分布在马尔代夫多数岛礁,以Gaafu Dhaahu环礁病例最为集中,其中的Gadhdhoo岛有57例,死亡3例[53]。
1.3.4 孟加拉国2008-2009年孟加拉国发热患者血清学调查显示,来自于全国6个行政地区的720例发热患者,分别利用ELISA和IFA进行检测,Ot阳性共170例[54]。2010年对6所医院患者血清学进行调查发现,ELISA检测IgM抗体阳性率为23.7%(287/1 209)[55]。这些调查说明孟加拉国全国范围内均有恙虫病。
1.3.5 斯里兰卡过去认为斯里兰卡恙虫病分布在岛屿西部湿润平原地区,如1976年在斯里兰卡首都科伦坡(Colombo)的医院患者血清抗体阳性率 < 6%[56],2008年西部地区的医院发热患者血清阳性率为66%[57]。但2003年对中部山区发热患者进行调查发现,IgM阳性率为13%(8/60)[58]。针对北方省筛查出64例临床病例,ELISA检测IgM阳性54例[59]。上述调查说明,疫区已覆盖斯里兰卡全岛,2004年前的20年,全国报告病例上升了13倍。2011年除北方省以外的8个省23家医院诊断为立克次体病患者中,Ot血清抗体阳性率为27%(168/ 615),主要分布在岛屿周边地区[60]。
1.3.6 不丹2008年不丹将恙虫病列入法定报告传染病,2010年开始有病例报告,由2010年的91例上升至2013年的351例[61]。2014年在不丹偏远地区学校发现41例恙虫病病例,死亡2例[62]。2015年对中南部8个地区健康人群血清流行病学进行调查发现,所调查地区均有恙虫病流行,平均血清阳性率为22.6%(195/864)[63]。
1.3.7 巴基斯坦1962年在巴基斯坦锡亚尔科特(Sialkot)地区的人、鼠和恙螨中分离出Ot;1967年在北部喜马拉雅Kaghan山谷、Gilgit山区沙漠、半沙漠Multan和位于平原的Lahore的鼠和恙螨也分离到Ot;这些地区靠近北部的喜马拉雅山或与印度临近;锡亚尔科特媒介为地里纤恙螨,而其他地区则未发现存在该恙螨[64]。
1.3.8 西亚和中亚1962年塔吉克斯坦有病例报告,1974年伊朗人群血清证实Ot感染,阿富汗曾有病例报告[4]。此后这些国家再无相关报告,恙虫病流行情况尚不清楚。
1.4 大洋洲 1.4.1 澳大利亚19世纪澳大利亚早期殖民者发现有类似恙虫病病例,1935年证实恙虫病的存在。二战时期,在昆士兰州(Queensland)北部训练的美国士兵有较多恙虫病病例[65]。此后疫源地的调查发现,疫源地分布在昆士兰东北距海岸64.4 km范围内的雨林地带,发病季节主要在3-7月的雨季。1991-1996年在北领地北部的Litchfield国家公园报告恙虫病病例8例,死亡1例。1993年西澳大利亚州北部Kimberley地区报告1例,1996年发现该地区人群Ot血清阳性率为2.6%(24/920)[66]。位于昆士兰和巴布亚新几内亚间的托雷斯海峡群岛(Torres Strait Islands)于1950年代发现恙虫病。2000-2001年托雷斯海峡群岛上再次出现10例恙虫病[67]。恙虫病为澳大利亚的法定报告传染病,自20世纪90年代再次开始流行,2004年出现较集中的暴发流行(图 4),疫区均为热带雨林地带,病例多发生在雨季,过去有报道这些地区存在地里纤恙螨[65]。
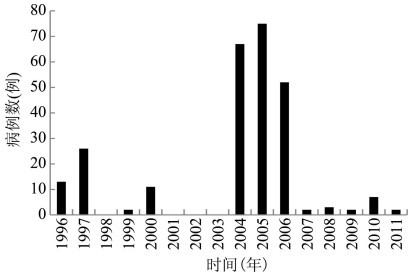
|
| 图 4 1996-2011年澳大利亚恙虫病报告病例数 Figure 4 Reported case numbers of scrub typhus in Australia, 1996-2011 |
| |
1930-1945年巴布亚新几内亚居民中发生恙虫病流行,二战时期美国军队发生809例,澳大利亚军队2 840例,病死率达9%。1997年首都莫尔斯比港(Port Moresby)健康人群血清Ot抗体阳性率为3.2%(3/93)[68]。2001年西部的Strickland河地区的血清学调查发现,9个村庄的健康人群和发热患者Ot血清阳性率为28%(39/140)[69]。
1.4.3 帕劳帕劳位于太平洋密克罗尼西亚群岛西部,2001-2003年西南部小岛屿首次发生恙虫病病例15例,其中14例发生在仅40人的小岛[70]。2003年健康人群血清IgG阳性率为47.6%(101 / 212),与西南岛屿有联系的居民阳性率更高。当地捕获鼠血清Ot抗体阳性率为28.6%(18/63)[71]。对1995年帕劳居民血清进行追溯性调查发现,血清IgG阳性率为5.6%(34/635),说明至少在20世纪90年代已有恙虫病流行[71]。
1.4.4 瓦努阿图瓦努阿图位于澳大利亚东北约2 000 km的太平洋上。1981年从北部Vanua Lava和Mota Lava两个岛屿的鼠和红纤恙螨(可能是绯红纤恙螨之误[39])分离到Ot,两个岛屿上也分布地里纤恙螨,但未分离到Ot。对同一地区人群进行检测发现,血清Ot抗体呈阳性[72]。
1.4.5 所罗门群岛1944年北所罗门群岛的美国军队有恙虫病病例45例。1971-1972年东所罗门群岛调查发现,居民血清阳性率为21%~82%,1975年报告恙虫病病例1例。2014年5-6月西所罗门省1所医院里证实恙虫病病例9例,时隔40年恙虫病再次开始流行[73]。
2 “恙虫病三角”以外地区近几年,在已知恙虫病分布区外的中东、非洲、南美洲和欧洲均发现人或动物感染恙虫病的证据。
2.1 中东2006年1名澳大利亚游客分别游览了阿联酋(迪拜)和英国,离开迪拜后出现发热等症状,且在腹部发现焦痂,判断患者在位于阿拉伯半岛的阿联酋感染。患者2次检测血清抗体(Gilliam型)滴度升高4倍,从患者血液中分离到1株恙虫病东方体,经过PCR对16S rRNA和47 kDa和56 kDa蛋白基因进行扩增、测序和序列分析,认为是东方体属新种,命名为中东东方体(O. chuto),此前东方体属仅Ot 1种[74]。
2.2 非洲 2.2.1 乌干达和卢旺达1951年部分乌干达-卢旺达地区的非洲人和印度裔居民Ot血清呈阳性[75]。这些人是否曾到过印度等疫区不详,此后30年非洲未有恙虫病相关报道。
2.2.2 尼日利亚1985年尼日利亚不明原因发热患者外斐反应OXK试验滴度较高,故推测可能存在恙虫病[76]。但外斐反应特异性低,存在与其他立克次体交叉免疫的可能,故该结论不可靠。
2.2.3 刚果(布)1989年1名日本人在刚果(布)旅行22 d,期间到过野外,返回日本6 d后出现发热、丘疹、焦痂等症状,血清间接免疫过氧化物酶试验诊断为恙虫病。报道者认为,患者回日本后在东京郊区上班,该地区无恙虫病发病病例,未到过其他可能感染的地点,故认为是在刚果(布)旅行期间感染[77]。但日本恙虫病疫区分布广泛,几乎分布全国,患者回国时间也长于最短潜伏期,故不能排除在日本感染的可能性[3]。
2.2.4 喀麦隆1997年1名美国人到达喀麦隆2周后出现溃疡和焦痂,3 d后出现发热、皮疹等症状,回美国后2次IFA检测血清Ot IgG升高4倍(1:256和1:1 024),皮肤病理标本(经过福尔马林固定和石蜡包埋)PCR检测Ot核酸为阴性。该病例临床表现与典型恙虫病有所不同,是否为恙虫病存在疑问[78]。
2.2.5 坦桑尼亚1999年1名从坦桑尼亚回国的荷兰游客因发热、皮疹和焦痂而就诊,在坦桑尼亚期间到过农村,经IFA检测抗Ot IgM和IgG抗体均升高,诊断为恙虫病[79]。
2.2.6 肯尼亚2015年肯尼亚6个地区医院急性发热患者的血清调查发现,血清Ot IgG抗体阳性率为5%(67/1 041),6个地区均有阳性,中部Marigat区的阳性率最高(12%),其次为靠近乌干达边界的Alupe区医院(6%)。调查者发现,接触山羊的病例阳性率较高,推测牧羊环境低矮灌丛适宜恙螨繁殖。该研究只检测急性期单份血清,故不能证实患者为恙虫病病例[80]。同年对肯尼亚某医院儿童发热病例进行血清学调查发现,单份血清IgG抗体阳性率为5.8%(21/364),双份血清抗体滴度上升>4倍的患儿占3.2%(9/281)[81]。上述两个研究Ot阳性样本均经过免疫印迹(Western blot)进一步确认,比较有力地证明了非洲人群存在Ot感染[80-81]。
2.2.7 吉布提2016年报道,自2010年开始每4周对吉布提屠宰场工人进行问卷调查,共20周,对有不明原因发热的工人采血,ELISA检测血清Ot IgG抗体阳性率为4%(2/49)。双份血清升高4倍的1例。利用IFA和重组47b和Kpr56蛋白抗原对上述ELISA阳性血清进行Western blot检测,结果证实,上述实验结果可靠。但阳性者的旅行史不清楚,尚无法确定是否在吉布提感染[82]。
2.2.8 塞内加尔2015年对在塞内加尔采集的354只鼠类脾脏进行PCR扩增Ot 16S rRNA基因,小家鼠(Mus musculus)阳性率为23.2%(48/207)[83]。序列分析发现,属于中东东方体。同一研究团队在塞内加尔的另一报道发现,小家鼠PCR阳性率为22.7%(46/ 203),Mastomys natalensis为2.2%(2/93)[84]。
2.2.9 南非2017年对南非东部的1只犬的血清进行PCR扩增发现,Ot 16S rRNA核酸阳性,序列与Kavasaki基因型相似[85]。
自20世纪50年代开始已在9个非洲国家发现恙虫病线索,包括病例和发热人群的血清学调查,肯尼亚儿童双份血清抗体升高的研究结果是非常有力的证据,塞内加尔和南非的动物体内发现Ot核酸则证明非洲动物存在恙虫病病原体感染。但这些研究均存在问题,如存在血清抗体与其他病原体交叉免疫的可能性,至今尚未从人或动物分离到病原体,也未在人群检测到核酸,人抗体阳性和动物核酸阳性间无时间和空间联系,至今未知通过何种途径传播。
2.3 南美洲 2.3.1 智利2011年智利报道,南部Chiloé岛1名疑似恙虫病病例,患者被蚂蝗叮咬后,腿部出现1个焦痂,伴发热。ELISA检测Ot IgG抗体滴度升高4倍以上(分别为 < 100和400),患处病理标本PCR扩增出16S rRNA基因片段,经比对发现,与中东东方体更接近[86]。2016年该岛又出现3例病例,经血清学和PCR核酸检测证实,尤其1例47 kDa和56 kDa片段均阳性,序列较接近Ot Kato型[87]。3例患者发病时间为南半球夏季,有野外活动史,但未被蚂蝗叮咬,未到过恙虫病流行区。
2.3.2 秘鲁2017年秘鲁亚马逊地区12个健康机构对发热患者监测发现,Ot IgG抗体阳性率为5.3%(60/1 124)(滴度≥400),1名士兵双份血清抗体滴度升高16倍,但47 kDa蛋白基因定量PCR检测呈阴性,该士兵2周内未到过其他地区[88]。
南美洲2个国家报道均有比较可靠的证据,但还需更大范围的人群调查研究。至今南美洲未发现纤恙螨属的恙螨种类,其传播媒介有待进一步研究。
2.4 欧洲2015年对来自法国的鼠类标本进行Ot 16S rRNA基因核酸进行检测,Myodes glareolus和Arvicola scherman两种鼠的阳性率分别14.6%(44/ 302)和3.1%(2/64),其他鼠种未发现阳性。序列与亚洲、中东和智利的序列属于不同基因型,为欧洲首次发现本地Ot感染[83]。
3 展望通过对全球恙虫病病例的数量、分布变化梳理可以看出,自1980年起多数国家发病数上升,多年未见病例报告的地区再次出现恙虫病病例(图 5)。恙虫病发病疫区扩大,如我国从长江以南扩大到长江以北广大地区,印度从北部扩散到南部,韩国、日本也自1980年发病数突然增加并覆盖全国。近10年来,恙虫病病例或动物感染相关报道开始出现在阿拉伯半岛、非洲、南美洲和欧洲,正从地区性疾病转变为全球性公共卫生问题。疫情上升可能因随着社会发展,诊断技术的普及提高了诊断率。但如此大幅度大范围的上升趋势可能还存在其他原因,如全球气候变化引起媒介和病原体分布的改变,从而影响恙虫病的分布和发病率。森林砍伐、环境破坏造成人与恙螨的接触机会增加,增加感染率。城市绿化增加,出现恙螨孳生地环境,是造成中国广州市和韩国首尔等地城市居民恙虫病发病上升的原因之一[89-90]。越来越多的城市居民开始到野外旅游,进行徒步探险等户外活动,也增加了接触恙螨和被叮咬的机会。全球化带来土地利用的改变,如中国台湾加入世界贸易组织后粮食价格下降,农村土地闲置,鼠类和恙螨数量增加,可能是恙虫病发病率上升的原因之一[91]。恙虫病再流行可能有多种原因,应深入开展疫情上升原因的相关研究,提出有针对性的控制策略和措施,控制疫情上升趋势。
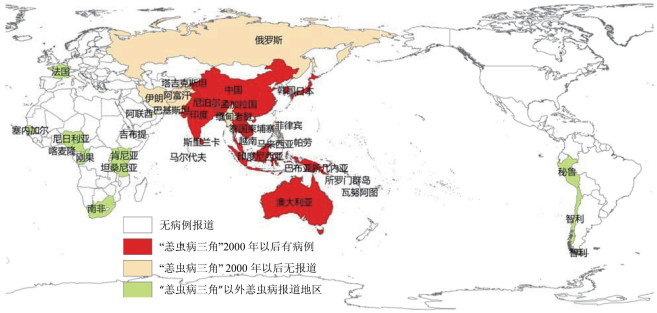
|
| 图 5 世界恙虫病分布 Figure 5 Geographical distribution of scrub typhus in the world |
| |
根据估计,Ot人群血清抗体阳性率为9.3%~ 27.9%(中位数22.2%,四分位数区间18.6%~ 25.7%),每10年人群发病率(中位数)4.6/10万[92]。据1997年世界卫生组织(WHO)估计,恙虫病威胁人口达10亿,全球每年发病至少100万[92]。该病流行区域为世界人口最稠密地区,仅“恙虫病三角”地区所覆盖人口约40亿,占世界人口一半以上。在该区域外的实际分布范围可能更广。恙虫病因感染Ot血清型别不同,病死率差异较大,未经治疗的病死率为0~70%(中位数6%),经治疗的病死率也达1.4%[1]。近年来,我国西南地区和印度发现儿童病例比例较高,且儿童病例易发生严重并发症[5, 93-94]。因此,恙虫病给流行地区的医疗部门和患者造成严重的经济负担。2016年我国恙虫病临床和实验室诊断病例数已超过9种法定报告病媒生物性传染病发病总数,为严重危害我国居民健康的重要传染病。1949年我国开始重视恙虫病的防治,1952年有恙虫病病例报告,1956年将其列入法定报告传染病。而1989年《传染病防治法》将恙虫病从法定报告传染病中剔除,导致1990-2005年恙虫病监测的空白和被忽视[4]。虽2006年中国CDC“疾病信息报告管理系统”已将恙虫病纳入其中,2009年发布的《恙虫病预防控制技术指南(试行)》要求恙虫病参照乙、丙类传染病报告,但因不属法定报告传染病,传染病疫情通报中不公布监测数据。公众和卫生行政部门、疾控、医疗机构不能接收相关信息,对其缺乏了解和重视,影响疾病的防控。WHO(WHO/ CDS/CSR/ISR/99.2)建议各国应建立恙虫病病例报告制度,日本、韩国、澳大利亚和不丹等国已将恙虫病列入法定报告传染病[15, 17, 61, 65]。因此,建议我国尽快重新将其列入法定报告传染病管理。
因恙虫病的免疫时间短、血清型多,尚无疫苗可预防。预防发病的关键是控制恙螨的数量,降低人被叮咬的概率。通过对疫区居民和到疫区去的旅游和工作者进行宣传教育,使其掌握预防恙螨叮咬知识,降低感染率。首先必须对疫区的恙螨进行详细调查,了解媒介恙螨种类、孳生习性和人接触的危险因素。近年来新发疫区缺乏相关资料,影响恙虫病的防控。恙虫病治疗的关键在早诊断以早期正确选择治疗药物。医生对恙虫病的认识和简便可靠的诊断技术对于控制恙虫病非常关键。应对疫区医生开展恙虫病诊治培训,科研机构研究、推广快速诊断技术,提高恙虫病的早期诊断率。
综上所述,通过提高各级机构的重视程度,加强疾病监测和管理,推动相关科学研究,对居民开展健康教育,提高基层医生的诊断能力,从而减少恙虫病发病数,阻断疫情上升趋势,减轻疾病负担,改善居民健康水平,实现“健康中国”的发展目标。
志谢: 复旦大学上海医学院温廷桓教授对本文提供帮助和部分资料,特此志谢作者贡献:
李贵昌 ORCID:0000-0002-6286-6366
李贵昌:负责查阅、整理文献和撰写论文
刘起勇:负责指导本文修改和审校
| [1] |
Taylor AJ, Paris DH, Newton PN. A systematic review of mortality from untreated scrub typhus(Orientia tsutsugamushi)[J]. PLoS Negl Trop Dis, 2015, 9(8): e0003971. DOI:10.1371/journal.pntd.0003971 |
| [2] |
Bavaro MF, Kelly DJ, Dasch GA, et al. History of U.S. military contributions to the study of rickettsial diseases[J]. Mil Med, 2005, 170(4 Suppl): 49-60. DOI:10.7205/MILMED.170.4S.49 |
| [3] |
Xu G, Walker DH, Jupiter D, et al. A review of the global epidemiology of scrub typhus[J]. PLoS Negl Trop Dis, 2017, 11(11): e0006062. DOI:10.1371/journal.pntd.0006062 |
| [4] |
陈香蕊. 恙虫病和恙虫病东方体[M]. 北京: 军事医学科学出版社, 2001: 1-21. Chen XR. Scrub typhus and Orientia tsutsugamushi[M]. Beijing: Military Medical Publishing House, 2001: 1-21. |
| [5] |
李贵昌, 栗冬梅, 李焱, 等. 2006-2016年我国恙虫病流行特征分析[J]. 疾病监测, 2018, 33(2): 139-143. Li GC, Li DM, Li Y, et al. Epidemiological features of scrub typhus in China from 2006 to 2016[J]. Dis Surveill, 2018, 33(2): 139-143. DOI:10.3784/j.issn.1003-9961.2018.02.006 |
| [6] |
龚建仁. 我国恙虫病的分布状况与研究概况[J]. 中华疾病控制杂志, 2016, 20(11): 1176-1181. Gong JR. The distribution and general situation on epidemiology studies of tsutsugamushi disease in China[J]. Chin J Dis Control Prev, 2016, 20(11): 1176-1181. DOI:10.16462/j.cnki.zhjbkz.2016.11.025 |
| [7] |
Ma SKE, Wong WC, Leung CWR, et al. Review of vector-borne diseases in Hong Kong[J]. Travel Med Infect Dis, 2011, 9(3): 95-105. DOI:10.1016/j.tmaid.2010.01.004 |
| [8] |
Kuo CC, Huang JL, Ko CY, et al. Spatial analysis of scrub typhus infection and its association with environmental and socioeconomic factors in Taiwan[J]. Acta Trop, 2011, 120(1/2): 52-58. DOI:10.1016/j.actatropica.2011.05.018 |
| [9] |
Lin PR, Tsai HP, Weng MH, et al. Field assessment of Orientia tsutsugamushi infection in small mammals and its association with the occurrence of human scrub typhus in Taiwan[J]. Acta Trop, 2014, 131: 117-123. DOI:10.1016/j.actatropica.2013.11.029 |
| [10] |
Jim WT, Chiu NC, Chan WT, et al. Clinical manifestations, laboratory findings and complications of pediatric scrub typhus in eastern Taiwan[J]. Pediatr Neonatol, 2009, 50(3): 96-101. DOI:10.1016/S1875-9572(09)60043-7 |
| [11] |
Kuo CC, Lee PL, Chen CH, et al. Surveillance of potential hosts and vectors of scrub typhus in Taiwan[J]. Parasit Vectors, 2015, 8: 611. DOI:10.1186/s13071-015-1221-7 |
| [12] |
Ebisawa I. Current epidemiology and treatment of Tsutsugamushi disease in Japan[J]. J Travel Med, 1995, 2(4): 218-220. DOI:10.1111/j.1708-8305.1995.tb00662.x |
| [13] |
Yoshikura H. Seasonality and geographical distribution of Tsutsugamushi diseases in Japan:analysis of the trends since 1955 till 2014[J]. Jpn J Infect Dis, 2017, 71(1): 1-7. DOI:10.7883/yoken.JJID.2017.073 |
| [14] |
Ogawa M, Hagiwara T, Kishimoto T, et al. Scrub typhus in Japan:epidemiology and clinical features of cases reported in 1998[J]. Am J Trop Med Hyg, 2002, 67(2): 162-165. DOI:10.4269/ajtmh.2002.67.162 |
| [15] |
Chang WH. Current status of tsutsugamushi disease in Korea[J]. J Korean Med Sci, 1995, 10(4): 227-238. DOI:10.3346/jkms.1995.10.4.227 |
| [16] |
Nakamura K, Shinzato T. Three cases of Tsutsugamushi disease in Miyakojima Island, Okinawa, Japan[J]. Kansenshogaku Zasshi, 2015, 89(2): 270-273. DOI:10.11150/kansenshogakuzasshi.89.270 |
| [17] |
Lee HW, Cho PY, Moon SU, et al. Current situation of scrub typhus in South Korea from 2001-2013[J]. Parasit Vectors, 2015, 8: 238. DOI:10.1186/s13071-015-0858-6 |
| [18] |
Lee IY, Kim HC, Lee YS, et al. Geographical distribution and relative abundance of vectors of scrub typhus in the Republic of Korea[J]. Korean J Parasitol, 2009, 47(4): 381-386. DOI:10.3347/kjp.2009.47.4.381 |
| [19] |
Urakami H, Tamura A, Tarasevich IV, et al. Decreased prevalence of Orientia tsutsugamushi in trombiculid mites and wild rodents in the Primorye region, Far East Russia[J]. Microbiol Immunol, 1999, 43(10): 975-978. DOI:10.1111/j.1348-0421.1999.tb03358.x |
| [20] |
Lerdthusnee K, Nigro J, Monkanna T, et al. Surveys of rodentborne disease in Thailand with a focus on scrub typhus assessment[J]. Integr Zool, 2008, 3(4): 267-273. DOI:10.1111/j.1749-4877.2008.00100.x |
| [21] |
Suputtamongkol Y, Suttinont C, Niwatayakul K, et al. Epidemiology and clinical aspects of rickettsioses in Thailand[J]. Ann N Y Acad Sci, 2009, 1166: 172-179. DOI:10.1111/j.1749-6632.2009.04514.x |
| [22] |
Willcox PHA. Mite typhus fever in Assam and Burma, 1944-1946[J]. Trans R Soc Trop Med Hyg, 1948, 42(2): 171-189. DOI:10.1016/0035-9203(48)90022-4 |
| [23] |
Berman SJ, Kundin WD. Scrub typhus in South Vietnam. A study of 87 cases[J]. Ann Intern Med, 1973, 79(1): 26-30. DOI:10.7326/0003-4819-79-1-26 |
| [24] |
Nadjm B, Thuy PT, Trang VD, et al. Scrub typhus in the northern provinces of Vietnam:an observational study of admissions to a national referral hospital[J]. Trans R Soc Trop Med Hyg, 2014, 108(11): 739-740. DOI:10.1093/trstmh/tru145 |
| [25] |
Hamaguchi S, Cuong NC, Tra DT, et al. Clinical and epidemiological characteristics of scrub typhus and murine typhus among hospitalized patients with acute undifferentiated fever in northern Vietnam[J]. Am J Trop Med Hyg, 2015, 92(5): 972-978. DOI:10.4269/ajtmh.14-0806 |
| [26] |
Trung NV, Hoi LT, Thuong NTH, et al. Seroprevalence of scrub typhus, typhus, and spotted fever among rural and urban populations of northern Vietnam[J]. Am J Trop Med Hyg, 2017, 96(5): 1084-1087. DOI:10.4269/ajtmh.16-0399 |
| [27] |
Le Viet N, Laroche M, Thi Pham HL, et al. Use of eschar swabbing for the molecular diagnosis and genotyping of Orientia tsutsugamushi causing scrub typhus in Quang Nam province, Vietnam[J]. PLoS Negl Trop Dis, 2017, 11(2): e0005397. DOI:10.1371/journal.pntd.0005397 |
| [28] |
Tay ST, Zan HAM, Lim YA, et al. Antibody prevalence and factors associated with exposure to Orientia tsutsugamushi in different aboriginal subgroups in West Malaysia[J]. PLoS Negl Trop Dis, 2013, 7(8): e2341. DOI:10.1371/journal.pntd.0002341 |
| [29] |
Vallée J, Thaojaikong T, Moore CE, et al. Contrasting spatial distribution and risk factors for past infection with scrub typhus and murine typhus in Vientiane City, Lao PDR[J]. PLoS Negl Trop Dis, 2010, 4(12): e909. DOI:10.1371/journal.pntd.0000909 |
| [30] |
Phongmany S, Rolain JM, Phetsouvanh R, et al. Rickettsial infections and fever, Vientiane, Laos[J]. Emerg Infect Dis, 2006, 12(2): 256-262. DOI:10.3201/eid1202.050900 |
| [31] |
Mayxay M, Castonguay-Vanier J, Chansamouth V, et al. Causes of non-malarial fever in Laos:a prospective study[J]. Lancet Glob Health, 2013, 1(1): e46-54. DOI:10.1016/S2214-109X(13)70008-1 |
| [32] |
Mayxay M, Sengvilaipaseuth O, Chanthongthip A, et al. Causes of fever in rural southern Laos[J]. Am J Trop Med Hyg, 2015, 93(3): 517-520. DOI:10.4269/ajtmh.14-0772 |
| [33] |
Delbove P, Canet J. A small epidemic of tropical typhus.(Scrub Typhus) in a group of plantations in Cambodia[J]. Bull Soc Pathol Exot, 1983, 31(6): 457. |
| [34] |
Corwin AL, Soeprapto W, Widodo PS, et al. Short report:surveillance of rickettsial infections in Indonesian military personnel during peace keeping operations in Cambodia[J]. Am J Trop Med Hyg, 1997, 57(5): 569-570. DOI:10.4269/ajtmh.1997.57.569 |
| [35] |
Chheng K, Carter MJ, Emary K, et al. A prospective study of the causes of febrile illness requiring hospitalization in children in Cambodia[J]. PLoS One, 2013, 8(4): e60634. DOI:10.1371/journal.pone.0060634 |
| [36] |
Duong V, Mai TT, Blasdell K, et al. Molecular epidemiology of Orientia tsutsugamushi in Cambodia and Central Vietnam reveals a broad region-wide genetic diversity[J]. Infect Genet Evol, 2013, 15: 35-42. DOI:10.1016/j.meegid.2011.01.004 |
| [37] |
Richards AL, Soeatmadji DW, Widodo MA, et al. Seroepidemiologic evidence for murine and scrub typhus in Malang, Indonesia[J]. Am J Trop Med Hyg, 1997, 57(1): 91-95. DOI:10.4269/ajtmh.1997.57.91 |
| [38] |
Punjabi NH, Taylor WR, Murphy GS, et al. Etiology of acute, non-malaria, febrile illnesses in Jayapura, northeastern Papua, Indonesia[J]. Am J Trop Med Hyg, 2012, 86(1): 46-51. DOI:10.4269/ajtmh.2012.10-0497 |
| [39] |
Vercammen-Grandjean PH, Langston R. The chigger mites of the world, Volume Ⅲ. Leptotrombidum complex section A[M]. California: Central Reproduction Services, UCSF, 1976: 301.
|
| [40] |
Philip CB, Woodward TE, Sullivan RR. Tsutsugamushi disease (scrub or mite-borne typhus) in the Philippine Islands during American re-occupation in 1944-45[J]. Am J Trop Med Hyg, 1946, 26: 229-242. |
| [41] |
Van Peenen PF, Ho CM, Bourgeois AL. Indirect immunofluorescence antibodies in natural and acquired Rickettsia tsutsugamushi infections of Philippine rodents[J]. Infect Immun, 1977, 15(3): 813-816. |
| [42] |
Lawley BJ. The discovery, investigation and control of scrub typhus in Singapore[J]. Trans R Soc Trop Med Hyg, 1957, 51(1): 56-61. DOI:10.1016/0035-9203(57)90007-X |
| [43] |
Sinha P, Gupta S, Dawra R, et al. Recent outbreak of scrub typhus in North Western part of India[J]. Indian J Med Microbiol, 2014, 32(3): 247-250. DOI:10.4103/0255-0857.136552 |
| [44] |
Singh P. Scrub typhus, a case report:military and regional significance[J]. Med J Armed Forces India, 2004, 60(1): 89-90. DOI:10.1016/S0377-1237(04)80174-6 |
| [45] |
Chauhan M, Mahajan S, Manish S, et al. Scrub typhus:An emerging scourge[J]. Ind J Bas Appl Med Res, 2015, 4(4): 394-401. |
| [46] |
Khan SA, Dutta P, Khan AM, et al. Re-emergence of scrub typhus in northeast India[J]. Int J Infect Dis, 2012, 16(12): e889-890. DOI:10.1016/j.ijid.2012.05.1030 |
| [47] |
Sengupta M, Anandan S, Daniel D, et al. Scrub typhus seroprevalence in healthy Indian population[J]. J Clin Diagn Res, 2015, 9(10): DM01-DM02. DOI:10.7860/JCDR/2015/14708.6623 |
| [48] |
Kumar K, Saxena VK, Thomas TG, et al. Outbreak investigation of scrub Typhus in Himachal Pradesh (India)[J]. J Commun Dis, 2004, 36(4): 277-283. |
| [49] |
Candasamy S, Ayyanar E, Paily K, et al. Abundance & distribution of trombiculid mites & Orientia tsutsugamushi, the vectors & pathogen of scrub typhus in rodents & shrews collected from Puducherry & Tamil Nadu, India[J]. Indian J Med Res, 2016, 144(6): 893-900. DOI:10.4103/ijmr.IJMR_1390_15 |
| [50] |
Poudel A. Three dead, 91 infected with scrub typhus so far[EB/ OL]. [2016-08-17](2017-12-01). http://www.myrepublica.com/news/3945/.
|
| [51] |
Upadhyaya BP, Shakya G, Adhikari S, et al. Scrub typhus:an emerging neglected tropical disease in nepal[J]. J Nepal Health Res Counc, 2016, 14(33): 122-127. |
| [52] |
Thapa S, Sapkota LB, Hamal P. Threat of scrub typhus in postearthquake Nepal[J]. J Chitwan Med College, 2016, 6(18): 1-6. DOI:10.3126/jcmc.v6i4.16707 |
| [53] |
Lewis MD, Yousuf AA, Lerdthusnee K, et al. Scrub typhus reemergence in the Maldives[J]. Emerg Infect Dis, 2003, 9(12): 1638-1641. DOI:10.3201/eid0912.030212 |
| [54] |
Faruque LI, Zaman RU, Gurley ES, et al. Prevalence and clinical presentation of Rickettsia, Coxiella, Leptospira, Bartonella and Chikungunya virus infections among hospital -based febrile patients from December 2008 to November 2009 in Bangladesh[J]. BMC Infect Dis, 2017, 17(1): 141. DOI:10.1186/s12879-017-2239-6 |
| [55] |
Maude RR, Maude RJ, Ghose A, et al. Serosurveillance of Orientia tsutsugamushi and Rickettsia typhi in Bangladesh[J]. Am J Trop Med Hyg, 2014, 91(3): 580-583. DOI:10.4269/ajtmh.13-0570 |
| [56] |
Van Peenen PF, See R, Soysa PE, et al. Seroepidemiological survey of hospital-associated populations in Colombo, Sri Lanka[J]. Southeast Asian J Trop Med Public Health, 1976(1): 16-20. |
| [57] |
Premaratna R, Loftis AD, Chandrasena TGAN, et al. Rickettsial infections and their clinical presentations in the Western Province of Sri Lanka:a hospital-based study[J]. Int J Infect Dis, 2008, 12(2): 198-202. DOI:10.1016/j.ijid.2007.06.009 |
| [58] |
Kularatne SAM, Edirisingha JS, Gawarammana IB, et al. Emerging rickettsial infections in Sri Lanka:the pattern in the hilly Central Province[J]. Trop Med Int Health, 2003, 8(9): 803-811. DOI:10.1046/j.1365-3156.2003.01108.x |
| [59] |
Pradeepan JA, Ketheesan N, Murugananthan K. Emerging scrub typhus infection in the northern region of Sri Lanka[J]. BMC Res Notes, 2014, 7: 719. DOI:10.1186/1756-0500-7-719 |
| [60] |
Liyanapathirana VC, Veranja C, Thevanesam V. Seroepidemiology of rickettsioses in Sri Lanka:a patient based study[J]. BMC Infect Dis, 2011, 11: 328. DOI:10.1186/1471-2334-11-328 |
| [61] |
Tshokey T, Choden T, Sharma R. Scrub typhus in Bhutan:a synthesis of data from 2009 to 2014[J]. WHO South East Asia J Public Health, 2016, 5(2): 117-122. DOI:10.4103/2224-3151.206248 |
| [62] |
Tshokey T, Graves S, Tshering D, et al. Scrub typhus outbreak in a remote primary school, Bhutan, 2014[J]. Emerg Infect Dis, 2017, 23(8): 1412-1414. DOI:10.3201/eid2308.162021 |
| [63] |
Tshokey T, Stenos J, Durrheim DN, et al. Seroprevalence of rickettsial infections and Q fever in Bhutan[J]. PLoS Negl Trop Dis, 2017, 11(11): e0006107. DOI:10.1371/journal.pntd.0006107 |
| [64] |
Traub R, Wisseman CL Jr, Ahmad N. The occurrence of scrub typhus infection in unusual habitats in West Pakistan[J]. Trans R Soc Trop Med Hyg, 1967, 61(1): 23-53. DOI:10.1016/0035-9203(67)90052-1 |
| [65] |
Derne B, Weinstein P, Musso D, et al. Distribution of rickettsioses in Oceania:past patterns and implications for the future[J]. Acta Trop, 2015, 143: 121-133. DOI:10.1016/j.actatropica.2014.10.012 |
| [66] |
Graves S, Wang L, Nack Z, et al. Rickettsia serosurvey in Kimberley, Western Australia[J]. Am J Trop Med Hyg, 1999, 60(5): 786-789. DOI:10.4269/ajtmh.1999.60.786 |
| [67] |
Faa AG, McBride WJH, Garstone G, et al. Scrub typhus in the Torres Strait islands of north Queensland, Australia[J]. Emerg Infect Dis, 2003, 9(4): 480-482. DOI:10.3201/eid0904.020509 |
| [68] |
Kende M, Graves S. Survey of rickettsial antibodies at two local sites and review of rickettsiosis in Papua New Guinea[J]. P N G Med J, 2003, 46(1/2): 53-62. |
| [69] |
Spicer PE, Taufa T, Benjamin AL. Scrub typhus (Orientia tsutsugamushi), spotted fever(Rickettsia australis)and dengue fever as possible causes of mysterious deaths in the Strickland Gorge area of Southern Highlands and West Sepik Provinces of Papua New Guinea[J]. P N G Med J, 2007, 50(3/4): 172-183. |
| [70] |
Durand AM, Kuartei S, Togamae I, et al. Scrub typhus in the Republic of Palau, Micronesia[J]. Emerg Infect Dis, 2004, 10(10): 1838-1840. DOI:10.3201/eid1010.040288 |
| [71] |
Demma LJ, McQuiston JH, Nicholson WL, et al. Scrub typhus, Republic of Palau[J]. Emerg Infect Dis, 2006, 12(2): 290-295. DOI:10.3201/eid1202.050967 |
| [72] |
Miles JA, Austin FJ, Jennings LC. Scrub typhus in the Eastern Solomon islands and Northern Vanuatu(New Hebrides)[J]. Am J Trop Med Hyg, 1981, 30(4): 849-854. DOI:10.4269/ajtmh.1981.30.849 |
| [73] |
Marks M, Joshua C, Longbottom J, et al. An outbreak investigation of scrub typhus in Western Province, Solomon islands, 2014[J]. Western Pac Surveill Response J, 2016, 7(1): 6-9. DOI:10.5365/WPSAR.2015.6.3.007 |
| [74] |
Izzard L, Fuller A, Blacksell SD, et al. Isolation of a novel Orientia species(O. chuto sp. nov. ) from a patient infected in Dubai[J]. J Clin Microbiol, 2010, 48(12): 4404-4409. DOI: 10.1128/JCM.01526-10(.InFremch)
|
| [75] |
Giroud P. The rickettsioses in equatorial Africa[J]. Bull World Health Organ, 1951, 4(4): 535-546. |
| [76] |
Emejuaiwe SO, Njoku-Obi AN. Serological evidence for the presence of rickettsial infections in parts of Nigeria[J]. Niger Med J, 1978, 8(6): 514-517. |
| [77] |
Osuga K, Kimura M, Goto H, et al. A case of Tsutsugamushi disease probably contracted in Africa[J]. Eur J Clin Microbiol Infect Dis, 1991, 10(2): 95-96. DOI:10.1007/BF01964418 |
| [78] |
Ghorbani RP, Ghorbani AJ, Jain MK, et al. A case of scrub typhus probably acquired in Africa[J]. Clin Infect Dis, 1997, 25(6): 1473-1474. DOI:10.1086/516990 |
| [79] |
Groen J, Nur YA, Dolmans W, et al. Scrub and murine typhus among Dutch travellers[J]. Infection, 1999, 27(4/5): 291-292. |
| [80] |
Thiga JW, Mutai BK, Eyako WK, et al. High seroprevalence of antibodies against spotted fever and scrub typhus bacteria in patients with febrile Illness, Kenya[J]. Emerg Infect Dis, 2015, 21(4): 688-691. DOI:10.3201/eid2104.141387 |
| [81] |
Maina AN, Farris CM, Odhiambo A, et al. Q fever, scrub typhus, and rickettsial diseases in children, Kenya, 2011-2012[J]. Emerg Infect Dis, 2016, 22(5): 883-886. DOI:10.3201/eid2205.150953 |
| [82] |
Horton KC, Jiang J, Maina A, et al. Evidence of Rickettsia and Orientia infections among abattoir workers in Djibouti[J]. Am J Trop Med Hyg, 2016, 95(2): 462-465. DOI:10.4269/ajtmh.15-0775 |
| [83] |
Cosson JF, Galan M, Bard E, et al. Detection of Orientia sp. DNA in rodents from Asia, West Africa and Europe[J]. Parasit Vectors, 2015, 8: 172. DOI:10.1186/s13071-015-0784-7 |
| [84] |
Galan M, Razzauti M, Bard E, et al. 16S rRNA Amplicon sequencing for epidemiological surveys of bacteria in wildlife[J]. mSystems, 2016, 1(4): e00032-16. DOI:10.1128/mSystems.00032-16 |
| [85] |
Kolo AO, Sibeko-Matjila KP, Maina AN, et al. Molecular detection of zoonotic rickettsiae and Anaplasma spp. in domestic dogs and their ectoparasites in bushbuckridge, South Africa[J]. Vector Borne Zoonotic Dis, 2016, 16(4): 245-252. DOI:10.1089/vbz.2015.1849 |
| [86] |
Balcells ME, Rabagliati R, García P, et al. Endemic scrub typhus-like illness, Chile[J]. Emerg Infect Dis, 2011, 17(9): 1659-1663. DOI:10.3201/eid1709.100960 |
| [87] |
Weitzel T, Dittrich S, López J, et al. Endemic scrub typhus in South America[J]. N Engl J Med, 2016, 375(10): 954-961. DOI:10.1056/NEJMoa1603657 |
| [88] |
Kocher C, Jiang J, Morrison AC, et al. Serologic evidence of scrub typhus in the Peruvian amazon[J]. Emerg Infect Dis, 2017, 23(8): 1389-1391. DOI:10.3201/eid2308.170050 |
| [89] |
Wei YH, Luo L, Jing QL, et al. A city park as a potential epidemic site of scrub typhus:a case-control study of an outbreak in Guangzhou, China[J]. Parasit Vectors, 2014, 7: 513. DOI:10.1186/s13071-014-0513-7 |
| [90] |
Park SW, Ha NY, Ryu B, et al. Urbanization of scrub typhus disease in South Korea[J]. PLoS Negl Trop Dis, 2015, 9(5): e0003814. DOI:10.1371/journal.pntd.0003814 |
| [91] |
Kuo CC, Huang JL, Shu PY, et al. Cascading effect of economic globalization on human risks of scrub typhus and tick-borne rickettsial diseases[J]. Ecol Appl, 2012, 22(6): 1803-1816. DOI:10.1890/12-0031.1 |
| [92] |
Bonell A, Lubell Y, Newton PN, et al. Estimating the burden of scrub typhus:A systematic review[J]. PLoS Negl Trop Dis, 2017, 11(9): e0005838. DOI:10.1371/journal.pntd.0005838 |
| [93] |
Krishnan R, Pillai RK, Elizabeth KE, et al. Pediatric scrub typhus in Southern Kerala:an emerging public health problem[J]. Clinical Epidemiology and Global Health, 2016, 4(2): 89-94. DOI:10.1016/j.cegh.2016.03.003 |
| [94] |
Varghese G, Janardhanan J, Abraham O, et al. Scrub typhus in India:predictors of severity and outcome[J]. Int J Infect Dis, 2012, 16(Suppl 1): e243. DOI:10.1016/j.ijid.2012.05.868 |
 2018, Vol. 33
2018, Vol. 33