扩展功能
文章信息
- 刘小波, 吴海霞, 郭玉红, 任东升, 李贵昌, 鲁亮, 刘起勇
- Liu Xiaobo, Wu Haixia, Guo Yuhong, Ren Dongsheng, Li Guichang, Lu Liang, Liu Qiyong
- 2016年中国媒介伊蚊密度监测结果分析
- Surveillance on the density of Aedes mosquitoes in China, 2016
- 疾病监测, 2018, 33(2): 144-149
- Disease Surveillance, 2018, 33(2): 144-149
- 10.3784/j.issn.1003-9961.2018.02.008
-
文章历史
- 收稿日期:2017-12-10
媒介伊蚊在我国分布范围广,可传播登革热、基孔肯雅热、寨卡病毒病和黄热病等蚊媒传染病。随着全球化、城镇化和气候变化等自然和社会因素的影响,媒介伊蚊及其所传疾病对我国人群健康威胁日益增加[1-5]。为应对媒介伊蚊及其传播疾病的威胁,中国疾病预防控制中心(CDC)于2014年颁布了《登革热防治技术指南》[中疾控传防发(2014)360号],该指南中的《媒介伊蚊监测指南》以及2016年修订印发的《全国病媒生物监测方案》[国卫办疾控函(2016)215号],是指导我国当前媒介伊蚊监测及风险评估工作的核心技术方案。我国已在媒介伊蚊分布的23个省(自治区、直辖市)按照上述技术方案要求开展了媒介伊蚊监测工作。本研究对上述监测省份媒介伊蚊监测资料进行分析,为登革热等媒介伊蚊传播疾病可持续精准防治提供科学依据。
1 资料与方法 1.1 数据来源媒介伊蚊监测资料来源于我国登革热中转支付项目媒介伊蚊监测数据库以及《全国病媒生物监测方案》涉及的监测省份的媒介伊蚊监测资料。
1.2 监测点根据《关于印发登革热防治技术指南的通知》中《媒介伊蚊监测指南》,Ⅰ类省份包括广东、云南、广西、海南、福建和浙江6个省份;Ⅱ类省份包括上海、重庆、江苏、安徽、江西、河南、湖北、湖南、四川、贵州10个省份;Ⅲ类省份包括北京、河北、山西、天津、山东、陕西和辽宁7个省份。在上述23个登革热中转支付项目省份开展媒介伊蚊监测。
1.3 监测方法及频次《媒介伊蚊监测指南》中幼蚊监测采用布雷图指数(BI)法和诱蚊诱卵器指数(MOI)法,各监测点根据当地情况至少选择一种。Ⅰ类省份登革热高风险区域的蚊虫活动季节,每月2次,间隔10~15 d;Ⅱ类省份5-10月,每月1次;Ⅲ类省份6-9月,每月1次。按照上述方案,部分省份开展了成蚊双层叠帐法监测。此外,《全国病媒生物监测方案》中成蚊密度监测主要采用诱蚊灯法,密度指标为蚊密度(只/灯·次),即布灯一次所捕获的蚊虫数量。
1.4 相关定义及计算依据上述相关监测方案,相关指标的定义如下:
(1)户的定义:每个家庭、集体宿舍/单位办公室/酒店的2个房间、农贸市场/花房/外环境/室内公共场所等每30 m2定义为一户。
(2)密度指标计算公式:
|
(3)风险评估标准:BI和MOI<5为控制登革热传播的阈值,>5有传播风险,>10有暴发风险,>20有区域流行风险。
1.5 统计学分析应用SPSS 18.0软件对监测数据进行分析。采用Pearson相关分析对幼蚊及成蚊密度以及不同幼蚊密度的相关性进行分析,相关系数以r表示,以双侧P<0.05表示差异有统计学意义。
2 结果 2.1 一般情况2016年全国21个省份3 305个市、县(区)开展了媒介伊蚊BI监测,其中,Ⅰ类省份监测市、县(区)数2 241个,Ⅱ类省份960个,Ⅲ类省份104个。同年,全国7省630个市、县(区)开展媒介伊蚊幼蚊MOI监测。其中,Ⅰ类省份监测市、县(区)数467个,Ⅱ类省份131个,Ⅲ类省份32个。此外,Ⅰ类省份广西、Ⅱ类省份重庆和湖北还开展了媒介伊蚊成蚊双层叠帐法监测资料。
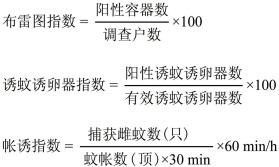
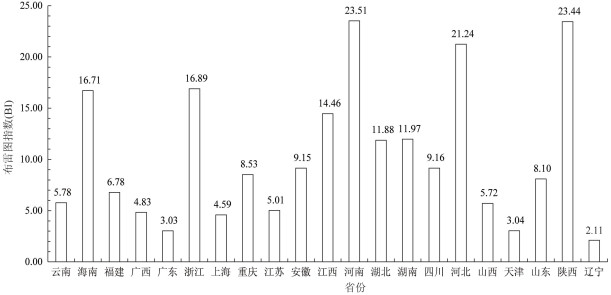
2.2 媒介伊蚊幼蚊密度 2.2.1 总密度2016年,全国开展BI监测市、县(区)3 305个,累计监测BI 3 778 206户,伊蚊幼蚊阳性容器及水体143 595个,平均BI为3.80。全国开展MOI监测市、县(区)630个,累计有效诱蚊诱卵器330 332个,阳性诱蚊诱卵器20 231个,平均MOI为6.12。各省媒介伊蚊BI和MOI监测结果见图 1、2。
|
| 图 1 2016年我国各省份媒介伊蚊幼蚊布雷图指数监测结果 Figure 1 BI of Aedes surveillance provinces in China in 2016 |
| |
|
| 图 2 2016年全国各省份媒介伊蚊诱蚊诱卵器指数监测结果 Figure 2 MOI of Aedes surveillance provinces in China in 2016 |
| |
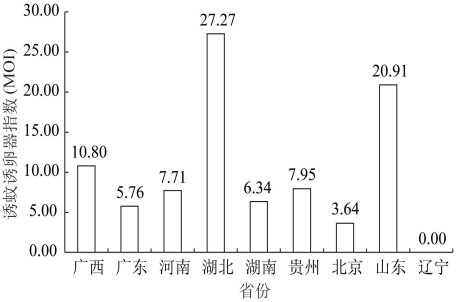
(1)BI:海南省全年BI均高于10,处于登革热暴发风险(10≤BI < 20),且6月下半月,9月上半月和10月下半月BI均超过20,达到登革热区域流行风险(BI≥20)。浙江省5月上半月至10月下半月BI均高于10,处于登革热暴发风险,其中,7月上半月,8月上半月达到区域流行风险(BI≥20)。福建省BI 6- 10月相对较高,均达到暴发风险(10≤BI < 20)。云南省自6月至9月上半月,BI均达到传播风险(5≤BI < 10)。广西BI总体处于较低水平,介于1.95~7.84之间,其中,3月下半月,4月上半月,5月下半月,6-8月,处于登革热传播风险(5≤BI < 10)。虽然广东省BI总体处于较低水平,但21个监测地市中的19个监测期内曾达到登革热传播风险,见图 3。
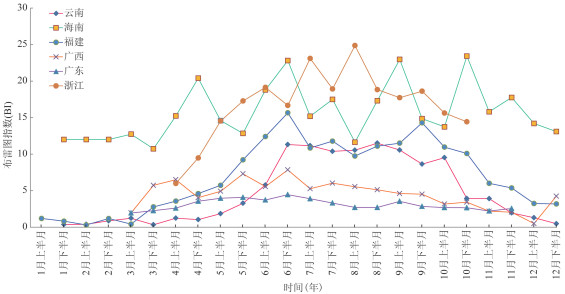
|
| 图 3 2016年Ⅰ类省份媒介伊蚊幼蚊布雷图指数季节消长 Figure 3 Seasonal fluctuation of BI in category I provinces in 2016 |
| |
(2)MOI:Ⅰ类省份仅广西和广东省开展了MOI法监测。其中,广东省5月上半月至9月下半月平均MOI均超过5,达到登革热传播风险;以所辖地市来看,21个监测地市中有20个MOI曾达到登革热传播风险。广西大多数月份MOI高于广东省同期水平,仅9月上半月及10月下半月后低于广东省同期MOI。
(3)代表性重点省份BI与MOI相关性:相关分析发现,自4月上半月至11月下半月,广西BI与同期MOI呈正相关(r=0.883,P<0.01),广东省BI与同期MOI呈正相关(r=0.746,P<0.01)。
2.2.3 Ⅱ类省份(1)BI:重庆市、江西省、河南省、湖北省、湖南省5-10月平均BI均达到登革热传播风险;安徽省和四川省自6月开始,BI均达到传播风险;上海市和江苏省仅7-8月BI达到传播风险,见表 1。
| 省份 | 5月 | 6月 | 7月 | 8月 | 9月 | 10月 |
| 上海 | 2.62 | 4.95 | 6.18 | 5.49 | 4.66 | 3.23 |
| 重庆 | 6.25 | 11.10 | 10.34 | 9.80 | 7.73 | 5.95 |
| 江苏 | 2.40 | 4.86 | 5.99 | 7.13 | 4.78 | 3.99 |
| 安徽 | 3.82 | 9.06 | 14.60 | 11.96 | 9.57 | 5.70 |
| 江西 | 14.10 | 23.60 | 12.48 | 12.67 | 8.76 | 15.33 |
| 河南 | 10.10 | 21.39 | 31.88 | 32.40 | 32.07 | 14.41 |
| 湖北 | 10.90 | 13.42 | 19.83 | 13.76 | 8.64 | 7.22 |
| 湖南 | 17.90 | 17.90 | 9.65 | 10.95 | 10.95 | 3.44 |
| 四川 | 4.90 | 7.60 | 8.33 | 13.36 | 7.56 | 8.98 |
(2)MOI:贵州省仅开展了MOI监测,河南省、湖南省开展BI监测的同时也开展了MOI监测。贵州省5-10月、湖南省6-9月、湖北省6月和10月、河南省6月及8-9月MOI均超过5,达到登革热传播风险,见表 2。
| 省份 | 诱蚊诱卵器指数 | |||||
| 5月 | 6月 | 7月 | 8月 | 9月 | 10月 | |
| 河南 | 2.59 | 7.28 | 1.80 | 25.77 | 15.91 | 0.00 |
| 湖南 | 3.12 | 9.83 | 8.89 | 6.49 | 6.49 | 0.00 |
| 贵州 | 5.29 | 7.81 | 8.87 | 11.03 | 9.05 | 5.74 |
| 湖北 | - | 38.89 | - | - | - | 13.3 |
| “-”表示未开展监测 | ||||||
(1)BI:陕西省6-8月、河北省8-9月BI均达到登革热区域流行风险;河北省7月、山东省8月以及陕西省9月BI均达到登革热暴发风险;山西省7-9月平均BI均达到登革热传播风险。值得注意的是,天津市、辽宁省监测期内月均BI未达到传播风险,见表 3。
| 省份 | 布雷图指数 | |||
| 6月 | 7月 | 8月 | 9月 | |
| 河北 | 8.75 | 11.00 | 40.72 | 24.50 |
| 山西 | 1.04 | 6.34 | 8.27 | 5.87 |
| 天津 | 2.00 | 3.80 | 3.19 | 3.19 |
| 山东 | 2.82 | 2.31 | 18.74 | 8.60 |
| 陕西 | 23.20 | 20.69 | 36.20 | 13.18 |
| 辽宁 | 0.58 | 2.26 | 3.08 | 2.50 |
(2)MOI:山东省6-9月MOI均超过10,达到登革热区域流行风险,北京市仅9月MOI达到登革热传播风险(MOI=5.87),辽宁省MOI尚未达到登革热传播阈值。
2.3 媒介伊蚊成蚊密度 2.3.1 双层叠帐法Ⅰ类省份广西壮族自治区,Ⅱ类省份重庆市、湖北省开展了媒介伊蚊成蚊双层叠帐法监测。其中,广西5月上半月至8月下半月及10月下半月帐诱指数超过2只/顶·h,重庆市5-10月及湖北省5-9月媒介伊蚊成蚊密度超过2只/顶·h。Pearson相关分析显示,广西自4月上半月至11月下半月媒介伊蚊帐诱指数与同期BI(r=0.576,P<0.05)和MOI(r=0.822,P<0.01)均呈正相关。5-10月重庆市和湖北省媒介伊蚊帐诱指数与同期BI均不相关(P>0.05)。
2.3.2 诱蚊灯法2016年全国各监测点共布放16 696灯次,捕获蚊种总数为277 892只,平均总密度为16.64只/灯·次,白纹伊蚊(Aedes albopictus)密度为0.30只/灯·次。蚊种构成中,淡色库蚊(Culex pipiens pallens)和致倦库蚊(Cx. quinquefasciatus)占44.96%、三带喙库蚊(Cx. tritaeniorhynchus)占32.30%、中华按蚊(Anopheles sinensis)占9.60%,本研究关注的白纹伊蚊仅占2.09%。白纹伊蚊季节消长呈现平缓的上升和下降趋势,其高峰值处于7-8月,9月开始略有下降,到12月达到年度最低,见表 4。
| 省份 | 1月 | 2月 | 3月 | 4月 | 5月 | 6月 | 7月 | 8月 | 9月 | 10月 | 11月 | 12月 |
| 北京 | - | - | - | 0 | 0.01 | 0.04 | 0.15 | 0.57 | 0.16 | 0.04 | - | - |
| 福建 | - | - | - | - | - | - | 0.71 | 0.21 | 0.18 | 0.24 | 0.04 | 0.01 |
| 甘肃 | - | - | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | - |
| 广东 | 0.00 | 0.00 | 0.15 | 0.86 | 0.90 | 1.12 | 0.95 | 1.12 | 0.99 | 0.32 | 0.42 | 0.08 |
| 广西 | - | - | 0.00 | 0.00 | 0.35 | 0.30 | 0.60 | 0.68 | 1.90 | 0.60 | 0.10 | - |
| 海南 | 0.00 | 0.05 | 0.08 | 0.05 | 0.08 | 0.00 | 0.13 | 0.08 | 1.14 | 0.65 | 0.10 | 0.00 |
| 河南 | - | - | - | - | 0.27 | 0.00 | 0.51 | 0.10 | 0.29 | - | - | - |
| 湖北 | - | - | 0.00 | 0.08 | 0.40 | 1.08 | 1.41 | 0.55 | 0.63 | 0.14 | 0.03 | - |
| 湖南 | - | - | - | - | - | - | 0.49 | 0.84 | 0.48 | 0.17 | 0.03 | - |
| 江苏 | 0.00 | 0.00 | 0.00 | 0.02 | 0.18 | 0.33 | 0.51 | 0.62 | 0.37 | 0.17 | 0.00 | 0.00 |
| 辽宁 | - | - | - | - | 0.00 | 0.08 | 0.00 | 0.00 | 0.00 | 0.00 | - | - |
| 山东 | - | - | 0.00 | 0.00 | 0.00 | 0.02 | 1.56 | 1.04 | 0.74 | 0.44 | 0.00 | - |
| 山西 | - | - | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | - |
| 陕西 | - | - | - | - | - | - | - | 0.18 | 0.00 | 0.00 | - | - |
| 上海 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 2.30 | 0.00 | 0.00 | 0.00 | - |
| 四川 | - | - | - | 0.38 | 0.98 | 1.28 | 3.32 | 5.39 | 0.44 | 0.29 | 0.31 | - |
| 天津 | - | - | - | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | - |
| 浙江 | - | - | - | - | 0.08 | 0.35 | 0.81 | 0.31 | 0.59 | 1.17 | - | - |
| 合计 | 0.00 | 0.02 | 0.03 | 0.12 | 0.08 | 0.14 | 0.66 | 0.39 | 0.25 | 0.15 | 0.07 | 0.02 |
| “-”表示该月份未开展监测;白纹伊蚊密度为只/灯·次 | ||||||||||||
本研究发现,2016年全国23个省媒介伊蚊幼蚊平均BI为3.80,幼蚊密度整体处于较低水平。据文献报道,媒介伊蚊幼蚊密度高低与监测时气候因子、生态环境、血源动物数量、孳生地面积、各地媒介伊蚊控制力度、媒介伊蚊传播疾病暴发、监测方法敏感性等因素相关[6-9]。根据中国气象局(http://www.cma.gov.cn)发布的信息,2016年我国年平均气温为10.5 ℃,同2015年平均气温10.6 ℃基本持平;2016年全国降水量(729.7 mm)略高于2015年同期水平(648.4 mm)。2016年我国出现登革热输入及本地暴发、输入性黄热病、寨卡病毒病和裂谷热等媒介伊蚊传播疾病,因此,2016年媒介伊蚊BI低于2015年可能与各地加大了媒介伊蚊的控制力度导致媒介伊蚊幼蚊密度较低有关[10-11]。本研究显示,2016年监测省份媒介伊蚊平均MOI略高于2015年水平。然而,由于2年开展MOI监测的省份数量较少,因此可能对监测结果产生一定影响,尚待进一步研究证实。
不同省份监测发现,海南、浙江和福建监测期内BI大部分超过10,参照《媒介伊蚊监测指南》,该水平处于登革热流行风险。2016年度,广西BI总体较低(1.95~7.84),同年也未出现暴发疫情,说明实际工作中通过BI进行风险评估相对准确。研究发现,虽然我国云南和广东的总体BI水平较上述3个省份低,但绝大多数监测市、县(区)监测期内媒介伊蚊密度超过登革热传播阈值,也能在一定程度上解释近年来2省登革热频繁暴发[12-13]。Ⅰ类省份中仅广东和广西开展了诱蚊诱卵器法监测,MOI趋势与BI正相关。除9月上半月外,广西同期MOI均较广东高,可能与2016年广西未出现登革热暴发,媒介伊蚊幼蚊密度相对较高有关。
重庆、江西、河南、湖北和湖南等我国中部省份,5-10月平均BI均超过5。贵州监测期内MOI均超过5,河南和湖南MOI与BI基本保持一致。鉴于河南7-9月BI均超过20,加之该省人口多、流动大,一旦出现登革热等媒介伊蚊传播疾病的输入病例,存在暴发流行的可能性。陕西、河北、山东和山西等省份,部分月份BI超过5;北京9月MOI超过5,山东监测期内MOI超过10。建议,应重视上述省份特别是北京和山东等地媒介伊蚊监测控制工作,以防止登革热等媒介伊蚊传播疾病暴发及扩散蔓延对首都等核心区域构成的威胁。
2016年仅收集到广西、重庆和湖北三地媒介伊蚊成蚊帐诱指数,绝大多数月份超过2只/顶·h,且广西媒介伊蚊BI、MOI和帐诱指数存在正相关。诱蚊灯法监测显示,白纹伊蚊成蚊总平均密度仅为0.30只/灯·次。以往研究证实,白纹伊蚊是白天活动的蚊虫,而诱蚊灯法是当前《全国病媒生物监测方案》要求的成蚊监测工具,主要监测时段是夜间,而该时段白纹伊蚊活动少且密度低,为本研究诱蚊灯法白纹伊蚊密度较低的主要原因。因此,今后媒介成蚊监测亟待研发或采取新的工具以便于更好地服务于媒介伊蚊传播疾病的风险评估、预测预警、控制规划、精准实施和效果评价等工作。
因我国埃及伊蚊分布相对局限及资料的可获得性,本研究未进一步区分埃及伊蚊和白纹伊蚊的幼蚊和成蚊密度,后续研究可进一步细化研究。此外,虽然2016年广东和广西BI总体未达到传播阈值(BI<5),但MOI超过传播风险,说明BI和MOI法监测结果存在部分差别,给疫情判断造成影响。据监测省份反映,MOI在城市监测效果好,特别适合像广东、广西植被分布多,成蚊密度相对较高的省份。随着经济发展,人口流动引起的一系列问题将随之出现,居民自我防护意识不断提高,入户查孳生地的工作难度逐年增加,对BI监测构成不利的影响,可能从部分程度上解释上述两种方法在现场密度监测中存在结果不一致现象。提示,应研究更为敏感和可操作性的方法及指标,便于各地更为客观地开展监测,为媒介伊蚊风险评估和可持续精准控制奠定坚实基础[14-15]。
志谢: 本研究得到监测省各级卫生计划生育委员会及疾病预防控制机构的大力支持,谨志感谢!作者贡献:
刘小波 ORCID:0000-0002-0420-2529
刘小波:监测数据整理分析和文章撰写
吴海霞、郭玉红、任东升、李贵昌、鲁亮:研究设计、数据分析、图表绘制、文章修改
刘起勇:研究设计和文章修改
| [1] |
Lessler J, Chaisson LH, Kucirka LM, et al. Assessing the global threat from Zika virus[J]. Science, 2016, 353(6300): aaf8160. DOI:10.1126/science.aaf8160 |
| [2] |
Bai L, Morton LC, Liu QY. Climate change and mosquito-borne diseases in China:a review[J]. Global Health, 2013, 9: 10. DOI:10.1186/1744-8603-9-10 |
| [3] |
Mayer SV, Tesh RB, Vasilakis N. The emergence of arthropod-borne viral diseases:A global prospective on dengue, chikungunya and Zika fevers[J]. Acta Trop, 2016, 166: 155-163. DOI:10.1016/j.actatropica.2016.11.020 |
| [4] |
Weaver SC, Lecuit M. Chikungunya virus and the global spread of a mosquito-borne disease[J]. New Engl J Med, 2015, 372(13): 1231-1239. DOI:10.1056/NEJMra1406035 |
| [5] |
Xu L, Stige LC, Chan KS, et al. Climate variation drives dengue dynamics[J]. Proc Natl Acad Sci USA, 2017, 114(1): 113-118. DOI:10.1073/pnas.1618558114 |
| [6] |
Xiang JJ, Hansen A, Liu QY, et al. Association between dengue fever incidence and meteorological factors in Guangzhou, China, 2005-2014[J]. Environ Res, 2017, 153: 17-26. DOI:10.1016/j.envres.2016.11.009 |
| [7] |
Gu HG, Leung RKK, Jing QL, et al. Meteorological Factors for Dengue Fever Control and Prevention in South China[J]. Int J Environ Res Public Health, 2016, 13(9): 867. DOI:10.3390/ijerph13090867 |
| [8] |
Tian HY, Huang SQ, Zhou S, et al. Surface water areas significantly impacted 2014 dengue outbreaks in Guangzhou, China[J]. Environ Res, 2016, 150: 299-305. DOI:10.1016/j.envres.2016.05.039 |
| [9] |
Guo YH, Lai SJ, Liu XB, et al. Governmental supervision and rapid detection on dengue vectors:An important role for dengue control in China[J]. Acta Trop, 2016, 156: 17-21. DOI:10.1016/j.actatropica.2015.12.011 |
| [10] |
Liu T, Zhu GH, He JF, et al. Early rigorous control interventions can largely reduce dengue outbreak magnitude:experience from Chaozhou, China[J]. BMC Public Health, 2017, 18(1): 90. DOI:10.1186/s12889-017-4616-x |
| [11] |
Shen JC, Luo L, Li L, et al. The impacts of mosquito density and meteorological factors on dengue fever epidemics in Guangzhou, China, 2006-2014:a Time-series Analysis[J]. Biomed Environ Sci, 2015, 28(5): 321-329. DOI:10.3967/bes2015.046 |
| [12] |
Sun JM, Lu L, Wu HX, et al. Epidemiological trends of dengue in mainland China, 2005-2015[J]. Int J Infect Dis, 2017, 57: 86-91. DOI:10.1016/j.ijid.2017.02.007 |
| [13] |
Luo L, Jiang LY, Xiao XC, et al. The dengue preface to endemic in mainland China:the historical largest outbreak by Aedes albopictus in Guangzhou, 2014[J]. Infect Dis Poverty, 2017, 6: 148. DOI:10.1186/s40249-017-0352-9 |
| [14] |
刘小波, 吴海霞, 鲁亮. 对话刘起勇:媒介伊蚊可持续控制是预防寨卡病毒病的杀手锏[J]. 科学通报, 2016, 61(21): 2323-2325. Liu XB, Wu HX, Lu L. Dialogue on Liu Qiyong:sustainalble Aedes management is the trump card to the prevention of Zika[J]. Chin Sci Bull, 2016, 61(21): 2323-2325. DOI:10.1360/N972016-00734 |
| [15] |
刘起勇. 媒介生物控制面临的挑战与媒介生物可持续控制策略[J]. 中华流行病学杂志, 2012, 33(1): 1-8. Liu QY. The challenge to vector control and sustainable vector management strategy[J]. Chin J Epidemiol, 2012, 33(1): 1-8. DOI:10.3760/cma.j.issn.0254-6450.2012.01.001 |
 2018, Vol. 33
2018, Vol. 33


