扩展功能
文章信息
- 石伟先, 董梅, 龚成, 李茂中, 张铁钢, 李爱华, 罗明, 刘医萌, 赵佳琛, 黄芳
- Shi Weixian, Dong Mei, Gong Cheng, Li Maozhong, Zhang Tiegang, Li Aihua, Luo Ming, Liu Yimeng, Zhao Jiachen, Huang Fang
- 2015-2016年北京市急性呼吸道感染病例肺炎支原体流行特征分析
- Analysis of Mycoplasma pneumoniae infection in acute respiratory infection cases in Beijing, 2015-2016
- 疾病监测, 2018, 33(4): 306-311
- Disease Surveillance, 2018, 33(4): 306-311
- 10.3784/j.issn.1003-9961.2018.04.011
-
文章历史
- 收稿日期:2017-11-23
2. 首都医科大学公共卫生学院, 北京 100069
2. School of Public Health, Capital Medical University, Beijing 100069, China
肺炎支原体(Mycoplasma pneumoniae,MP)是引起人类呼吸道感染的重要致病原,人群普遍易感,且易导致聚集性流行[1]。研究发现,肺炎支原体每3~7年呈周期性暴发流行规律[1]。根据P1基因对肺炎支原体进行基因分型可了解其周期性暴发流行的分子机制[2]。本研究通过采集北京市哨点医院急性呼吸道感染病例的咽拭子、痰、鼻咽抽吸物等样本,对肺炎支原体及基因型进行筛查检测,了解其感染现况和流行特征,为其防控提供科学依据。
1 材料与方法 1.1 病例定义临床诊断为急性呼吸道感染病例,包括临床表现为发热(腋下体温≥38 ℃),伴咳嗽或咽痛、鼻塞、流涕、咳痰等的急性上呼吸道感染病例及参照中华医学会呼吸病学分会制定的《中国成人社区获得性肺炎诊断和治疗指南(2016版)》的诊断标准,临床表现为具有急性感染表现(发热或寒战或白细胞分布异常)并具有影像学支持的肺炎诊断或伴呼吸道疾病表现(咳嗽、咳痰或气促、气短、呼吸困难或胸闷、胸痛或听诊呼吸音异常)所诊断的肺炎病例。
1.2 标本来源北京市各区选取1~2家哨点医院(共28家),监测诊室包括发热门诊、儿科门诊、急诊、呼吸内科病房、儿科病房、重症监护病房(ICU)等,各医院每月采集5例急性上呼吸道感染病例咽拭子标本,5~15例肺炎病例的下呼吸道标本,如深咳痰、气管抽吸物等。2015年5月至2016年5月于北京市某社区每月采集无呼吸道症状的 < 14岁儿童及> 18岁成年人的咽拭子标本各10份,作为健康对照。2015年1月至2016年12月共监测病例13 904例,采集急性上呼吸道感染病例咽拭子样本共5 100份,肺炎病例样本8 804份;采集健康儿童和成年人咽拭子样本各120份。样本均在4 ℃条件下于6 h内送至实验室,-80 ℃保存,每月集中检测1次。
1.3 核酸提取使用Thermo Fisher Scientific公司产KingFisher Flex磁珠纯化仪及Thermal Fisher Labserv-Viral试剂盒提取标本核酸,按试剂盒说明书操作。
1.4 荧光PCR检测引物与探针序列参照已报道文献[2],25 μl检测体系包括:0.25 μl Platinum Taq DNA polymerase(Invitrogen C10966 -034),12.5 μl Platinum quantitative PCR SuperMix-UDG(Invitrogen C11730-025),1.5 μl MgCl2(50 mmol/L),0.5 μl正向引物RepMP-F(25 μmol/L),0.5 μl反向引物RepMPR(25 μmol / L),0.2 μl探针RepMP-P(25 μmol / L),1.5 μl PCR nucleotide mix(Promega C1141),5 μl提取的DNA模板,用Nuclease-free water(Promega P1193)补至25 μl。使用ABI公司产7500 Real-time PCR仪进行扩增。扩增条件为:95 ℃ 2 min;95 ℃ 15 s,57 ℃ 30 s(采集荧光),40个循环。
1.5 肺炎支原体基因分型的双重实时荧光PCR检测使用MP阳性样本核酸进一步检测其基因型别,引物与探针序列参照文献[3],25 μl检测体系包括0.25 μl Platinum Taq DNA polymerase(Invitrogen C10966 - 034),12.5 μl Platinum quantitative PCR SuperMix - UDG(Invitrogen C11730 - 025),1.5 μl MgCl(2 50 mmol/L),0.5 μl正向引物MP1-F及MP2-F(均为25 μmol/L),0.5 μl反向引物MP1-R及MP2-R(均为25 μmol/L),0.2 μl探针MP1-P及MP2-P(均为25 μmol / L),1.5 μl PCR nucleotide mix(Promega C1141),5 μl DNA模板,用Nuclease -free water(Promega P1193)补至25 μl。使用ABI公司产7500 Real-time PCR仪进行扩增。扩增条件:95 ℃ 2 min;95 ℃ 15 s,56 ℃ 30 s(采集荧光),45个循环。
1.6 其他呼吸道病毒核酸检测使用江苏和创生物科技有限公司的呼吸道病毒核酸多重实时荧光PCR检测试剂盒,检测副流感病毒(human parainfluenza virus,HPIV)、腺病毒(adenovirus,ADV)、偏肺病毒(metapneumovirus,MPV)、冠状病毒(human coronavirus,HCOV)、流感病毒(influenza virus,FLU)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、鼻病毒(human rhinovirus,HRV)、肠道病毒(human enterovirus,HEV)、博卡病毒(human bocavirus,HBOV)9种其他常见呼吸道病毒,反应条件见文献[4]。
1.7 统计学分析采用SPSS 19.0软件建立数据库并进行相应的统计学分析。阳性率的比较采用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 检测情况240份健康对照人群中均未检出肺炎支原体。13 904份病例样本中肺炎支原体阳性率为4.69%(652/13 904);其中P1-Ⅰ型、P1-Ⅱ型和未分型阳性样本分别为238、230和184份;经χ2检验,P1 - Ⅰ型与P1 - Ⅱ型阳性率差异无统计学意义(χ2=0.139,P=0.709)。
对病例样本同时检测ADV、MPV、HCOV、FLU、RSV、HRV、HEV、HBOV、HPIV其他9种常见呼吸道病毒,阳性率分别为1.95%(271 / 13 904)、1.72%(239/13 904)、1.91%(265/13 904)、10.07%(1 400/ 13 904)、2.48%(345/13 904)、4.09%(569/13 904)、3.45%(479 / 13 904)、0.79%(110 / 13 904)和4.62%(642/13 904)。
49份肺炎支原体阳性样本中同时检测到其他呼吸道病毒,占阳性样本的7.52%(49/652),其中44份同时检出1种其他病毒,5份同时检出≥2种其他病毒,主要混合感染分别为肺炎支原体与RSV(11份)、HEV(9份)、HRV(7份)、HPIV(7份)。
2.2 病例性别分布男性患者样本中肺炎支原体阳性率为4.35%(342/7 866),其中P1-Ⅰ型、P1-Ⅱ型和未分型阳性率分别为1.70%(134/7 866)、1.40%(110/7 866)和1.25%(98/7 866);女性患者样本阳性率为5.13%(310/6 038),P1-Ⅰ型、P1-Ⅱ型和和未分型阳性率分别为1.72%(104/6 038)、1.99%(120/ 6 038)、1.42%(86/6 038),男女性阳性率差异有统计学意义(χ2=4.726,P=0.030)。
2.3 肺炎支原体病例年龄分布6~15岁年龄组病例肺炎支原体阳性率最高,达10.23%(150/1 466),60~岁最低,为1.43%(62/4 346);经χ2检验,各年龄组阳性率差异有统计学意义(χ2=347.600,P=0.001),见表 1。P1-Ⅰ型在各年龄组阳性率差异有统计学意义(χ2=215.2,P=0.001);而P1-Ⅱ型在16~、26~岁年龄组的阳性率高于其他年龄组,差异有统计学意义(χ2=31.257、106.400,均P=0.001)。P1-Ⅰ型在0~、6~岁年龄组中阳性率较P1-Ⅱ型高,差异有统计学意义(χ2=4.486、53.620,P=0.034、0.000),而P1-Ⅱ型在26~岁年龄组中较P1-Ⅰ型高,差异有统计学意义(χ2=18.289,P=0.001)。
| 年龄组(岁) | 检测数(份) | P1-Ⅰ型 | P1-Ⅱ型 | 未分型 | 总计 | |||||||
| 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | |||||
| 0~ | 3 166 | 29 | 0.92 | 15 | 0.47 | 23 | 0.73 | 67 | 2.12 | |||
| 6~ | 1 466 | 94 | 6.41 | 18 | 1.23 | 38 | 2.59 | 150 | 10.23 | |||
| 16~ | 990 | 26 | 2.63 | 38 | 3.84 | 25 | 2.53 | 88 | 8.89 | |||
| 26~ | 3 936 | 74 | 1.88 | 135 | 3.43 | 76 | 1.93 | 285 | 7.24 | |||
| 60~ | 4 346 | 15 | 0.35 | 24 | 0.55 | 23 | 0.53 | 62 | 1.43 | |||
| 合计 | 13 904 | 238 | 1.71 | 230 | 1.65 | 184 | 1.32 | 652 | 4.69 | |||
分别对2015-2016年中不同年份的肺炎支原体检测情况进行统计,结果见表 2;2015与2016年阳性率差异有统计学意义(χ2=8.889,P=0.003);不同基因型肺炎支原体在不同年份中的阳性率差异无统计学意义(χ2=2.041、0.090,P=0.153、0.764)。
| 年份 | 检测数(份) | P1-Ⅰ型 | P1-Ⅱ型 | 未分型 | 总计 | |||||||
| 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | |||||
| 2015 | 6 420 | 99 | 1.54 | 86 | 1.34 | 79 | 1.23 | 264 | 4.11 | |||
| 2016 | 7 484 | 139 | 1.86 | 144 | 1.92 | 105 | 1.4 | 388 | 5.18 | |||
| 合计 | 13 904 | 238 | 1.71 | 230 | 1.65 | 184 | 1.32 | 652 | 4.69 | |||
其中10-12月阳性率为9.06%(346/3 819),与其他月份比较差异有统计学意义(χ2=225.000,P=0.001)。2015和2016年阳性率均在1-7月持续较低,自8月开始逐渐升高,10-12月达到高峰后逐渐下降。1-9月P1-Ⅰ型阳性率高于P1-Ⅱ型,差异有统计学意义(χ2=21.231,P=0.001);10 - 12月P1-Ⅱ型阳性率则高于P1-Ⅰ型,差异有统计学意义(χ2=13.103,P=0.001),见图 1。
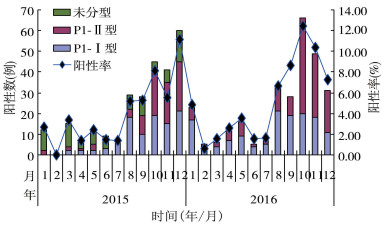
|
| 图 1 2015-2016年北京市急性呼吸道感染病例中肺炎支原体时间分布 Figure 1 Time distribution of M. pneumoniae detection in acute respiratory infection cases in Beijing, 2015 - 2016 |
| |
肺炎病例中肺炎支原体阳性率为6.45%,高于急性上呼吸道感染病例(1.65%),差异有统计学意义(χ2=166.800,P=0.001),肺炎支原体与其他病毒混合感染阳性率为0.49%,高于急性上呼吸道感染病例(0.12%),差异有统计学意义(χ2=12.641,P=0.001);不同临床诊断病例中,P1-Ⅰ和P1-Ⅱ型肺炎支原体阳性率差异无统计学意义(χ2=1.731、0.703,P=0.188、0.402),见表 3。
| 临床表现 | 检测数(份) | 阳性数(份) | 阳性率(%) | 与其他病毒混合感染 | P1-Ⅰ型 | P1-Ⅱ型 | 未分型 | |||||||
| 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率(%) | 阳性数(份) | 阳性率 | |||||||
| 急性上呼吸道感染 | 5 100 | 84 | 1.65 | 6 | 0.12 | 19 | 0.37 | 28 | 0.55 | 37 | 0.73 | |||
| 肺炎 | 8 804 | 568 | 6.45 | 43 | 0.49 | 219 | 2.49 | 202 | 2.29 | 147 | 1.67 | |||
| 合计 | 13 904 | 652 | 4.69 | 49 | 0.35 | 238 | 1.71 | 230 | 1.65 | 184 | 1.32 | |||
肺炎支原体是导致呼吸道感染的重要病原体,以往研究对象多为肺炎病例,对上呼吸道感染病例中肺炎支原体的感染状况研究报道较少。本研究通过对2015-2016年北京市哨点医院急性上呼吸道病例及肺炎病例中的肺炎支原体感染开展监测,结果显示,排除混合感染其他呼吸道病毒的肺炎支原体阳性样本的混杂因素,肺炎支原体感染更易导致肺炎,在急性上呼吸道感染病例中的阳性率为1.53%(78/5 100),在临床诊治中应引起关注。肺炎病例中肺炎支原体阳性样本易混合感染其他呼吸道病毒,但混合感染病例中的致病菌仍需深入研究。本研究针对健康人群进行肺炎支原体监测,未发现肺炎支原体健康携带者。
肺炎支原体在肺炎病例中的感染情况与国家、地区、年份、季节和人群有关[1],儿童肺炎病例感染率约50%[5]。目前,对儿童以外的其他年龄组人群中肺炎支原体感染状况报道较少,同时关于肺炎和急性上呼吸道感染病例的肺炎支原体感染状况报道也较少。北京地区社区获得性肺炎病例中,15~ 24岁和5~14岁年龄组肺炎支原体感染率相同(24.36%)[6]。广州地区呼吸道感染患者中,5~ 20岁年龄组为肺炎支原体感染高发人群[7]。本研究结果与既往报道相似,6~15岁年龄组肺炎支原体阳性率最高,远高于0~5岁幼儿组,表明北京地区6~15岁中小学生为肺炎支原体感染高发人群。
肺炎支原体全年散发,我国北方秋末和冬初为发病高峰季节,每3~7年出现1次流行高峰[1]。本研究结果显示,北京市肺炎支原体在1-7月呈低水平流行状态,自8月开始逐渐升高,10-12月达到高峰后逐渐下降。对北京市2011-2015年社区获得性肺炎患者调查发现,2013年7-12月肺炎支原体阳性率明显高于其他年份[6]。本研究结果显示,2016年急性呼吸道感染病例肺炎支原体阳性检出率高于2015年,北京市肺炎支原体流行是否为每3年出现1个流行高峰仍待大量监测数据支持。本研究急性呼吸道感染病例中,女性感染率高于男性,与相关报道一致[7-8],但因其机制尚无研究支持,仍需大量监测数据和研究结果支持。
P1基因是肺炎支原体分型最常用的靶基因,根据P1基因序列将肺炎支原体分为P1-Ⅰ和P1-Ⅱ型2种基因型[2]。本研究中有部分样本无法分出型别,分析其原因,可能是首先对样本中的肺炎支原体初筛使用的引物探针靶点为P1基因上的重复序列,其最低检出限为1.9 CFU/ml [2],而分型检测所使用的双重实时荧光PCR法,引物、探针检测靶点为P1-Ⅰ和P1-Ⅱ型特异性靶点(P1-Ⅰ型的mpn459基因和P1-Ⅱ型的mpna5846基因),其最低检出限为3 CFU/ml [3],检测灵敏度较检测多拷贝靶点方法低,则样本中肺炎支原体含量较低样本分型失败;其次分型检测所使用的核酸为初筛检测后冻存样本,冻融过程会造成一定的核酸降解,进而影响低载量样本的分型检测,提示我们应在初筛检测后及时进行分型检测,以降低标本核酸冻融产生的影响。
不同地区、年份流行的肺炎支原体基因型不同,不同型别肺炎支原体交替流行。2009年浙江省[9]、西安市[10]、2010年11月至2011年5月天津市[11]、2009-2011年上海市[12]、2010-2012年北京地区[13]的肺炎支原体感染儿童中均以PI-Ⅰ型为主,P1-Ⅱ型占0%~7.3%[11-13],而2013-2015年北京市肺炎支原体住院患儿P1-Ⅱ型占比升为11.0%[14]。2015年梅州地区肺炎支原体感染患儿中P1-Ⅱ型占比为14.88%[15]。北京市社区获得性肺炎患者中,2011- 2013年P1-Ⅱ型占比为28.57%,而2014- 2015年占比升至62.5%[6],表明自2014年以来我国P1-Ⅱ型缓慢增长。Sasaki等[16]对日本神奈川县肺炎支原体进行分型,结果显示,1979-1980年全部样本为P1 - Ⅱ型,自1983年开始出现P1 - Ⅱ型向P1-Ⅰ转变趋势,1985-1991年以P1-Ⅰ型为优势菌株,随后几年又逐渐向PI-Ⅱ型转变。1962-1986年丹麦肺炎支原体菌株均为P1-Ⅰ型,1987-1988年丹麦、法国均为P1-Ⅱ型,1991-1993年丹麦、法国、德国均以P1-Ⅰ型为主[17]。本研究结果显示,P1-Ⅰ与P1-Ⅱ型在2015和2016年、急性上呼吸道感染和肺炎病例和不同性别急性呼吸道感染病例中的阳性率差异均不明显。在10-12月流行高峰期,P1-Ⅱ型阳性率高于P1-Ⅰ型;在0~、6~岁年龄组中,P1-Ⅰ型阳性率高于P1-Ⅱ型,与相关报道一致[14-15]。因对成年人病例中肺炎支原体基因分型研究较少,而本研究26~岁年龄组中P1-Ⅱ型阳性率高于P1-Ⅰ型,为首次报道。北京市不同基因型肺炎支原体的时间分布和年龄分布等流行规律仍需深入研究。
作者贡献:
石伟先 ORCID:0000-0002-1901-0597
石伟先:研究设计、方法建立、数据收集、资料分析与撰写
龚成:数据分析
李茂中、李爱华、罗明、张铁刚、董梅:样本收集与初筛检测
刘医萌、赵佳琛:基因分型检测
黄芳:组织协调
| [1] |
陆权, 陆敏. 肺炎支原体感染的流行病学[J]. 实用儿科临床杂志, 2007, 22(4): 241-243. Lu Q, Lu M. Epidemiology of Mycoplasma pneumoniae infection[J]. J Appl Clin Pediat, 2007, 22(4): 241-243. |
| [2] |
Dumke R, Schurwan N, Lenz M, et al. Sensitive detection of Mycoplasma pneumoniae in human respiratory tract samples by optimized real-time PCR approach[J]. J Clin Microbiol, 2007, 45(8): 2726-2730. DOI:10.1128/JCM.00321-07 |
| [3] |
Zhao F, Liu LY, Tao XX, et al. Culture-independent detection and genotyping of Mycoplasma pneumoniae in clinical specimens from Beijing, China[J]. PLoS One, 2015, 10(10): e0141702. DOI:10.1371/journal.pone.0141702 |
| [4] |
李爱华, 张铁钢, 石伟先, 等. 三种呼吸道病毒实验室检测方法比较[J]. 中华微生物学和免疫学杂志, 2013, 33(7): 541-544. Li AH, Zhang TG, Shi WX, et al. A comparison of three methods for detecting respiratory viruses[J]. Chin J Microbiol Immunol, 2013, 33(7): 541-544. DOI:10.3760/cma.j.issn.0254-5101.2013.07.012 |
| [5] |
Vervloet LA, Marguet C, Camargos PAM. Infection by Mycoplasma pneumoniae and its importance as an etiological agent in childhood community-acquired pneumonias[J]. Braz J Infect Dis, 2007, 11(5): 507-514. DOI:10.1590/S1413-86702007000500012 |
| [6] |
石伟先, 吴双胜, 龚成, 等. 2011-2015年北京5家哨点医院社区获得性肺炎病例中肺炎支原体流行特征及耐药情况[J]. 中华预防医学杂志, 2017, 51(9): 832-836. Shi WX, Wu SS, Gong C, et al. The epidemiological characteristics and drug resistance of Mycoplasma pneumoniae in patients with community-acquired pneumonia during 2011-2015 in 5 sentinel hospitals in Beijing[J]. Chin J Prev Med, 2017, 51(9): 832-836. DOI:10.3760/cma.j.issn.0253-9624.2017.09.011 |
| [7] |
黄海樱, 陈波, 周强, 等. 广州地区不同人群肺炎支原体感染的流行病学调查分析[J]. 中华医院感染学杂志, 2015, 25(2): 300-302. Huang HY, Chen B, Zhou Q, et al. Epidemiological survey of Mycoplasma pneumoniae infection in different populations in Guangzhou area[J]. Chin J Nosocomiol, 2015, 25(2): 300-302. DOI:10.11816/cn.ni.2015-133587 |
| [8] |
李军良. 2012-2013年秦皇岛地区成人肺炎支原体流行情况分析[J]. 预防医学情报杂志, 2015, 31(7): 508-510. Li JL. Epidemic status of adult Mycoplasma pneumonia in Qinhuangdao, 2012-2013[J]. J Prev Med Inf, 2015, 31(7): 508-510. |
| [9] |
张立, 陈志敏, 沈征, 等. 浙江省儿童鼻咽吸出物标本肺炎支原体基因分型研究[J]. 中华儿科杂志, 2011, 49(10): 750-754. Zhang L, Chen ZM, Shen Z, et al. Genotyping of Mycoplasma pneumoniae in nasopharyngeal aspirate from children with pneumonia in Zhejiang province[J]. Chin J Pediatr, 2011, 49(10): 750-754. DOI:10.3760/cma.j.issn.0578-1310.2011.10.009 |
| [10] |
王楠, 张凯, 张国成. 儿童肺炎支原体西安流行株的基因分型[J]. 临床儿科杂志, 2013, 31(5): 455-458. Wang N, Zhang K, Zhang GC. Genotyping of Mycoplasma pneumoniae strains in Xi'an[J]. J Clin Pediatr, 2013, 31(5): 455-458. DOI:10.3969/j.issn.1000-3606.2013.05.016 |
| [11] |
徐巧, 林书祥, 郭伟, 等. 220例住院肺炎患儿肺炎支原体的分子检测及其基因分型研究[J]. 中国当代儿科杂志, 2013, 15(1): 37-41. Xu Q, Lin SX, Guo W, et al. Molecular detection and genotyping of Mycoplasma pneumoniae in 220 children hospitalized with pneumonia[J]. Chin J Contemp Pediatr, 2013, 15(1): 37-41. DOI:10.7499/j.issn.1008-8830.2013.01.010 |
| [12] |
Xiao JH, Liu Y, Wang MG, et al. Detection of Mycoplasma pneumoniae P1 subtype variations by denaturing gradient gel electrophoresis[J]. Diagn Microbiol Infect Dis, 2014, 78(1): 24-28. DOI:10.7499/j.issn.1008-8830.2013.01.010 |
| [13] |
孙红妹, 薛冠华, 闫超, 等. 2010-2012年北京地区儿童肺炎支原体流行基因型监测[J]. 中华微生物学和免疫学杂志, 2012, 32(11): 939-943. Sun HM, Xue GH, Yan C, et al. Genotype analysis of Mycoplasma pneumoniae during 2010-2012 in children from Beijing[J]. Chin J Microbiol Immunol, 2012, 32(11): 939-943. DOI:10.3760/cma.j.issn.0254-5101.2012.11.004 |
| [14] |
郑宝英, 闫超, 薛冠华, 等. 耐药肺炎支原体肺炎患儿的临床特点及流行基因型特征分析[J]. 中华实用儿科临床杂志, 2017, 32(10): 735-739. Zheng BY, Yan C, Xue GH, et al. Analysis of clinical characteristics and epidemic genotypes of children with Mycoplasma pneumoniae pneumonia[J]. J Appl Clin Pediatr, 2017, 32(10): 735-739. DOI:10.3760/cma.j.issn.2095-428X.2017.10.005 |
| [15] |
肖光文, 李舟文, 张国雄, 等. 梅州地区小儿感染肺炎支原体生物群分布与耐药性差异研究[J]. 中国人兽共患病学报, 2016, 32(10): 898-902. Xiao GW, Li ZW, Zhang GX, et al. Mycoplasma pneumoniae serotypes distribution and drug resistance in Meizhou area, China[J]. Chin J Zoonoses, 2016, 32(10): 898-902. DOI:10.3969/j.issn.1002-2694.2016.010.010 |
| [16] |
Sasaki T, Kenri T, Okazaki N, et al. Epidemiological study of Mycoplasma pneumoniae infections in japan based on PCRrestriction fragment length polymorphism of the P1 cytadhesin gene[J]. J Clin Microbiol, 1996, 34(2): 447-449. |
| [17] |
Cousin-Allery A, Charron A, de Barbeyrac B, et al. Molecular typing of Mycoplasma pneumoniae strains by PCR-based methods and pulsed-field gel electrophoresis.Application to French and Danish isolates[J]. Epidemiol Infect, 2000, 124(1): 103-111. DOI:10.1017/S0950268899003313 |
 2018, Vol. 33
2018, Vol. 33


