扩展功能
文章信息
- 王红, 赵鹏, 杜悦, 何德辉, 苏爱荣, 蓝兰, 李秀桂, 黄彦
- Wang Hong, Zhao Peng, Du Yue, He Dehui, Su Airong, Lan Lan, Li Xiugui, Huang Yan
- 多菌型副溶血性弧菌共感染引起集中事件调查分析
- Survey of a foodborne outbreak caused by multi type Vibrio parahaemolyticus
- 疾病监测, 2018, 33(4): 312-315
- Disease Surveillance, 2018, 33(4): 312-315
- 10.3784/j.issn.1003-9961.2018.04.012
-
文章历史
- 收稿日期:2018-02-11
2. 贵港市疾病预防控制中心, 广西 贵港 537100
2. Guigang Prefectural Center for Disease Control and Prevention, Guigang 537100, Guangxi, China
副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种嗜盐革兰阴性杆菌,广泛存在于贝类、鱼、虾等海产品中,因交叉污染等在淡水产品中也大量检出[1]。经食源性感染VP后,可引起腹泻、发热、血便等急性肠胃炎症状[2]。目前,VP根据血清学分型包括13种O和74种K血清的不同组合[3]。在流行病调查时,VP血清型并不能完全解释事件的相关性,通常还需辅以脉冲场凝胶电泳(Pulsed - field gel electrophoresis,PFGE)等分子分型手段,以更清晰地明确菌株相关性以及污染溯源[4]。目前,国家致病菌识别网和PulseNet China以PFGE图谱构建了VP指纹图谱数据库,用于VP流行和暴发调查,并取得成果[5]。大量调查发现,分离自腹泻患者的大多数VP携带耐热直接溶血素基因(tdh)或相关溶血素基因(trh),而来源于食品或环境样品的菌株极少数检测这2个基因[2]。因此,常以是否携带这2个基因判断菌株的致病性,携带其一或同时携带2个基因菌株才被认为是致病VP。但也有不携带该2个基因的菌株感染引起腹泻的相关报道[6]。1996年后有一大克隆群的VP在全球各地引起感染率急剧上升,被称为“大流行株”,经调查发现,该群菌均携带有噬菌体f237独特的开放阅读框ORF8基因片段。因此,ORF8常被检测以判断该菌的流行强度和作为“大流行株”的判断依据[7]。这些相关毒力基因在流行调查时均不能忽视。
2017年9月广西壮族自治区某乡村举办丧宴,多名用餐人员出现呕吐、腹泻等急性肠胃炎症状,从入院腹泻患者13份肛拭标本中分离出10株VP。高度怀疑食物—对虾未留样,无法开展相关检测;其他食品、环境和生活饮用水等样品均未检出VP。为进一步调查该起事件性质,我们对这些分离株的血清型、毒力基因、PFGE分子分型等进行研究,并利用Bionumerics 6.6软件进行聚类分析,调查该起事件的特性,现将结果报告如下。
1 材料与方法 1.1 菌株来源从10名参加丧宴后出现呕吐或腹泻的急性肠胃炎患者肛拭子分离10株VP,编号为VP500~VP509。
1.2 生化鉴定与诊断血清分型所有可疑菌株经分离纯化后,利用VITEK 2 compact生化鉴定仪(生物梅里埃,法国)按照仪器操作规程进行生化鉴定。挑取斜面纯培养物用诊断血清(生研株式会社,日本)按产品说明书进行O抗原和K抗原玻片凝集实验。
1.3 相关毒力基因检测方法选择4个(tlh、tdh、trh和ORF8)与VP致病性相关的基因,采用CFX96荧光定量PCR仪(BIO-RAD,美国)通过TaqMan水解探针的多重荧光PCR方法进行检测。探针和引物参照文献[8]由Invitrogen生物技术有限公司(上海)合成。模板DNA用热裂解法提取,结果根据循环阈值(Ct)判定,Ct<34为阳性;Ct≥34为阴性。
1.4 PFGE分析参照国家致病菌识别网PFGE技术规范-VP脉冲场凝胶电泳标准操作方案进行,主要步骤:将培养16~18 h的新鲜菌落制备菌悬液,取等体积菌悬液与融化的1% SeaKem Gold琼脂糖(美国CAMBREX BIOSCIENCE ROCKLAND)混匀,制备Plug。经原位裂解后,用超纯水和TE(美国Invitrogen)溶液清洗。用限制性内切酶Sfi Ⅰ和Not Ⅰ[宝生物工程(大连)有限公司]进行原位酶切,标准分子质量用布伦登卢普沙门菌H9812(Salmonella braenderup H9812)的Xba Ⅰ[宝生物工程(大连)有限公司]酶切指纹谱带。PFGE仪CHEF MAPPER(美国BIO-RAD)电泳19 h后,Gelred(北京索莱宝科技有限公司)染胶,利用凝胶成像系统Gel DoCTM(美国BIO-RAD)读胶保存。
1.5 聚类分析将菌株PFGE指纹图谱、血清型、毒力基因谱以及菌株分离相关信息导入Bionumerics 6.6软件(Applied Maths,比利时)VP分子分型数据库。在分析相似度时,用Clustering功能对菌株的指纹图谱进行聚类,聚类相似系数(距离)采用基于条带的Dice差异,利用非加权组平均法(UPGMA)分析。
2 结果 2.1 血清诊断10株菌株可分5种血清型,其中O3:K6型6株;其他4株分别为O4:K8、O1:KUT、O2:KUT和O10:K19(图 1)。
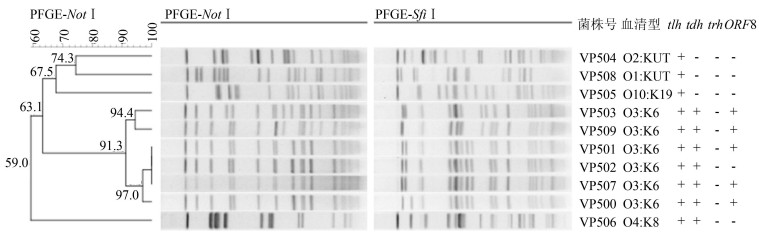
|
| 图 1 NotⅠ和SfiⅠ酶切脉冲场凝胶电泳图谱聚类分析 Figure 1 PFGE patterns of isolates with enzyme Not Ⅰ and Sfi Ⅰ digestion 注:致病株为VP500、VP501、VP502、VP503、VP506、VP507、VP509;非致病株为VP504、VP505、VP508;“大流行株”为VP500、VP501、VP503、VP507、VP509 |
| |
所有分离株tlh基因均为阳性,trh基因均为阴性。不同血清型VP携带tdh基因情况有所不同,O3:K6和O4:K8株均为阳性,其他血清型tdh基因均为阴性。对于ORF8基因,有5株O3:K6株为阳性,其他5株为阴性。值得注意的是,菌株VP502血清型也为O3:K6但ORF8基因呈阴性(图 1)。
2.3 PFGE分子分型聚类分析分离株经PFGE凝胶成像后,运用Bionumerics 6.6软件进行聚类分析。10株VP分离株分为8个不同型别(图 1),VP501、VP502和VP507具有相同型别,三者相似度为100%。其余菌株条带至少存在≥1条的差别,各为1个菌型。由聚类图可以看出,6株O3:K6血清型VP相似度较高,聚为一簇,相似度>91.3%。
3 讨论该起VP集中暴发事件与食用被污染食物密切相关,据调查,丧宴中的海产品对虾为高度怀疑的污染源头,但因未进行留样,故无法从食品上检出VP。另外提示对虾为污染来源的依据为,从就医患者中的1名5岁小男孩粪便标本中分离出VP(编号为VP504),但该儿童并未出席丧宴,仅食用由家人打包的对虾(未带其他食物),也同样腹泻并分离出VP。由聚类图可以看出,VP504的PFGE型别与其他患者分离株差别较大,未携带tdh和trh毒力基因。因此,该株菌的致病性及其在该暴发事件中的作用待进一步论证。
VP在各类海产品或海底沉积物中广泛存在,且通常为多种菌型的共生状态,1份标本可分离数种血清型VP。因此,一旦食物被污染,也将是各菌型VP共感染的结果。在调查VP感染时,本实验室结合菌株的血清型,tlh、tdh、trh、ORF8基因携带情况,Not Ⅰ和Sfi Ⅰ两种酶切后的PFGE带型进行综合分析。仅以上特征完全相同时才将这些菌株定义为“相同菌型”或“同一株菌”。在该次感染暴发事件中,虽菌株VP502与VP501、VP507均为O3:K6血清型,PFGE指纹图谱经Bionumerics 6.6软件分析结果也相同,但通过肉眼仔细辨认可以发现,VP501和VP507菌株由左侧第7、8条条带开始明显地分开,而VP502相同位置的2条带合在一起,且VP502的ORF8基因为阴性,VP501和VP507的ORF8基因呈阳性,基于此,我们认为VP502菌型与VP501和VP507不同,属于2个不同菌型。鉴于VP菌型具有多样性,在开展调查流行病学调查时,应从同一份标本中尽可能挑取多个可疑菌株,同时运用多种分型手段结合流行病学资料进行分析,以更全面地掌握流行株菌型和特征。而实际工作中,基层疾病预防控制机构却疏于菌型分析,仅以VP污染上报。该起集中暴发事件也存在该问题,每份标本仅保存1株菌,未能鉴别1份标本中是否存在多种菌型,在今后工作中应完善。
由该起暴发事件看出,按血清型、毒力基因型和PFGE型来说分别为5、3和8种,同为O3:K6血清型菌株可以分出4种PFGE型别,因此,PFGE分型最为敏感,在VP流行调查中不失为一种有效方法。VP主要毒力因子有耐热直接溶血素(TDH)和相关溶血素(TRH),其分别由tdh和trh基因编码,通常将携带有其中1个或2个基因的VP称为致病株。而在本次暴发中,由腹泻患者肛拭子分离的3株菌并未携带这2个基因,虽其致病力有待进一步研究,但提示该种“非致病菌株”在日常监测中也不能完全忽视。20世纪90年代末,以O3:K6为代表携带tdh和ORF8基因的VP在全球范围内导致发病率急剧增加[9-11]。在该起暴发分离株中,有5株VP具有相同特征,是“大流行株”克隆群,为感染暴发的主要菌群,与国内大多数研究相似[12-13]。值得注意的是,虽VP502血清型为O3:K6,tdh基因呈阳性,但ORF8基因呈阴性,故该株不属于“大流行株”抑或是“大流行株”变种。但无论何种情况,该起暴发事件及之前较多报道均提示,VP感染往往是多菌型,有效预防须从源头上将生熟食物严格分开,避免食物被污染[14-15]。
综上所述,VP菌群繁多,开展调查时应多挑取可疑菌落,并运用多种分型手段以更准确地分析暴发流行情况。本暴发事件是由一群多种血清型、多PFGE型别的致病和非致病VP共同引起。
作者贡献:
王红 ORCID:0000-0001-6561-8336
王红:文章撰写,PFGE实验
何德辉:菌株分离保存
杜悦、苏爱荣、蓝兰:菌株鉴定与血清 实验
赵鹏、李秀桂:现场调查,数据分析
黄彦:实验设计,技术支持
| [1] |
吴青, 韩海红, 余东敏, 等. 北京市水产品污染与感染病例中副溶血性弧菌血清型和毒力基因型的比较研究[J]. 中国食品卫生杂志, 2015, 27(4): 363-367. Wu Q, Han HH, Yu DM, et al. Comparative study of serotypes and virulence genes of Vibrio parahaemolyticus isolated from contaminated aquatic products and infection cases in Beijing[J]. Chin J Food Hyg, 2015, 27(4): 363-367. DOI:10.13590/j.cjfh.2015.04.004 |
| [2] |
Su YC, Liu CC. Vibrio parahaemolyticus:a concern of seafood safety[J]. Food Microbiol, 2007, 24(6): 549-558. DOI:10.1016/j.fm.2007.01.005 |
| [3] |
Guo X, Liu B, Chen M, et al. Genetic and serological identification of three Vibrio parahaemolyticus strains as candidates for novel provisional O serotypes[J]. Int J Food Microbiol, 2017, 245: 53-58. DOI:10.1016/j.ijfoodmicro.2017.01.010 |
| [4] |
Wong HC, Liu SH, Wang TK, et al. Characteristics of Vibrio parahaemolyticus O3:K6 from Asia[J]. Appl Environ Microbiol, 2000, 66(9): 3981-3986. DOI:10.1128/AEM.66.9.3981-3986.2000 |
| [5] |
李伟, 崔志刚, 阚飙, 等. 中国细菌性传染病分子分型实验室监测网络-PulseNet China[J]. 疾病监测, 2011, 26(1): 1-4. Li W, Cui ZG, Kan B, et al. The national molecular subtyping network for bacterial pathogens surveillance-PulseNet China[J]. Dis Surveill, 2011, 26(1): 1-4. DOI:10.3784/j.issn.1003-9961.2011.01.001 |
| [6] |
黄彦, 唐振柱, 王红, 等. 一起不同血清型食物中毒副溶血性弧菌毒力基因检测[J]. 应用预防医学, 2012, 18(4): 197-199. Huang Y, Tang ZZ, Wang H, et al. Detection of virulence gene and serotyping of Vibrio parahaemolyticus isolated from one food poisoning[J]. J Appl Prev Med, 2012, 18(4): 197-199. DOI:10.3969/j.issn.1673-758X.2012.04.003 |
| [7] |
Nasu H, Iida T, Sugahara T, et al. A filamentous phage associated with recent pandemic Vibrio parahaemolyticus O3:K6 strains[J]. J Clin Microbiol, 2000, 38(6): 2156-2161. |
| [8] |
Ward LN, Bej AK. Detection of Vibrio parahaemolyticus in shellfish by use of multiplexed real-time PCR with TaqMan fluorescent probes[J]. Appl Environ Microbiol, 2006, 72(3): 2031-2042. DOI:10.1128/AEM.72.3.2031-2042.2006 |
| [9] |
Okuda J, Ishibashi M, Hayakawa E, et al. Emergence of a unique O3:K6 clone of Vibrio parahaemolyticus in Calcutta, India, and isolation of strains from the same clonal group from Southeast Asian travelers arriving in Japan[J]. J Clin Microbiol, 1997, 35(12): 3150-3155. |
| [10] |
Bag PK, Nandi S, Bhadra RK, et al. Clonal diversity among recently emerged strains of Vibrio parahaemolyticus O3:K6 associated with pandemic spread[J]. J Clin Microbiol, 1999, 37(7): 2354-2357. |
| [11] |
Nair GB, Ramamurthy T, Bhattacharya SK, et al. Global dissemination of Vibrio parahaemolyticus serotype O3:K6 and its serovariants[J]. Clin Microbiol Rev, 2007, 20(1): 39-48. DOI:10.1128/CMR.00025-06 |
| [12] |
李薇薇, 梅玲玲, 唐震, 等. 2007-2009年中国副溶血性弧菌临床分离株分子特征分析[J]. 中华预防医学杂志, 2014, 48(1): 44-52. Li WW, Mei LL, Tang Z, et al. Analysis of molecular features of clinical Vibrio parahaemolyticus strains in China[J]. Chin J Prev Med, 2014, 48(1): 44-52. DOI:10.3760/cma.j.issn.0253-9624.2014.01.010 |
| [13] |
周丽萍, 王艳, 徐岚, 等. 江苏地区致病性副溶血性弧菌及大流行克隆的研究[J]. 中国卫生检验杂志, 2010, 20(11): 2719-2721, 2916. Zhou LP, Wang Y, Xu L, et al. Pathogenic bacteria and vice hemolytic solitary pandemic cloning research in Jiangsu[J]. Chin J Health Labor Technol, 2010, 20(11): 2719-2721, 2916. |
| [14] |
鞠长燕, 黄锐敏, 段永翔, 等. 食物中毒中不同血清型副溶血性弧菌基因特征分析[J]. 华南预防医学, 2014, 40(3): 229-234. Ju CY, Huang RM, Duan YX, et al. Genetic characterization of different serotypes of Vibrio parahaemolyticus isolated from food poisoning cases[J]. South China J Prev Med, 2014, 40(3): 229-234. DOI:10.13217/j.scjpm.2014.0229 |
| [15] |
田明胜, 郑雷军, 彭少杰, 等. 2000-2007年上海市副溶血性弧菌致集体性食物中毒分析及对策[J]. 中国食品卫生杂志, 2008, 20(6): 514-517. Tian MS, Zheng LJ, Peng SJ, et al. Analysis and measures on collective food poisoning caused by Vibrio parahaemolyticus in Shanghai munidpality during 2000-2007[J]. Chin J Food Hyg, 2008, 20(6): 514-517. DOI:10.3969/j.issn.1004-8456.2008.06.014 |
 2018, Vol. 33
2018, Vol. 33


