扩展功能
文章信息
- 梁均和, 李柏生, 刘涛华, 潘钊文, 黄妙琳, 赵劲文
- Liang Junhe, Li Baisheng, Liu Taohua, Pan Zhaowen, Huang Miaolin, Zhao Jingwen
- 广东省江门市一起副溶血弧菌食物中毒分离株的病原学特征分析
- Etiological characteristics of Vibrio parahaemolyticus strains isolated from a food poisoning event in Jiangmen, Guangdong
- 疾病监测, 2018, 33(5): 387-390
- Disease Surveillance, 2018, 33(5): 387-390
- 10.3784/j.issn.1003-9961.2018.05.009
-
文章历史
- 收稿日期:2018-02-07
2. 广东省疾病预防控制中心, 广东 广州 511430
2. Guangdong Provincial Center for Disease Control and Prevention, Guangzhou 511430, Guangdong, China
副溶血弧菌(Vibrio parahaemolyticus)是一种嗜盐性弧菌,常存在于近海岸的海水、鱼虾贝壳类等海产品中,居民多因食用未煮熟的海产品或被副溶血弧菌污染的食物而引起腹泻、腹痛、恶心、呕吐和发热等症状[1]。近年来,我国多省报道过副溶血弧菌引起的食物中毒事件[2],如果不及时送医治疗,可能会危及生命,因此事件发生后,快速确定病原体并找到污染源是事件处置和预防再次发生的关键。2017年8月,广东省江门市某公司发生一起食物中毒事件,患者主要症状为腹痛、腹泻和呕吐等不适,根据流行病学调查、临床表现和实验室检测结果,参照《感染性腹泻诊断标准》,证实为一起副溶血弧菌引起的食物中毒事件。为进一步了解该部分菌株的血清型别,耐药表型和分子特征,本研究对14株病例分离株和1株食物分离株进行了血清分型、药敏试验、毒力基因检测及脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分析同源性。
1 材料与方法 1.1 菌株和试剂来源从现场采集的19份病例肛拭子及2份剩余食物中检测出15株副溶血弧菌(14株分离自患者样本,1株分离自食物样本),保存菌株进行病原性分析。选择性分离培养基选用TCBS培养基(广东环凯公司),副溶血弧菌血清分型用的各种O血清和K血清购自日本Denka Seiken公司,所有试剂均在有效期内使用。
1.2 血清学分型菌株在3%NaCl TSA斜面上37 ℃培养过夜后,用接种环取新鲜培养物至3% NaCl灭菌盐水试管中,研磨成均匀的菌悬液,121 ℃高压1 h后,离心半径7 cm,4 000 r/min离心10 min,弃上清液后,再用3% NaCl灭菌盐水重悬,此菌悬浮液用于检测O抗原,用生理盐水作对照。剩余培养物上的菌苔用于玻片凝集检测K抗原。
1.3 抗菌药物敏感性试验参照国家致病菌识别网革兰阴性菌肠道菌群药敏实验方法,采用微量肉汤稀释法进行抗生素敏感试验,30种抗生素分别为氨苄西林(AMP)、氨苄西林/舒巴坦(AMS)、四环素(TET)、氯霉素(CHL)、复方新诺明(SXT)、头孢唑啉(CFZ)、头孢噻肟(CTX)、头孢他啶(CAZ)、头孢西丁(CFX)、庆大霉素(GEN)、亚胺培南(IMP)、萘啶酸(NAL)、阿奇霉素(AZI)、磺胺异恶唑(Sul)、环丙沙星(CIP)、阿莫西林/克拉维酸(AMC)、头孢噻肟/克拉维酸(CTX-C)、头孢他啶/克拉维酸(CAZ-C)、多粘菌素E(CT)、多粘菌素B(PB)、米诺环素(MIN)、阿米卡星(AMK)、氨曲南(AZM)、头孢吡肟(FEP)、美罗培南(MEM)、左氧氟沙星(LEV)、多西环素(DOX)、卡那霉素(KAN)、链霉素(STR)、吉米沙星(GEM)。药敏试验采用ATCC25922大肠埃希菌做质控菌株。实验结果在国家致病菌识别网进行录入和分析。
1.4 细菌DNA提取采取水煮法粗提DNA:分离株在3%NaCl TSA斜面37 ℃培养过夜后,挑取菌苔1环于200 μl灭菌水中充分研磨,菌悬液于100 ℃水浴10 min后再冰浴5 min,离心半径7 cm,10 000 r/min离心2 min,取上清用于PCR检测。
1.5 毒力基因PCR检测参照相关文献的反应条件,合成引物序列检测副溶血弧菌的tdh、trh、orf8和大流行克隆株基因(group - specific PCR,GS - PCR)[3-5]。PCR反应体系为25 μl,内含12.5 μl Taq Premix(2×),正、反向引物各1 μl,模板DNA 2 μl。PCR检测在温度梯度PCR仪T-100(美国Bio-Rad公司)上进行。毒力基因tdh、trh、orf8和GS-PCR产物大小分别为434、250、746和651 bp,扩增产物凝胶电泳后观察结果。
1.6 PFGE分型参照国家致病菌识别网副溶血弧菌PFGE标准操作方法,用NotⅠ和SfiⅠ内切酶消化基因组DNA后,在CHEF MAPPER脉冲场凝胶电泳仪(美国Bio-Rad公司)上电泳(温度14 ℃,起始转换时间为10 s,终止转换时间为35 s)18 h。电泳结束后,用1%的EB染色30 min,去离子水脱色3次,每次30 min后,使用Gel Doc EQ拍摄图像。获得的图像上传至国家致病菌识别网进行分析,基于菌株带型构建聚类树。
2 结果 2.1 流行病学资料 2.1.1 疫情概况2017年8月,江门市某公司发生一起食物中毒事件,病例均为该公司员工,发病47例,罹患率为42.73%(47/110),其中11例症状稍重需要留院治疗,其余轻症病例经门诊简单治疗后病情好转,无死亡病例。47例病例的主要症状为腹痛(脐周阵发性绞痛)、腹泻(黄褐色水样便)、恶心、呕吐等,无发热、抽搐、紫绀、紫斑、呼吸困难、脸色潮红等症状。
2.1.2 发病时间最早为8月12日02:00,最晚11:00,发病高峰在当天06:00,见图 1。发病曲线显示该次事件为一次点源暴发,平均潜伏期约10~14 h,根据流行病学资料分析,从发病高峰往前推一个平均潜伏期,该次事件可能的暴露时间为8月11日。
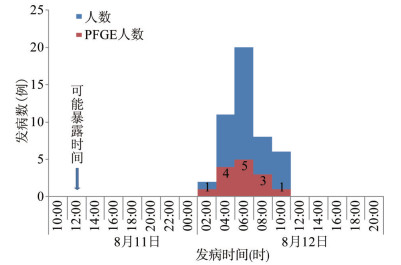
|
| 图 1 2017年8月11-12日江门市某公司食物中毒病例发病时间曲线 Figure 1 Incidence curve of food poisoning cases in a company in Jiangmen, August 11-12, 2017 |
| |
对34例病例采血进行血常规检验,结果26份血液样本WBC计数升高,对11份粪便进行常规检验,结果2份显示便潜血弱阳性。采集19份病例肛拭子、1份剩余食物(萝卜干炒肉片)、1份腌制萝卜送江门市疾病预防控制中心病原微生物实验室,分别开展副溶血弧菌、沙门菌、致泻性大肠埃希菌、志贺菌、诺如病毒、轮状病毒等检验。
2.2 分离鉴定14份肛拭子和1份剩余食物检出副溶血弧菌,其余项目均未检出。所有分离株均革兰阴性杆菌或弧形菌,无芽孢及荚膜,氧化酶试验阳性。经API20E生化鉴定为副溶血弧菌。
2.3 毒力基因和耐药检测经血清凝集试验检测,所有菌株均为O3:K6型。经PCR检测,15株分离株均为tdh+trh-菌株,并且均携带GS-PCR和orf8基因。药敏试验结果显示,15株分离株的耐药谱完全一致,所有菌株对氨苄西林及头孢唑啉耐药率为100%,而对其他试验抗生素则完全敏感。
2.4 PFGE分型15株副溶血弧菌经 NotⅠ酶切,脉冲电泳后,在20~1 000 kb范围内产生19~20条片段条带,分别将所有菌的PFGE指纹图谱导入致病菌识别网中,与数据库中江门地区往年分离的4株O3:K6散发分离株进行聚类分析,结果显示14株病例暴发分离株与1株食物分离株的PFGE指纹图谱高度一致,相似度为97.8%,各分离株的PFGE指纹图谱仅存在1个条带的位置稍微有点偏差,而2017年的暴发分离株与往年的O3:K6散发分离株的PFGE指纹图谱则存在较大的区别,见图 2。为进一步明确暴发菌株之间的遗传相关性,对暴发分离株再次以SfiⅠ内切酶消化后,在20~1 000 kb范围内产生18条片段条带,结果显示14株病例暴发分离株与1株食物分离株的PFGE指纹图谱相似度为94.4%,各分离株的PFGE指纹图谱仅存在1个条带的位置稍微有点偏差,见图 3。

|
| 图 2 副溶血弧菌分离株NotⅠ内切酶消化脉冲场凝胶电泳分子分型聚类结果 Figure 2 Dendrogram of PFGE patterns generated from NotⅠ-digested genomic DNA of V. parahaemolyticus isolates |
| |

|
| 图 3 副溶血弧菌分离株SfiⅠ内切酶消化PFGE分子分型聚类结果 Figure 3 Dendrogram of PFGE patterns generated from SfiⅠ-digested genomic DNA of V. parahaemolyticus isolates |
| |
副溶血弧菌是一种嗜盐性菌,在海产品中检出率较高,多见于日本、东南亚、美国及我国沿海地区,是我国沿海地区食物中毒事件中的主要致病菌[6-7],同时,其具有遗传多样性,我国存在多个该菌血清型的流行[8]。而江门市是我国南方典型的沿海城市,具备丰富的海洋资源,因此该菌的流行对江门市居民的健康存在潜在威胁。
本次食物中毒事件中,从患者肛拭样本和剩余食物中共分离出15株副溶血弧菌,血清型均为O3:K6。有研究认为,tdh和trh基因是副溶血弧菌的主要毒力因子,GS-PCR和/或orf8基因是副溶血弧菌大流行克隆株的标志性基因。大流行克隆株是1996年以后分离的,携带tdh基因,缺失trh基因,GS-PCR阳性和/或orf8基因阳性的副溶血弧菌,主要包括了O3:K6,O1:KUT等在内的20多种血清型。本研究中发现,2017年江门市副溶血弧菌食物中毒分离株均为tdh+trh-型菌株,并携带典型的“大流行克隆株”基因GS-PCR和orf8,具备引起副溶血弧菌暴发流行的条件,因此,需要加强对这类菌株的监测,防止其在本地区引起发生更大范围的暴发和流行。
随着分子生物学技术的发展,PFGE细菌分型技术已经被证实是细菌分子流行病学研究的“金标准”[9]。基因分型技术可以为同一时间发生的暴发事件溯源分析提供依据,我国的国家致病菌识别网,以网络化信息平台为依托,采用病原识别、分子分型、基因组溯源等新型调查分析技术开展细菌性传染病监测和防控,建立了PFGE标准化方案及数据库。在本案例溯源调查中,经过NotⅠ和SfiⅠ内切酶消化后的PFGE分子分型结果显示,2017年8月发生在江门市由副溶血弧菌引起的食物中毒暴发事件分离株具有高度一致的PFGE型别,并与本地区其他年份分离的散发分离株的PFGE型别相似度较低,结合患者的发病时间、就餐情况、临床表现以及暴露因素等流行病学资料可以确定这起食物中毒事件是由2种克隆群的副溶血弧菌引起。研究表明,PFGE分型技术在食源性疾病的暴发调查中显示了绝对的优势,基于分子分型技术的国家致病菌识别网在处理、预防和控制细菌性传染病的主动监测和暴发溯源中起着非常重要的作用。
作者贡献:
梁均和 ORCID:0000-0002-8498-4011
梁均和:检验,数据分析,论文写作
李柏生:检验,数据分析
刘涛华:数据整理
潘钊文、黄妙琳:检验
赵劲文:现场采样,流行病学调查
| [1] |
刘萍, 高敏国, 周伟杰, 等. 无锡市2011-2014年食物中毒事件流行病学分析[J]. 江苏预防医学, 2015, 26(6): 101-102. Liu P, Gao MG, Zhou WJ, et al. Epidemiological analysis of food poisoning incidents from 2011to 2014 in Wuxi city[J]. Jiangsu J Prev Med, 2015, 26(6): 101-102. DOI:10.13668/j.issn.1006-9070.2015.06.045 |
| [2] |
赵振, 丁越江, 巫波, 等. 北京市海淀区2000-2009年食物中毒的流行病学分析[J]. 现代预防医学, 2011, 38(3): 441-443. Zhao Z, Ding YJ, Wu B, et al. Epidemiological analysis of food poisoning in Haidian district of Beijing from 2000 to 2009[J]. Mod Prev Med, 2011, 38(3): 441-443. |
| [3] |
Bej AK, Patterson DP, Brasher CW, et al. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh[J]. J Microbiol Methods, 1999, 36(3): 215-225. DOI:10.1016/S0167-7012(99)00037-8 |
| [4] |
Bhuiyan NA, Ansaruzzaman M, Kamruzzaman M, et al. Prevalence of the pandemic genotype of Vibrio parahaemolyticus in Dhaka, Bangladesh, and significance of its distribution across different serotypes[J]. J Clin Microbiol, 2002, 40(1): 284-286. DOI:10.1128/JCM.40.1.284-286.2002 |
| [5] |
Matsumoto C, Okuda J, Ishibashi M, et al. Pandemic spread of an O3:K6 clone of Vibrio parahaemolyticus and emergence of related strains evidenced by arbitrarily primed PCR and toxRS sequence analyses[J]. J Clin Microbiol, 2000, 38(2): 578-585. |
| [6] |
江艳华, 姚琳, 宋春丽, 等. 青岛市售贝类副溶血性弧菌污染状况及耐药性分析[J]. 中国卫生检验杂志, 2012, 22(2): 375-377. Jiang YH, Yao L, Song CL, et al. The pollution status and drug resistance of Vibrio parahaemolyticus of shellfish in Qingdao[J]. Chin J Health Lab Technol, 2012, 22(2): 375-377. |
| [7] |
孔玲, 封会茹, 王兆娥, 等. 丰台区2013年水产品及腹泻患者中副溶血性弧菌脉冲场凝胶电泳分型[J]. 实用预防医学, 2016, 23(11): 1388-1391. Kong L, Feng HR, Wang ZE, et al. Pulsed field gel electrophoresis typing of Vibrio parahaemolyticus isolated from aquatic products and diarrhea patients in Fengtai district, 2013[J]. Pract Prev Med, 2016, 23(11): 1388-1391. DOI:10.3969/j.issn.1006-3110.2016.11.032 |
| [8] |
程苏云, 翁景清, 林香娟, 等. 副溶血性弧菌食物中毒菌株的血清型、耐药性及基因检测[J]. 中国卫生检验杂志, 2002, 12(2): 141-142. Cheng SY, Weng JQ, Lin XJ, et al. Serotype, resistance, tdh and trh gene analysis of food poison strain in Vibrio papahaemolyticus[J]. Chin J Health Lab Technol, 2002, 12(2): 141-142. DOI:10.3969/j.issn.1004-8685.2002.02.005 |
| [9] |
Safa A, Bhuiyan NA, Alam M, et al. Genomic relatedness of the new Matlab variants of Vibrio cholerae O1 to the classical and El Tor biotypes as determined by pulsed-field gel electrophoresis[J]. J Clin Microbiol, 2005, 43(3): 1401-1404. DOI:10.1128/JCM.43.3.1401-1404.2005 |
 2018, Vol. 33
2018, Vol. 33


