扩展功能
文章信息
- 李东迅, 王艳, 马爱静, 王毅, 刘凯, 刘东鑫, 王和, 叶长芸
- LI Dong-xun, WANG Yan, MA Ai-jing, WANG Yi, LIU Kai, LIU Dong-xin, WANG He, YE Chang-yun
- 单增李斯特菌1/2c血清型菌株生物膜形成能力的研究
- Study on biofilm formation of foodborne Listeria monocytogenes serotype 1/2c strains
- 疾病监测, 2015, 30(6): 474-478
- Disease Surveillance, 2015, 30(6): 474-478
- 10.3784/j.issn.1003-9961.2015.06.011
-
文章历史
- 收稿日期:2015-02-09
2. 传染病预防控制国家重点实验室,中国疾病预防控制中心传染病预防控制所,北京 102206;
3. 南华大学病原生物学研究所,湖南 衡阳 421001
2. State Key Laboratory for Communicable Disease Prevention and Control,Institute for Communicable Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing 102206,China;
3. Pathogen Biology Research Institute,University of South China,Hengyang 421001,Hunan,China
单增李斯特菌是一种革兰阳性、兼性厌氧的短杆菌,广泛分布于食品和自然环境[1]。该菌是一种重要的食源性病原体,可引起人和动物李斯特菌病的散发和暴发,主要感染免疫力低下(老年人、孕妇及新生儿)和免疫缺陷的人群,引起发热性胃肠炎、败血症、早产、流产以及死产等临床病症[2, 3]。
食源性动物及肉类中单增李斯特菌分离情况被广泛研究。Takahashi等[4]的研究结果显示,在牛大肠内含物和牛胴体表面未分离到单增李斯特菌。Sasaki等[5]在110份猪肝样品中分离到1株单增李斯特菌,其分离率远低于肉类食品中单增李斯特菌污染率[6],Kanuganti等[7] 的研究证实,生猪肉中的单增李斯特菌的污染率远高于猪体本身的携带率,可能与其屠宰后的加工处理过程有关。单增李斯特菌能附着于各种生物及非生物表面并形成生物膜,从而获得耐高温、高盐、干燥以及抵抗消毒剂、抗菌药物、紫外线的能力[8, 9]。因此,在食品加工、储存及销售环境中,生物膜的形成是其成为潜在食品微生物污染源的一个重要因素,从而导致食品中食源性病原体的传播[10]。
目前单增李斯特菌被分为13种血清型,血清型1/2a、1/2b、1/2c和4b经常分离于食品及患者标本[11]。已报道的中国食源性单增李斯特菌大部分为1/2c血清型[12],且本实验室前期的调查发现,从市场采集的生肉制品分离到的单增李斯特菌也以1/2c血清型为主,其他血清型菌株分离较少。为探究单增李斯特菌1/2c血清型菌株在我国食品中分离率较高的可能因素,本研究选取2014年北京生肉标本中分离到的20株单增李斯特菌1/2c血清型菌株和9株其他血清型菌株,比较不同生存压力条件下1/2c菌株和其他血清型菌株生物膜形成能力差异;同时选取20株本实验室保存的其他地区菌株(8株1/2c血清型和12株其他血清型)进行比较验证,为我国1/2c血清型单增李斯特菌生物膜形成能力与其高污染率的相关性提供可能的线索。
1 材料与方法 1.1 材料 1.1.1 菌株选择根据血清型和基因型别选取菌株,2014年北京地区分离菌株和其他地区分离菌株见表1。1/2a血清型单增李斯特菌参考菌株EGD-e作为实验对照菌株。
| 菌株 | 血清型 | 菌株数 |
| 北京地区分离LM | 1/2c | 20 |
| 1/2a | 3 | |
| 1/2b | 2 | |
| 3a | 4 | |
| 其他地区分离LM | 1/2c | 8 |
| 1/2a | 4 | |
| 1/2b | 3 | |
| 3a | 2 | |
| 4a | 1 | |
| 4b | 1 | |
| 4c | 1 |
胰蛋白胨大豆肉汤(TSB)购自美国BD公司;脑心浸液(BHI)购自北京陆桥技术有限公司;结晶紫染料购自美国Amresco公司;无水乙醇购自北京化工厂;恒温振荡器购自美国精骐公司;生化培养箱(ICP600)购自德国Memmert公司;紫外分光光度计(CARY-50)购自美国瓦里安中国有限公司;酶标仪(BioTek)购自美国伯腾公司。
1.2 方法 1.2.1 菌液制备将-80℃保存的实验菌株划线接种于脑心浸液(BHI)固体培养基复苏,挑取单菌落接种于5 ml BHI液体培养基中,37℃,220 r/min,过夜培养,吸取50μl菌液加入5 ml胰蛋白胨大豆肉汤(TSB),37℃,220 r/min,培养至A600=0.6备用。
1.2.2 不同压力条件下,北京地区不同血清型单增李斯特菌分离株生物膜形成能力 1.2.2.1 不同培养温度96孔培养板生物膜形成能力检测参照Kostaki等[13]使用的方法:吸取200 μl菌液(A600=0.6)于96孔培养板微孔中(每个菌株做7个平行样),无菌TSB液作为空白对照,于25℃静置3 h以便菌黏附于96孔培养板微孔表面,之后用移液器去除菌液,每孔加入200 μl无菌PBS洗涤以便去除附着不牢固菌(重复洗涤2次),每孔再加入200 μl TSB液于4℃/16℃/25℃/37℃静置培养48 h(每组实验重复3次,TSB培养液pH=7.0)。
1.2.2.2 不同培养基吸取200 μl菌液(A600=0.6)于96孔培养板微孔中(每个菌株做7个平行样),无菌TSB液作为空白对照,于25℃静置3 h以便菌黏附于96孔培养板微孔表面,之后用移液器去除菌液,每孔加入200 μl无菌PBS洗涤以便去除附着不牢固菌(重复洗涤2次),每孔再分别加入200 μl TSB/ 10%TSB/ MWB(Modified Welshimer’s broth),于25℃静置培养48 h(每组实验重复3次,TSB/ 10%TSB培养液pH=7.0)。
1.2.2.3 不同pH值吸取200 μl菌液(A600=0.6)于96孔培养板微孔中(每个菌株做7个平行样),无菌TSB液作为空白对照,于25℃静置3 h以便菌黏附于96孔培养板微孔表面,之后用移液器去除菌液,每孔加入200 μl无菌PBS洗涤去除附着不牢固菌(重复洗涤2次),每孔再分别加入pH=3、4、5、6、7、8、9、10的TSB液200 μl,于25℃静置培养48 h。
1.2.3 其他地区不同血清型单增李斯特菌分离株生物膜形成能力在已证实1/2c血清型单增李斯特菌生物膜形成能力较强的条件下(包括25℃、TSB、10% TSB和pH=7、8),进行其他地区不同血清型单增李斯特菌分离株的生物膜形成能力验证(方法同上述不同压力条件相应的操作方法)。
1.2.4 生物膜的菌含量测定参照叶正兴等[14]使用的方法进行生物膜的菌含量测定:培养结束后,弃菌液,无菌水洗涤3次弃去附着不牢固细菌,每孔加入200 μl 0.1%结晶紫溶液,室温染色30 min后弃去染液并用无菌蒸馏水洗5次,最后加入200 μl 95%乙醇溶液溶解结晶紫,于595 nm测A值。
1.2.5 数据分析实验数据采用SPSS 17.0软件进行单因素方差分析。
2 结果 2.1 北京地区不同血清型单增李斯特菌分离株生物膜形成能力 2.1.1 不同培养温度在4℃时,单增李斯特菌生物膜形成能力极低,随着温度升高单增李斯特菌生物膜形成能力逐渐增加,在37℃时达最大值;且25 ℃培养条件下,1/2c血清型菌株形成生物膜的能力强于其他血清型菌株(P<0.05),见图1A。
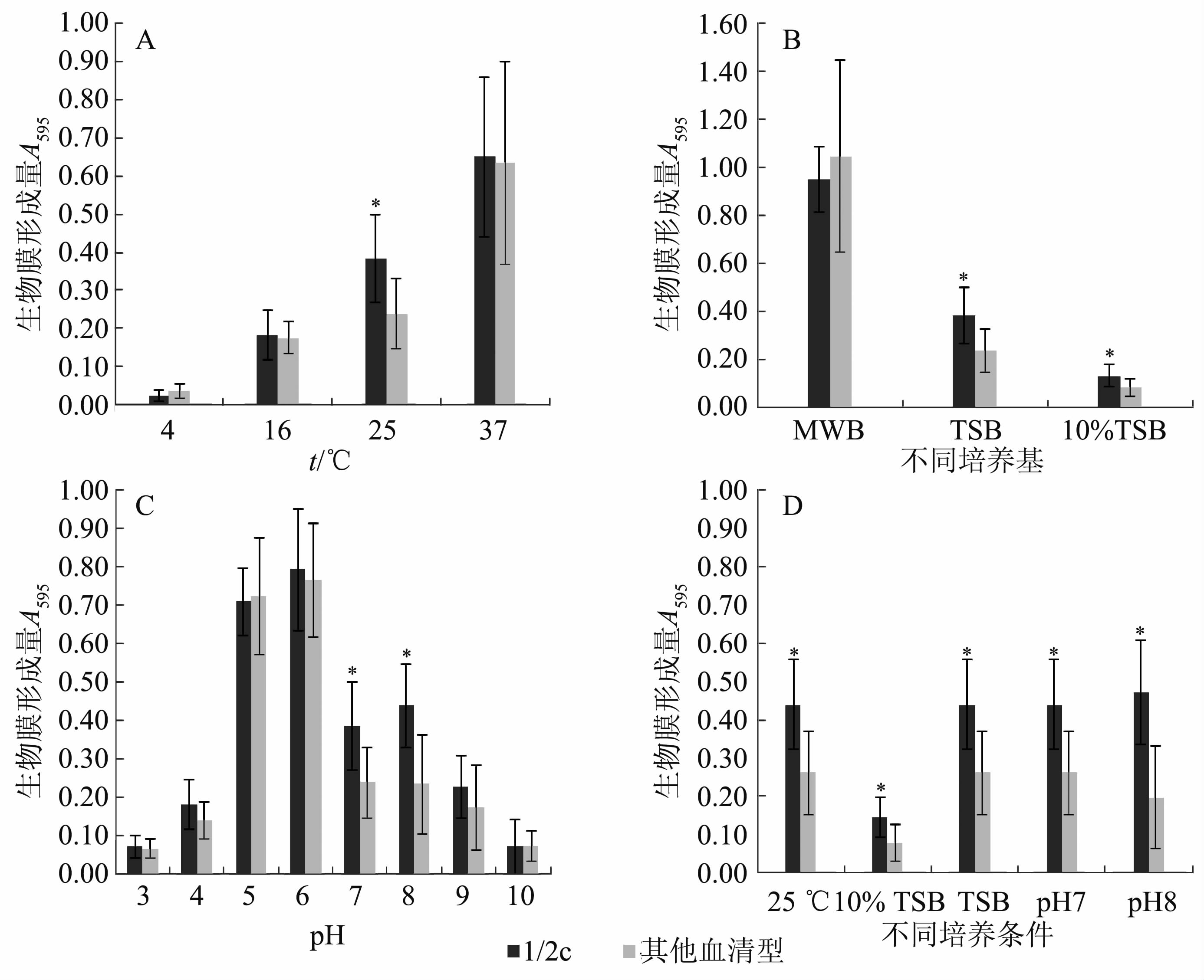
|
| 图1 单增李斯特菌1/2c血清型和其他血清型菌株在不同压力条件下生物膜形成能力比较 Fig.1 Biofilm formation capabilities of L.monocytogenes serotype 1/2c and other serotypes strains at different conditions 注:A、B、C分别为北京地区分离菌株在不同温度、不同培养基、不同pH值条件下生物膜形成能力比较; D为中国其他地区分离菌株在不同压力条件下生物膜形成能力比较。*表示在同一条件下,1/2c血清型和其他血清型菌株生物膜形成能力的差异有统计学意义(P<0.05)。 |
在MWB培养基中单增李斯特菌生物膜形成能力较强,且1/2c血清型与其他血清型菌株生物膜形成能力的差异无统计学意义(P>0.05)。将TSB培养液稀释为10% TSB后,单增李斯特菌生物膜形成能力降低,但在这2种培养基中,1/2c血清型单增李斯特菌的生物膜形成能力均强于其他血清型菌株(P<0.05),见图1B。
2.1.3 不同pH值偏酸和偏碱的环境有利于单增李斯特菌生物膜形成,且pH=5、6时生物膜形成能力最强(P<0.05),但在pH=7、8环境中1/2c血清型菌株生物膜形成能力强于其他血清型菌株(P<0.05);随着酸/碱度的逐渐增加,单增李斯特菌生物膜形成能力逐渐降低,直至不形成生物膜,见图1C。
2.2 其他地区不同血清型单增李斯特菌分离株生物膜形成能力在25℃、TSB、10%TSB和pH=7、8条件下,其他地区分离的食源性1/2c血清型单增李斯特菌的生物膜形成能力也强于其他血清型菌株(P<0.05),与2014年北京地区分离的1/2c血清型单增李斯特菌的生物膜形成能力相似,见图1D。
3 讨论生物膜是由细菌分泌的胞外多聚物包被而形成的细菌群体结构,有助于细菌黏附于生物或非生物表面[15]。生物膜的形成是导致食品污染的主要原因,影响生物膜形成的因素多且复杂。目前认为,培养温度是影响单增李斯特菌生物膜形成能力的重要因素,随着温度的升高生物膜形成能力逐渐增强,在37℃时单增李斯特菌生物膜形成能力最强[16]。Norwood和Glimour[17]报道,在4、18、30℃培养条件下单增李斯特菌株FM876(1/2c)黏附能力强于单增李斯特菌株ScottA(4b)。本研究结果显示,在不同温度培养条件下,随着温度的升高单增李斯特菌生物膜形成能力逐渐增强,且1/2c血清型菌株在25℃时生物膜形成能力强于其他血清型菌株(P<0.05)。由此提示在室温条件下,血清型1/2c菌株相较于其他血清型可能更易于形成生物膜。
早期研究显示,单增李斯特菌的生物膜形成能力受营养条件的影响[18]。本研究的结果与Harvey等[19]的发现相似,在MWB基本培养基中单增李斯特菌生物膜形成能力强于TSB培养基中的菌株,且TSB培养基中单增李斯特菌生物膜形成能力强于稀释的TSB培养基。本研究还证实,在TSB培养基和10% TSB培养基中,1/2c血清型菌株生物膜形成能力强于其他血清型菌株,提示在富营养/低营养环境中,1/2c血清型菌株可能易于形成生物膜。
单增李斯特菌生物膜形成能力也受pH值的影响,其疏水性和表面黏附力随着环境pH值降低而增加[20,21]。李燕杰等[22]报道中性略偏碱性条件有利于单增李斯特菌生物膜形成。Giäo和Keevil[23]报道单增李斯特菌能在自来水中形成生物膜。本实验结果显示,在偏酸或偏碱的环境中,单增李斯特菌生物膜形成能力增加,且在偏碱(pH=7~8)环境中,1/2c血清型菌株的生物膜形成能力强于其他血清型菌株。本研究菌株来源的标本所采集的市场主要用自来水冲洗进行清洁,经测定该市场自来水为弱碱性(pH=7.6~7.8),提示在销售市场环境中1/2c血清型菌株可能易形成生物膜。
本研究比较了不同压力条件下,1/2c血清型和其他血清型单增李斯特菌生物膜形成能力的差异,证实2014年北京地区分离的食源性单增李斯特菌和国内其他地区的分离株,在室温、富/低营养条件和中性略偏碱性环境中1/2c血清型菌株的生物膜形成能力强于其他血清型菌株,而这些条件在食品加工及销售环境中较为常见,提示这可能是我国食源性1/2c血清型单增李斯特菌污染率较高的原因之一。因此,在食品加工、储存和销售的各个环节中,采取积极有效的消毒措施去除单增李斯特菌生物膜产生的条件,对减少食品中单增李斯特菌的污染率,降低食源性单增李斯特菌病的发生具有重要意义。
单增李斯特菌生物膜的形成是一个复杂的过程(细菌黏附、胞外多聚物的形成及成熟生物膜的形成),受群体感应系统的调控,涉及转录调控、新陈代谢、鞭毛及粘肽合成[24]。研究认为生物膜形成受相关基因的调控,如flaA、degU、agrA和luxS等基因参与早期生物膜形成;而yneA、recA、relA、hpt和prfA等基因则作用于生物膜成熟阶段[25]。因此,可从分析生物膜形成相关基因着手,进一步探究1/2c血清型单增李斯特菌生物膜形成能力较强的可能机制。
| [1] | McLauchlin J, Mitchell RT, Smerdon WJ, et al. Listeria monocytogenes and listeriosis: a review of hazard characterisation for use in microbiological risk assessment of foods [J]. Int J Food Microbiol, 2004,92(1):15-33. |
| [2] | Freitag NE, Port GC, Miner MD. Listeria monocytogenes -from saprophyte to intracellular pathogen [J]. Nat Rev Microbiol, 2009,7(9):623-628. |
| [3] | Gandhi M, Chikindas ML. Listeria: A foodborne pathogen that knows how to survive [J]. Int J Food Microbiol, 2007,113(1):1-15. |
| [4] | Takahashi T, Ochiai Y, Matsudate H, et al. Isolation of Listeria monocytogenes from the skin of slaughtered beef cattle[J]. J Vet Med Sci, 2007,69(10):1077-1079. |
| [5] | Sasaki Y, Haruna M, Murakami M, et al. Prevalence of Campylobacter spp., Salmonella spp., Listeria monocytogenes , and hepatitis E virus in swine livers collected at an abattoir[J]. Jpn J Infect Dis, 2013,66(2):161-164. |
| [6] | Gao YN. Identification and pathogen characteristics analysis of PRRSV,PCUZ,SIV and HCV [J]. Chinese Journal of Animal Quarantine, 2012,29(4):56-58.(in Chinese) 高影凝. 部分猪场猪繁殖与呼吸综合征、圆环病毒-2、猪流感、猪瘟的病原检测和初步分析[J]. 中国动物检疫,2012,29(4):56-58. |
| [7] | Kanuganti SR, Wesley IV, Reddy PG, et al. Detection of Listeria monocytogenes in pigs and pork[J]. J Food Protectp, 2002,65(9):1470-1474. |
| [8] | Silva S, Teixeira P, Oliveira R, et al. Adhesion to and viability of Listeria monocytogenes on food contact surfaces [J]. J Food Protectp, 2008,71(7):1379-1385. |
| [9] | Carpentier B, Cerf O. Review-Persistence of Listeria monocytogenes in food industry equipment and premises [J]. Int J Food Microbiol, 2011,145(1):1-8. |
| [10] | Rieu A, Briandet R, Habimana O, et al. Listeria monocytogenes EGD-e biofilms: no mushrooms but a network of knitted chains [J]. Appl Environ Microbiol, 2008,74(14):4491-4497. |
| [11] | Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR [J]. J Clin Microbiol, 2004,42(8):3819-3822. |
| [12] | Wang Y, Zhao A, Zhu RF, et al. Genetic diversity and molecular typing of Listeria monocytogenes in China[J]. BMC Microbiology, 2012,12:119. |
| [13] | Kostaki M, Chorianopoulos N, Braxou E, et al. Differential biofilm formation and chemical disinfection resistance of sessile cells of Listeria monocytogenes strains under monospecies and dual-species (with Salmonella enterica) conditions [J]. Appl Environ Microbiol, 2012,78(8):2586-2595. |
| [14] | Ye ZX, Wang Y, Li PJ, et al. Biofilm formation of Listeria monocytogenes serotype 1/2a strains and the diversity in correlated genes [J]. Chinese Journal of Zoonoses, 2013,29(4):354-360. (in Chinese) 叶正兴,王艳,李培京,等. 单增李斯特菌1/2a血清型菌株生物膜形成能力及相关基因差异研究[J]. 中国人兽共患病学报,2013,29(4):354-360. |
| [15] | Costerton JW, Lewandowski Z, DeBeer D, et al. Biofilms, the customized microniche [J]. J Bacteriol, 1994,176(8):2137-2142. |
| [16] | Rodrigues DA, Almeida MA, Teixeira PA, et al. Effect of batch and fed-batch growth modes on biofilm formation by Listeria monocytogenes at different temperatures [J]. Curr Microbiol, 2009,59(4):457-462. |
| [17] | Norwood DE, Gilmour A. The differential adherence capabilities of two Listeria monocytogenes strains in monoculture and multispecies biofilms as a function of temperature [J]. Appl Microbiol, 2001,33:320-324. |
| [18] | Djordjevic D, Wiedmann M, McLandsborough LA. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation [J]. Applied and Environmental Microbiology, 2002,68(6):2950-2958. |
| [19] | Harvey J, Keenan KP, Gilmour A. Assessing biofilm formation by Listeria monocytogenes strains [J]. Food microbiol, 2007,24(4):380-392. |
| [20] | Duffy G, Sheridan JJ. The effect of temperature, pH and medium in a surface adhesion immunofluorescent technique for detection of Listeria monocytogenes [J]. J Appl Microbiol, 1997,83(1):95-101. |
| [21] | Mafu AA, Roy D, Goulet J, et al. Characterization of physicochemical forces involved in adhesion of Listeria monocytogenes to surfaces [J]. Appl Environ Microbiol, 1991,57(7):1969-1973. |
| [22] | Li YJ, Zhu XH, Xia Y, et al. The influence of various culture conditions on Llisteria monocytogenes biofilm formation [J]. Food Research and Development, 2010,31(11):188-192. (in Chinese) 李燕杰,朱小花,夏雨,等. 不同培养条件对单增李斯特菌生物被膜形成的影响研究[J].食品研究与开发,2010,31(11):188-192. |
| [23] | Giäo MS, Keevil CW. Listeria monocytogenes can form biofilms in tap water and enter into the viable but non-cultivable state [J]. Microb Ecol, 2014,67(3):603-611. |
| [24] | Nguyen UT, Harvey H, Hogan AJ, et al. Role of PBPD1 in stimulation of Listeria monocytogenes biofilm formation by subminimal inhibitory beta-lactam concentrations [J]. Antimicrob Agents Chemother, 2014,58(11):6508-6517. |
| [25] | Renier S, Hébraud M, Desvaux M. Molecular biology of surface colonization by Listeria monocytogenes : an additional facet of an opportunistic gram-positive foodbrone pathogen [J]. Environ Microbiol, 2011,13(4):835-850. |
 2015, Vol. 30
2015, Vol. 30


