扩展功能
文章信息
- 杜悦, 王红, 苏爱荣, 韦程媛, 李秀桂, 谭冬梅, 黄彦
- DU Yue, WANG Hong, SU Ai-rong, WEI Cheng-yuan, LI Xiu-gui, TAN Dong-mei, HUANG Yan
- 急性腹泻病患者与健康体检人员肠集聚性大肠埃希菌分子特征及耐药性研究
- Antibiotic resistance and molecular characteristics of enteroaggregative Escherichia coli from patients with acute diarrhea and persons receiving health examination
- 疾病监测, 2017, 32(12): 931-935
- Disease Surveillance, 2017, 32(12): 931-935
- 10.3784/j.issn.1003-9961.2017.12.009
-
文章历史
- 收稿日期:2017-09-04
肠聚集性大肠埃希菌(enteroaggregative Escherichia coli,EAEC)最早于1987年在智利发现,可产生毒素与黏附素,易感染儿童与免疫低下人群并引发急性和持续性腹泻。由EAEC引发的腹泻在发展中国家和工业化国家是一个重大的公共卫生问题。2011年德国曾暴发由产志贺毒素的EAEC引发的疫情,这次疫情提示人们EAEC具有极强的重组能力。而EAEC并非只存在于腹泻患者体内,前往墨西哥的旅行者中有10%检出隐性感染了EAEC[1],美国2006年对门诊患者与健康志愿者的调查中,EAEC检出率分别为4.5%和1.7%[2]。为了解这些健康携带者是否会成为潜在的传染源,本研究以来源于急性腹泻病患者和健康体检人员中检出的EAEC为样本,对其毒力基因携带情况,脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分型及耐药性进行比较分析。
1 材料与方法 1.1 菌株2016年经生化和PCR方法毒力基因确认[3],从急性腹泻病患者和健康体检人员的粪便、肛拭标本收集到48株EAEC。其中3家医院急性腹泻病患者分离到26株,健康体检人员(餐饮行业办理健康证人员,近期无急性腹泻)分离到22株。大肠埃希菌标准菌株ATCC25922(美国典型菌种保藏中心)。
1.2 试剂与仪器SeaKem Gold琼脂糖(美国CambrexBioScience Rockland);蛋白酶K(德国merck);限制性内切酶XbaⅠ(美国New England Biolabs);药敏板(美国Thermo Fisher Scientific);生物安全柜(美国Baker);恒温培养箱(日本SANYO);浊度仪(法国生物梅里埃);Taq酶(TaKaRa);PCR仪、电泳仪、凝胶成像系统和PFGE及配套设备(美国Bio-Rad公司)。
1.3 毒力基因检测根据文献[4-7]合成引物,经PCR扩增,1.5%凝胶成像后,检测菌株携带毒力基因pCVD432、aap、agg3、agg4、pet、air、sat的情况。PCR反应体系:模板2 μl,上、下游引物各0.5 μl,PCR Buffer 2.5 μl,dNTP 1 μl,Taq 0.5 μl,加水补足至25 μl。PCR反应条件:94 ℃ 3 min;94 ℃ 40 s,57 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min。
1.4 PFGE分型按照美国疾病预防控制中心(CDC)PulseNet制定的非O157大肠埃希菌的PFGE标准,用限制性内切酶XbaⅠ进行酶切,以沙门菌标准株H9812作为分子质量标记。主要实验参数为电压梯度6 V/cm,电场夹角120°,脉冲时间6.76~35.38 s,电泳时间18~19 h。PFGE图像用BioNumerics(Version 7.0)软件根据UPGMA(unweighted pair group-method using arithmetic averages)方法进行聚类分析。
1.5 药敏实验按照美国临床实验室标准化协会(clinical and laboratory standards institute,CLSI)推荐的微量肉汤稀释法进行体外药敏试验,选择含有氨苄西林(AMP)、氨苄西林/舒巴坦(AMS)、头孢唑啉(CFZ)、头孢他啶(CAZ)、头孢噻肟(CTX)、头孢西丁(CFX)、亚胺培南(IPM)、庆大霉素(GEN)、四环素(TET)、氯霉素(CHL)、萘啶酸(NAL)、环丙沙星(CIP)、甲氧苄啶/磺胺甲恶唑(SXT)的药敏板进行抗菌药物的最小抑菌浓度(minimum inhibitory concentration,MICs)的测定,结果判读参照CLSI《抗菌药物敏感性试验执行标准第二十五版资料增刊》 (performance standards for antimicrobial susceptibility testing; twenty-five informational supplement)进行。质控菌株为大肠埃希菌ATCC25922(美国典型菌种保藏中心)。对≥3类抗菌药物耐药判定为多重耐药。
1.6 统计学分析运用SPSS 17. 0统计软件包进行数据处理,运用χ2检验进行差异性分析。P<0.05为差异有统计学意义。
2 结果 2.1 毒力基因检测急性腹泻患者和健康体检人员分离株。7种毒力基因的检测阳性率见表 1,所有毒力基因中检出率最高的为sat(66.67%),其次为air(64.58%),aap为41.67%。其中腹泻病例中air检出率最高,健康体检人员中sat检出率最高,这2个基因都位于基因组上。位于质粒上的毒力基因中腹泻患者的阳性率略高于健康体检人员。EAEC携带毒力基因有14种组合,急性腹泻病患者和健康体检人员分离株所携带的毒力基因组合,分布有所差异,见表 2。健康体检人员中sat+air的组合出现频率最高(27.27%),其次是pCVD432 + sat + aap(9.09%)和pCVD432 + sat + aap + agg3A + agg4C(9.09%)。腹泻患者中pCVD432 + sat + aap + agg3A + agg4C + air组合最常见(11.54%),其次为pCVD432 + sat + aap + air(7.69%)和pCVD432 + sat + aap + agg3A + agg4C(7.69%)。与健康体检人员相比,腹泻病患者中分离的EAEC携带毒力基因组合更复杂。
| 毒力基因 | 组别(阳性数/总数) | P值 | |
| 腹泻患者 | 健康体检 | ||
| air | 18/26 | 13/22 | 0.551 |
| sat | 15/26 | 16/22 | 0.368 |
| pCVD432 | 8/26 | 8/22 | 0.764 |
| aap | 11/26 | 9/22 | 1.000 |
| agg3 | 7/26 | 4/22 | 0.514 |
| agg4 | 7/26 | 4/22 | 0.514 |
| pet | 2/26 | 1/22 | 1.000 |
| 毒力基因 | 腹泻患者 | 健康体检人员 | 合计 |
| 未检出毒力基因 | 1 | 1 | 2 |
| sat | 3 | 2 | 5 |
| air | 5 | 4 | 9 |
| sat + aap | 1 | 0 | 1 |
| air + aap | 1 | 0 | 1 |
| air + pet | 2 | 0 | 2 |
| sat + air | 3 | 6 | 9 |
| pCVD432 + aap | 0 | 1 | 1 |
| pCVD432 + sat + aap | 0 | 2 | 2 |
| pCVD432 + sat + aap + air | 2 | 1 | 3 |
| pCVD432 + sat + aap + pet | 0 | 1 | 1 |
| pCVD432 + sat + aap + agg3A + agg4C | 2 | 2 | 4 |
| pCVD432 + aap + agg3A + agg4C + air | 1 | 0 | 1 |
| sat + aap + agg3A + agg4C + air | 1 | 1 | 2 |
| pCVD432 + sat + aap + agg3A + agg4C + air | 3 | 1 | 4 |
48株菌EAEC中除4株菌PFGE结果降解外,共得到43种PFGE带型,带型相似度为50.9%~100%,见图 1。总体上EAEC带型呈现高度多态性,仅2株菌株具有完全一致的谱型。PFGE带型相似度高于90%的菌株检出了相同的毒力基因,其中来源于腹泻病患者的E308和E311带型相似度100%,来源于健康体检者的E286和来源于腹泻患者的E288带型相似度94.7%,这两组菌株分别具有相同的毒力基因和耐药谱。
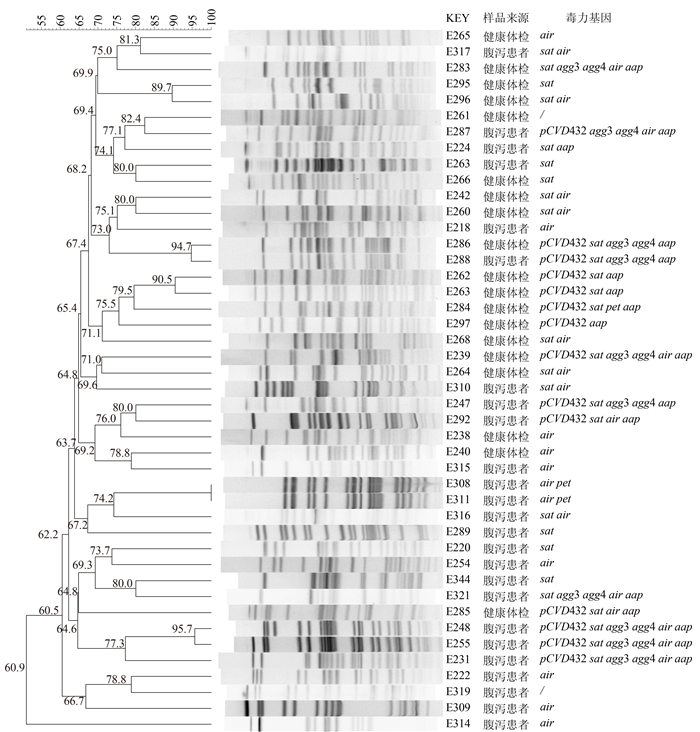
|
| 图 1 不同来源EAEC菌株的PFGE聚类分析 Figure 1 Resistances of EAEC isolates to some antibiotics |
| |
不同来源的48株EAEC耐药性结果见表 3,EAEC对亚胺培南完全敏感,对其余12种抗生素均表现出不同程度的耐药,耐受AMP(77.08%)、AMS(64.58%)、TET(62.50%)、SXT(60.42%)的能力较强。根据耐药结果,来源于腹泻患者的菌株耐药性明显较健康体检分离的菌株严重,见图 2。这一现象在β-内酰胺类药物中尤为显著,耐受CFX和CAZ的菌株均来自腹泻患者,且来源于腹泻患者的菌株耐受药物情况更复杂。另外,从菌株的多重耐药率来看,腹泻患者EAEC为41.67%,高于健康体检人员分离株的20.83%。
| 抗生素 | 腹泻患者(n =26) | 健康体检人员(n=22) | 合计(n=48) | ||||||||
| 耐药(%) | 中敏(%) | 敏感(%) | 耐药(%) | 中敏(%) | 敏感(%) | 耐药(%) | 中敏(%) | 敏感(%) | |||
| AMP | 24(92.31) | 0(0.00) | 2(7.691) | 13(59.09) | 0(0.00) | 9(40.91) | 37(77.08) | 0(0.00) | 11(22.92) | ||
| AMS | 20(76.92) | 2(7.69) | 4(15.39) | 11(50.00) | 1(4.55) | 10(45.45) | 31(64.58) | 3(6.25) | 14(29.17) | ||
| TET | 16(61.54) | 0(0.00) | 10(38.46) | 14(63.64) | 0(0.00) | 8(36.36) | 30(62.50) | 0(0.00) | 18(37.50) | ||
| SXT | 17(65.38) | 0(0.00) | 9(34.62) | 12(54.55) | 0(0.00) | 10(45.45) | 29(60.42) | 0(0.00) | 19(39.58) | ||
| NAL | 12(46.15) | 0(0.00) | 14(53.85) | 11(50.00) | 0(0.00) | 11(50.00) | 23(47.92) | 0(0.00) | 25(52.08) | ||
| CHL | 11(42.31) | 1(3.85) | 14(53.84) | 7(31.82) | 0(0.00) | 15(68.18) | 18(37.50) | 1(2.08) | 29(60.42) | ||
| CFZ | 15(57.69) | 3(11.54) | 8(30.77) | 2(9.09) | 6(27.27) | 14(63.64) | 17(35.42) | 9(18.75) | 22(45.83) | ||
| CTX | 9(34.61) | 1(3.85) | 16(61.54) | 2(9.09) | 0(0.00) | 20(90.91) | 11(22.92) | 1(2.08) | 36(75.00) | ||
| GEN | 5(19.23) | 0(0.00) | 21(80.77) | 5(22.73) | 0(0.00) | 17(77.27) | 10(20.83) | 0(0.00) | 38(79.17) | ||
| CIP | 4(15.38) | 1(3.85) | 21(80.77) | 3(13.64) | 0(0.00) | 19(86.36) | 7(14.58) | 1(2.08) | 40(83.34) | ||
| CFX | 3(11.54) | 2(7.69) | 21(80.77) | 0(0.00) | 2(9.09) | 20(90.91) | 3(6.25) | 4(8.33) | 41(85.42) | ||
| CAZ | 3(11.54) | 2(7.69) | 21(80.77) | 0(0.00) | 1(4.55) | 21(95.45) | 3(6.25) | 3(6.25) | 42(87.50) | ||
| IPM | 0(0.00) | 0(0.00) | 26(100.00) | 0(0.00) | 0(0.00) | 22(100.00) | 0(0.00) | 0(0.00) | 48(100.00) | ||
| 注:AMP为氨苄西林;AMS为氨苄西林/舒巴坦;TET为四环素;SXT为甲氧苄啶/磺胺甲恶唑;NAL为萘啶酸;CHL为氯霉素;CFZ为头孢唑啉;CTX为头孢噻肟;GEN为庆大霉素;CIP为环丙沙星;CFX为头孢西丁;CAZ为头孢他啶;IPM为亚胺培南 | |||||||||||
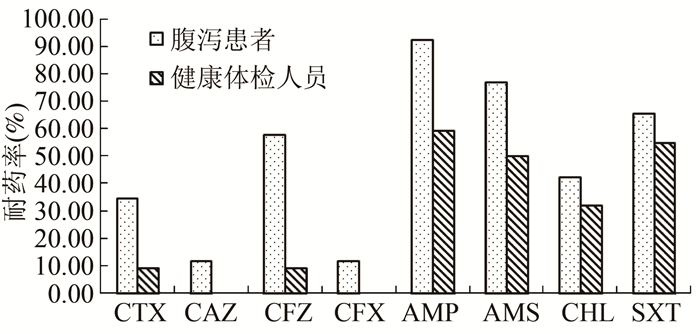
|
| 图 2 EAEC对部分抗生素耐药情况 Figure 2 Resistances of EAEC isolates to some antibiotics 注:CTX为头孢噻肟;CAZ为头孢他啶;CFZ为头孢唑啉;CFX为头孢西丁;AMP为氨苄西林;AMS为氨苄西林/舒巴坦;CHL为氯霉素;SXT为甲氧苄啶/磺胺甲恶唑 |
| |
EAEC作为一种新发现的病原菌,正逐渐被认为是导致健康成年人和儿童散发性腹泻的主要原因。在近期的研究中发现健康老年人肠道的EAEC检出率为10%,且产β-内酰胺酶的EAEC菌株的携带率为56.25%[8]。近年来国内外的研究显示EAEC在健康人群中有较高携带率,且耐药性较强,因此,针对健康人群与腹泻患者间EAEC分离株的比较研究有助于了解EAEC的致病机制。
在本研究中,48株EAEC除IPM外对其余所有的抗菌药物均表现出不同程度的耐受,对AMP、AMS、TET、SXT表现出较高耐药性,与国内外相关研究报道相似[9-11]。值得注意的是,来自腹泻病患者的EAEC耐药性普遍要高于健康体检人员,特别是对于β-内酰胺类药物的耐药性,来源于健康体检人员的EAEC对于CFX和CAZ完全敏感,而来源于腹泻患者的EAEC对这两种药物都有11.54%的耐药率。此外,从腹泻患者中分离到的EAEC有41.67%为多重耐药,是健康体检人员分离株(20.83%)的2倍。该结果也提示临床应合理用药,以减少多重耐药菌的产生。
EAEC有多种毒力基因,有学者曾对不同来源的EAEC毒力基因检出率差异进行研究,发现一些毒力基因与菌株来源有关联性[12]。本文选取了7个毒力基因进行检测,它们的携带率可能与来源相关。结果表明,源自腹泻患者的分离株中检出率最高为air,健康体检人员分离株检出率最高为sat,在相关研究中发现sat与健康体检人员分离株关系密切,pet和aap与腹泻患者关系密切[11, 13],这些论点在本研究中也得到一定程度的验证。agg3和agg4分别编码EAEC不同类型的菌毛抗原,因aap编码的表面分散蛋白可使菌毛张开,使得这种蛋白对于EAEC的黏附非常重要。本研究中,agg3、agg4在腹泻病例中的检出率略高于健康体检,且检出agg3和agg4的菌株也同时检出aap。pCVD432编码抗集聚蛋白转运蛋白[14-15],在两种来源中的携带率差异较小。在所检测的7个毒力基因中,air与sat位于基因组,其余5个基因均位于质粒上,大部分EAEC中的质粒共用一个相同的质粒骨架和元件,但质粒上基因的位置与组合方式各有不同,因此EAEC的毒力基因具有复杂的多样性[16]。
48株EAEC共得到43种PFGE带型,表明EAEC的PFGE带型呈现高度多态性,在其他研究者的报道中也得到相同结果[17]。本研究中PFGE带型相似度高于90%的菌株携带相同的毒力基因,其中两组更是有一致的耐药谱,对于此类菌株PFGE带型和毒力基因与耐药谱之间的关系,还需要结合流行病学开展进一步研究。
本文对不同来源EAEC分离株的毒力基因、耐药性和PFGE进行分析,不同来源EAEC携带的毒力基因差异不显著,PFGE带型呈高度多态性,来源于腹泻患者的EAEC耐药性高于健康体检人员,同时研究结果也为本地区的临床用药和分子溯源提供了数据支持。
作者贡献:
杜悦 ORCID:0000-0003-4578-7436
杜悦:文章撰写,实验主要完成者
王红、苏爱荣、韦程媛:参与药敏与PFGE实验
李秀桂、谭冬梅、黄彦:实验设计,数据复核
| [1] |
Jiang ZD, Okhuysen PC, Guo DC, et al. Genetic susceptibility to enteroaggregative Escherichia coli diarrhea:polymorphism in the interleukin-8 promotor region[J]. J Infect Dis, 2003, 188(4): 506-511. DOI:10.1086/jid.2003.188.issue-4 |
| [2] |
Nataro JP, Mai V, Johnson J, et al. Diarrheagenic Escherichia coli infection in Baltimore, Maryland, and new haven, Connecticut[J]. Clin Infect Dis, 2006, 43(4): 402-407. DOI:10.1086/505867 |
| [3] |
Müller D, Greune L, Heusipp G, et al. Identification of unconventional intestinal pathogenic Escherichia coli isolates expressing intermediate virulence factor profiles by using a novel single-step multiplex PCR[J]. Appl Environ Microbiol, 2007, 73(10): 3380-3390. DOI:10.1128/AEM.02855-06 |
| [4] |
Schmid H, Knop C, Franke S, et al. Development of PCR for screening of enteroaggregative Escherichia coli[J]. J Clin Microbiol, 1995, 33(3): 701-705. |
| [5] |
Boisen N, Scheutz F, Rasko DA, et al. Genomic characterization of enteroaggregative Escherichia coli from children in mali[J]. J Infect Dis, 2012, 205(3): 431-444. DOI:10.1093/infdis/jir757 |
| [6] |
Restieri C, Garriss G, Locas MC, et al. Autotransporter-encoding sequences are phylogenetically distributed among Escherichia coli clinical isolates and reference strains[J]. Appl Environ Microbiol, 2007, 73(5): 1553-1562. DOI:10.1128/AEM.01542-06 |
| [7] |
Boisen N, Ruiz-Perez F, Scheutz F, et al. Short report:high prevalence of serine protease autotransporter cytotoxins among strains of enteroaggregative Escherichia coli[J]. Am J Trop Med Hyg, 2009, 80(2): 294-301. |
| [8] |
Xu JY, Wang Y, Luo F, et al. Research on the virulence genes of ESBL and EAEC in the healthy elder[J]. Chinese Journal of Health Laboratory Technology, 2016, 26(6): 768-771. (in Chinese) 许江燕, 王原, 骆丰, 等. 健康老年人肠道中肠集聚性大肠埃希菌毒力基因及超广谱β内酰胺酶的研究[J]. 中国卫生检验杂志, 2016, 26(6): 768-771. |
| [9] |
Shen JL, Pan YP, Xu YH, et al. Susceptibility of Escherichia coli strains in hospitals across China:results from the CHINET Antimicrobial Resistance Surveillance Program, 2005-2014[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(2): 129-140. (in Chinese) 沈继录, 潘亚萍, 徐元宏, 等. 2005-2014年CHINET大肠埃希菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 129-140. |
| [10] |
Cui EB, Chen SM, Zhang CL, et al. Distribution of the community-acquired bacterial diarrheal pathogens and drug resistance in 16 provinces or cities in China during 2009-2013[J]. Infectious Disease Information, 2014, 27(3): 143-147. (in Chinese) 崔恩博, 陈素明, 张成龙, 等. 2009-2013年我国16省市社区获得性细菌性腹泻病原菌分布及临床耐药分析[J]. 传染病信息, 2014, 27(3): 143-147. |
| [11] |
Bafandeh S, Haghi F, Zeighami H. Prevalence and virulence characteristics of enteroaggregative Escherichia coli in a case-control study among patients from Iran[J]. J Med Microbiol, 2015, 64(5): 519-524. DOI:10.1099/jmm.0.000055 |
| [12] |
Nüesch-Inderbinen MT, Hofer E, Hächler H, et al. Characteristics of enteroaggregative Escherichia coli isolated from healthy carriers and from patients with diarrhoea[J]. J Med Microbiol, 2013, 62(Pt 12): 1828-1834. |
| [13] |
Lima IFN, Boisen N, da Quetz Silva J, et al. Prevalence of enteroaggregative Escherichia coli and its virulence-related genes in a case-control study among children from north-eastern Brazil[J]. J Med Microbiol, 2013, 62(Pt 5): 683-393. |
| [14] |
Baudry B, Savarino SJ, Vial P, et al. A sensitive and specific DNA probe to identify enteroaggregative Escherichia coli, a recently discovered diarrheal pathogen[J]. J Infect Dis, 1990, 161(6): 1249-1251. DOI:10.1093/infdis/161.6.1249 |
| [15] |
Nishi J, Sheikh J, Mizuguchi K, et al. The export of coat protein from enteroaggregative Escherichia coli by a specific ATP-binding cassette transporter system[J]. J Biol Chem, 2003, 278(46): 45680-45689. DOI:10.1074/jbc.M306413200 |
| [16] |
Johnson TJ, Nolan LK. Pathogenomics of the virulence plasmids of Escherichia coli[J]. Microbiol Mol Biol Rev, 2010, 74(3): 477-478. DOI:10.1128/MMBR.00002-10 |
| [17] |
Li DX, Peng H, Wen YH, et al. Antibiotic resistance and pulsed-field gel electophoresis molecular type of diarrhoeagenic Escherichia coli isolated in Changping district of Beijing, 2015[J]. Disease Surveillance, 2017, 32(3): 247-251. (in Chinese) 李东迅, 彭华, 闻艳红, 等. 2015年北京市昌平区致泻性大肠埃希菌耐药性及脉冲场凝胶电泳分型研究[J]. 疾病监测, 2017, 32(3): 247-251. |
 2017, Vol. 32
2017, Vol. 32


